Алкан - Alkane

В органическая химия, алкан, или же парафин (историческое название, которое также другие значения ), является ациклический насыщенный углеводород. Другими словами, алкан состоит из водород и углерод атомы расположены в дерево структура, в которой все углерод-углеродные связи находятся Один.[1] Алканы имеют общую химическую формулу CпЧАС2п+2. Алканы варьируются по сложности от простейшего случая метан (CH4), куда п = 1 (иногда называемой родительской молекулой) до сколь угодно больших и сложных молекул, например пентаконтан (C50ЧАС102) или 6-этил-2-метил-5- (1-метилэтил) октан, изомер из тетрадекан (C14ЧАС30).
Международный союз теоретической и прикладной химии определяет алканы как «ациклические разветвленные или неразветвленные углеводороды, имеющие общую формулу CпЧАС2п+2, и поэтому состоящий полностью из атомов водорода и насыщенных атомов углерода ". Однако в некоторых источниках этот термин используется для обозначения любой насыщенные углеводороды, включая те, которые являются моноциклическими (т.е. циклоалканы ) или полициклический,[2] несмотря на то, что они имеют четкую общую формулу (т.е.циклоалканы представляют собой CпЧАС2п).
В алкане каждый атом углерода равен зр3-гибридизированный с 4 сигма-облигации (либо C – C, либо C – H ), и каждый атом водорода соединен с одним из атомов углерода (связью C – H). Самый длинный ряд связанных атомов углерода в молекуле известен как ее углеродный скелет или углеродная основа. Число атомов углерода можно рассматривать как размер алкана.
Одна группа высшие алканы находятся воск, твердых тел в стандартная температура и давление окружающей среды (SATP), для которого количество атомов углерода в углеродной основной цепи больше примерно 17 с их повторяющимися –CH2 единиц, алканы составляют гомологическая серия органических соединений, в которых члены различаются молекулярная масса кратно 14,03ты (общая масса каждого такого метиленовый мостик единица, состоящая из одного атома углерода с массой 12.01 u и двух атомов водорода с массой ~ 1.01 u каждый).
Метан производится метаногенные бактерии а некоторые длинноцепочечные алканы действуют как феромоны у определенных видов животных или как защитные воски у растений и грибов. Тем не менее, у большинства алканов мало биологическая активность. Их можно рассматривать как молекулярные деревья, на которые можно повесить более активные / реактивные. функциональные группы биологических молекул.
Алканы имеют два основных коммерческих источника: нефть (сырая нефть)[3] и натуральный газ.
An алкил Группа представляет собой молекулярный фрагмент на основе алкана, который имеет одну открытую валентность для связывания. Обычно они сокращаются до символа любой органильной группы, R, хотя Alk иногда используется для специфического обозначения алкильной группы (в отличие от алкенильной группы или арильной группы).
Структура и классификация
Насыщенные углеводороды углеводороды имея только одинарные ковалентные связи между атомами углерода. Они могут быть:
- линейный (общая формула C
пЧАС
2п+2), в котором атомы углерода объединены в змеевидную структуру - разветвленный (общая формула C
пЧАС
2п+2, п > 2) в котором углеродная основа отщепляется в одном или нескольких направлениях - циклический (общая формула C
пЧАС
2п, п > 3), в котором углеродная основная цепь связана с образованием петли.
Согласно определению ИЮПАК, первые два - алканы, а третья группа называется циклоалканы.[1] Насыщенные углеводороды также могут сочетать любую из линейных, циклических (например, полициклических) или разветвленных структур; общая формула C
пЧАС
2п−2k+2, куда k - количество независимых шлейфов. Алканы - это ациклический (без петель), соответствующие k = 0.
Изомерия
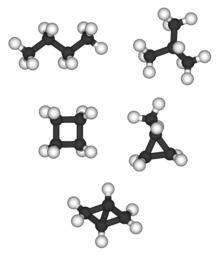
Бицикло [1.1.0] бутан единственный C4ЧАС6 алкан и не имеет изомера алкана; тетраэдран (ниже) - единственный C4ЧАС4 алкан и поэтому не имеет изомера алкана.
Алканы с более чем тремя углерод атомы могут быть расположены по-разному, образуя структурные изомеры. Самый простой изомер алкана - это тот, в котором атомы углерода расположены в единую цепь без разветвлений. Этот изомер иногда называют п-изомер (п для «нормального», хотя и не обязательно самого распространенного). Однако цепь атомов углерода также может быть разветвленной в одной или нескольких точках. Число возможных изомеров быстро увеличивается с увеличением числа атомов углерода. Например, для ациклических алканов:[4]
- C1: метан Только
- C2: этан Только
- C3: пропан Только
- C4: 2 изомера: бутан и изобутан
- C5: 3 изомера: пентан, изопентан, и неопентан
- C6: 5 изомеры: гексан, 2-метилпентан, 3-метилпентан, 2,2-диметилбутан, и 2,3-диметилбутан
- C7: 9 изомеры: гептан, метилгексан (2 изомера), диметилпентан (4 изомера), 3-этилпентан, 2,2,3-триметилбутан
- C12: 355 изомеров
- C32: 27,711,253,769 изомеров
- C60: 22 158 734 535 770 411 074 184 изомеров, многие из которых нестабильны.
Разветвленные алканы могут быть хиральный. Например, 3-метилгексан и его выше гомологи хиральны из-за их стереогенный центр у атома углерода номер 3. Приведенный выше список включает только различия связности, но не стереохимии. Помимо изомеров алканов, цепь атомов углерода может образовывать одно или несколько колец. Такие соединения называются циклоалканы, а также исключены из приведенного выше списка, поскольку изменение количества колец меняет молекулярная формула. Циклобутан и метилциклопропан являются изомерами друг друга, но не являются изомерами бутана.
Номенклатура
В Номенклатура ИЮПАК (систематический способ наименования соединений) для алканов основан на идентификации углеводородных цепей. Неразветвленные насыщенные углеводородные цепи систематически обозначаются греческим числовым префиксом, обозначающим количество атомов углерода, и суффиксом «-ан».[5]
В 1866 г. Август Вильгельм фон Хофманн предложили систематизировать номенклатуру, используя всю последовательность гласных a, e, i, o и u для создания суффиксов -ane, -ene, -ine (или -yne), -one, -une, для углеводороды CпЧАС2п+2, СпЧАС2п, СпЧАС2п−2, СпЧАС2п−4, СпЧАС2п−6.[6] Итак, первые три называют углеводороды с одинарными, двойными и тройными связями;[7] "-one" представляет собой кетон; «-ol» представляет собой спирт или группу ОН; «-oxy-» означает эфир и относится к кислороду между двумя атомами углерода, так что метоксиметан - это название ИЮПАК для диметиловый эфир.
Трудно или невозможно найти соединения с более чем одним ИЮПАК имя. Это связано с тем, что более короткие цепи, прикрепленные к более длинным цепям, являются префиксами, и соглашение включает скобки. Цифры в названии, обозначающие, к какому углероду присоединена группа, должны быть как можно меньше, чтобы подразумевалось 1- и обычно опускалось в названиях органических соединений только с одной боковой группой. У симметричных соединений будет два способа получить одно и то же имя.
Линейные алканы
Алканы с прямой цепью иногда обозначаются префиксом «н-» или «п- "(для" нормального "), где нелинейный изомер существуют. Хотя это не является строго необходимым, использование по-прежнему является обычным в случаях, когда имеется важное различие в свойствах между изомерами с прямой и разветвленной цепью, например, п-гексан или 2- или 3-метилпентан. Альтернативные названия для этой группы: линейные парафины или же п-парафины.
Члены ряда (по количеству атомов углерода) названы следующим образом:
- метан
- CH4 - один углерод и 4 водорода
- этан
- C2ЧАС6 - два углерода и 6 водорода
- пропан
- C3ЧАС8 - три углерода и 8 водорода
- бутан
- C4ЧАС10 - четыре углерода и 10 водорода
- пентан
- C5ЧАС12 - пять атомов углерода и 12 водорода
- гексан
- C6ЧАС14 - шесть углеродов и 14 водорода
Первые четыре имени были полученный из метанол, эфир, пропионовая кислота и Масляная кислота, соответственно (гексадекан также иногда называют цетаном). Алканы с пятью или более атомами углерода называют добавлением суффикс -ан к соответствующему числовой множитель префикс[8] с элизия любой конечной гласной (-а или же -о) от основного числового члена. Следовательно, пентан, С5ЧАС12; гексан, С6ЧАС14; гептан, С7ЧАС16; октан, С8ЧАС18; Приставка обычно греческая, однако алканы с числом атомов углерода, оканчивающимся на девять, например нонан, использовать латинский префикс не-. Для более полного списка см. Список алканов.
Разветвленные алканы

Простые разветвленные алканы часто имеют общее название, в котором используется префикс, чтобы отличить их от линейных алканов, например п-пентан, изопентан, и неопентан.
Соглашения об именах ИЮПАК могут использоваться для создания систематического имени.
Ключевые шаги в названии более сложных разветвленных алканов следующие:[9]
- Определите самую длинную непрерывную цепочку атомов углерода
- Назовите эту самую длинную корневую цепочку, используя стандартные правила именования
- Назовите каждую боковую цепь, изменив суффикс названия алкана с «-ан» на «-ил».
- Пронумеруйте самую длинную непрерывную цепь, чтобы дать минимально возможное количество боковых цепей.[10]
- Пронумеруйте и назовите боковые цепи перед названием корневой цепи.
- Если есть несколько боковых цепей одного и того же типа, используйте префиксы, такие как «ди-» и «три-», чтобы указать их как таковые, и пронумеруйте каждую из них.
- Добавьте имена боковых цепей в алфавитном порядке (без учета префиксов «ди-» и т. Д.) Перед именем корневой цепочки.
| Распространенное имя | п-пентан | изопентан | неопентан |
|---|---|---|---|
| Название ИЮПАК | пентан | 2-метилбутан | 2,2-диметилпропан |
| Структура |  |  |
Насыщенные циклические углеводороды
Хотя этот класс углеводородов технически отличается от алканов, некоторые называют его «циклическими алканами». Как следует из их описания, они содержат одно или несколько колец.
Простые циклоалканы имеют приставку «цикло-», чтобы отличать их от алканов. Циклоалканы названы в соответствии с их ациклическими аналогами в зависимости от числа атомов углерода в их основных цепях, например, циклопентан (C5ЧАС10) представляет собой циклоалкан с 5 атомами углерода, как и пентан (C5ЧАС12), но они объединены в пятичленное кольцо. Аналогичным образом пропан и циклопропан, бутан и циклобутан, так далее.
Замещенные циклоалканы названы аналогично замещенным алканам - указано циклоалкановое кольцо, а заместители указаны в соответствии с их положением в кольце, а нумерация определяется Правила приоритета Кана – Ингольда – Прелога.[8]
Тривиальные / распространенные имена
Тривиальный (не-систематический ) название алканов - парафины. Вместе алканы известны как «парафиновая серия». Тривиальные названия соединений обычно являются историческими артефактами. Они были придуманы до появления систематических названий и были сохранены благодаря привычному использованию в промышленности. Циклоалканы еще называют нафтенами.
Почти наверняка термин «парафин» происходит от нефтехимическая промышленность. Алканы с разветвленной цепью называются изопарафины. Использование термина «парафин» является общим термином и часто не делает различий между чистыми соединениями и смесями изомеры, т.е. соединения одного и того же химическая формула, например, пентан и изопентан.
- В ИЮПАК
Следующие тривиальные имена сохранены в системе IUPAC:
- Не-ИЮПАК
Иногда используются некоторые тривиальные имена, не относящиеся к IUPAC:
- цетан, для гексадекан
- cerane, для гексакозан[11]
Физические свойства
Все алканы бесцветны.[12][13] Алканы с наименьшей молекулярной массой - это газы, с промежуточной молекулярной массой - жидкости, а самые тяжелые - это воскообразные твердые вещества.
Таблица алканов
| Алкан | Формула | Точка кипения [° C] | Точка плавления [° C] | Плотность [кг / м3] (при 20 ° C) | Изомеры |
| Метан | CH4 | -162 | −182 | 0,656 (газ) | 1 |
| Этан | C2ЧАС6 | −89 | −183 | 1,26 (газ) | 1 |
| Пропан | C3ЧАС8 | −42 | −188 | 2,01 (газ) | 1 |
| Бутан | C4ЧАС10 | 0 | −138 | 2,48 (газ) | 2 |
| Пентан | C5ЧАС12 | 36 | −130 | 626 (жидкость) | 3 |
| Гексан | C6ЧАС14 | 69 | −95 | 659 (жидкость) | 5 |
| Гептан | C7ЧАС16 | 98 | −91 | 684 (жидкость) | 9 |
| Октан | C8ЧАС18 | 126 | −57 | 703 (жидкость) | 18 |
| Нонан | C9ЧАС20 | 151 | −54 | 718 (жидкость) | 35 |
| Decane | C10ЧАС22 | 174 | −30 | 730 (жидкость) | 75 |
| Ундекан | C11ЧАС24 | 196 | −26 | 740 (жидкость) | 159 |
| Додекан | C12ЧАС26 | 216 | −10 | 749 (жидкость) | 355 |
| Тридекан | C13ЧАС28 | 235 | -5.4 | 756 (жидкость) | 802 |
| Тетрадекан | C14ЧАС30 | 253 | 5.9 | 763 (жидкость) | 1858 |
| Пентадекан | C15ЧАС32 | 270 | 10 | 769 (жидкость) | |
| Гексадекан | C16ЧАС34 | 287 | 18 | 773 (жидкость) | |
| Гептадекан | C17ЧАС36 | 303 | 22 | 777 (сплошной) | |
| Октадекан | C18ЧАС38 | 317 | 28 | 781 (сплошной) | |
| Нонадекан | C19ЧАС40 | 330 | 32 | 785 (цельный) | |
| Икосан | C20ЧАС42 | 343 | 37 | 789 (сплошной) | |
| Триаконтан | C30ЧАС62 | 450 | 66 | 810 (сплошной) | |
| Тетраконтан | C40ЧАС82 | 525 | 82 | 817 (сплошной) | |
| Пентаконтане | C50ЧАС102 | 575 | 91 | 824 (сплошной) | |
| Гексаконтан | C60ЧАС122 | 625 | 100 | 829 (цельный) | |
| Гептаконтан | C70ЧАС142 | 653 | 109 | 869 (цельный) |
Точка кипения

Алканы испытывают межмолекулярные силы Ван дер Ваальса. Более сильные межмолекулярные силы Ван-дер-Ваальса приводят к более высоким температурам кипения алканов.[14]
Есть два определяющих фактора силы Ван-дер-Ваальса:
- количество электронов, окружающих молекула, которая увеличивается с увеличением молекулярной массы алкана
- площадь поверхности молекулы
Под стандартные условия, из CH4 в C4ЧАС10 алканы газообразные; из C5ЧАС12 в C17ЧАС36 они жидкости; а после C18ЧАС38 они твердые. Поскольку температура кипения алканов в первую очередь определяется массой, неудивительно, что температура кипения имеет почти линейную зависимость от размера (молекулярный вес ) молекулы. Как показывает практика, точка кипения повышается на 20–30 ° C для каждого углерода, добавляемого в цепь; это правило применяется к другим гомологичным сериям.[14]
Алкан с прямой цепью будет иметь температуру кипения выше, чем алкан с разветвленной цепью, из-за большей площади поверхности, контактирующей с соседними молекулами, и, следовательно, более высоких сил Ван-дер-Ваальса. Например, сравните изобутан (2-метилпропан) и н-бутан (бутан), которые кипят при -12 и 0 ° C, и 2,2-диметилбутан и 2,3-диметилбутан, которые кипят при 50 и 58 ° C соответственно.[14] В последнем случае две молекулы 2,3-диметилбутана могут «сцепляться» друг с другом лучше, чем крестообразный 2,2-диметилбутан, отсюда и большие силы Ван-дер-Ваальса.
С другой стороны, циклоалканы имеют тенденцию иметь более высокие температуры кипения, чем их линейные аналоги из-за заблокированных конформаций молекул, которые создают плоскость межмолекулярного контакта.[15]
Точки плавления
В точки плавления алканов следуют аналогичной тенденции к точки кипения по той же причине, что указана выше. То есть (при прочих равных) чем больше молекула, тем выше температура плавления. Есть одно существенное различие между температурами кипения и плавления. Твердые тела имеют более жесткую и фиксированную структуру, чем жидкости. Эта жесткая конструкция требует энергии для разрушения. Таким образом, для разрушения более прочных твердых конструкций потребуется больше энергии. Для алканов это видно из графика выше (то есть синей линии). Алканы с нечетными номерами имеют более низкую тенденцию к температуре плавления, чем алканы с четными номерами. Это связано с тем, что даже пронумерованные алканы хорошо упаковываются в твердой фазе, образуя хорошо организованную структуру, для разрушения которой требуется больше энергии. Алканы с нечетными номерами упаковываются хуже, поэтому «более рыхлая» организованная твердая структура упаковки требует меньше энергии для разрушения.[16] Для визуализации кристаллических структур см.[17]
Температуры плавления алканов с разветвленной цепью могут быть выше или ниже, чем у соответствующих алканов с прямой цепью, опять же, в зависимости от способности рассматриваемого алкана хорошо упаковываться в твердой фазе: это особенно верно для изоалканы (2-метильные изомеры), которые часто имеют температуры плавления выше, чем у линейных аналогов.
Электропроводность и растворимость
Алканы никоим образом не проводят электричество и не имеют существенного поляризованный по электрическое поле. По этой причине они не образуют водородные связи и нерастворимы в полярных растворителях, таких как вода. Так как водородные связи между отдельными молекулами воды выровнены от молекулы алкана, сосуществование алкана и воды приводит к увеличению молекулярного порядка (снижение энтропия ). Поскольку между молекулами воды и молекулами алканов нет значительной связи, второй закон термодинамики предполагает, что это снижение энтропии должно быть минимизировано путем сведения к минимуму контакта между алканом и водой: алканы, как говорят, гидрофобный поскольку они отталкивают воду.
Их растворимость в неполярных растворителях относительно высока, и это свойство называется липофильность. Например, алканы могут смешиваться между собой во всех пропорциях.
Плотность алканов обычно увеличивается с увеличением числа атомов углерода, но остается меньшей, чем у воды. Следовательно, алканы образуют верхний слой в смеси алкан – вода.
Молекулярная геометрия

Молекулярная структура алканов напрямую влияет на их физические и химические характеристики. Это получено из электронная конфигурация из углерод, который имеет четыре валентные электроны. Атомы углерода в алканах всегда sp.3-гибридизированный, то есть валентные электроны, как говорят, находятся на четырех эквивалентных орбиталях, полученных из комбинации 2s-орбиталей и трех 2p-орбиталей. Эти орбитали, имеющие одинаковую энергию, пространственно расположены в виде тетраэдр, угол cos−1(−1/3) ≈ 109,47 ° между ними.
Длины скрепления и валентные углы
Алкан имеет только одинарные связи C – H и C – C. Первый результат перекрытия зр.3 орбиталь углерода с 1-й орбиталью водорода; последний за счет перекрытия двух зр.3 орбитали на соседних атомах углерода. В длина облигаций составляют 1,09 × 10−10 м для связи C – H и 1,54 × 10−10 м для связи C – C.

Пространственное расположение связей аналогично расположению четырех прядей.3 орбитали - они расположены тетраэдрически, с углом между ними 109,47 °. Структурные формулы, которые представляют связи как находящиеся под прямым углом друг к другу, хотя и являются общими и полезными, не соответствуют действительности.
Конформация
Структурная формула и валентные углы обычно не достаточно для полного описания геометрии молекулы. Есть еще степень свободы для каждой углерод-углеродной связи: угол кручения между атомами или группами, связанными с атомами на каждом конце связи. Пространственное расположение, описываемое торсионными углами молекулы, известно как ее конформация.


Этан представляет собой простейший случай для изучения конформации алканов, так как существует только одна связь C – C. Если посмотреть вниз по оси связи C – C, можно увидеть так называемый Проекция Ньюмана. Атомы водорода как на переднем, так и на заднем атоме углерода имеют угол 120 ° между собой, что является результатом проекции основания тетраэдра на плоскую плоскость. Однако торсионный угол между данным атомом водорода, присоединенным к переднему углероду, и данным атомом водорода, присоединенным к заднему атому углерода, может свободно изменяться от 0 ° до 360 °. Это следствие свободного вращения вокруг одинарной связи углерод – углерод. Несмотря на эту кажущуюся свободу, важны только две ограничивающие конформации: затмил конформация и шахматное строение.
Две конформации различаются по энергии: ступенчатая конформация на 12,6 кДж / моль ниже по энергии (более стабильна), чем затменная конформация (наименее устойчивая).
Эта разница в энергии между двумя конформациями, известная как энергия кручения, мала по сравнению с тепловой энергией молекулы этана при температуре окружающей среды. Существует постоянное вращение вокруг связи C – C. Время, за которое молекула этана переходит от одной ступенчатой конформации к другой, что эквивалентно вращению одного CH3 группа на 120 ° относительно другой, порядка 10−11 секунд.
Случай высшие алканы более сложен, но основан на схожих принципах, при этом антиперипланарная конформация всегда является наиболее предпочтительной для каждой углерод-углеродной связи. По этой причине алканы обычно изображаются зигзагообразно на схемах или в моделях. Фактическая структура всегда будет несколько отличаться от этих идеализированных форм, поскольку различия в энергии между конформациями невелики по сравнению с тепловой энергией молекул: молекулы алканов не имеют фиксированной структурной формы, что бы ни предлагали модели.
Спектроскопические свойства
Практически все органические соединения содержат углерод-углеродные и углерод-водородные связи, поэтому в своих спектрах проявляются некоторые особенности алканов. Алканы примечательны тем, что не имеют других групп, и поэтому отсутствие других характерных спектроскопических особенностей функциональной группы, таких как -ОЙ, –CHO, –COOH и Т. Д.
ИК-спектроскопия
Режим растяжения углерод-водород дает сильное поглощение между 2850 и 2960см−1, а валентная мода углерод – углерод поглощает от 800 до 1300 см−1. Изгибные режимы углерод-водород зависят от природы группы: метильные группы показывают полосы при 1450 см−1 и 1375 см−1, а метиленовые группы показывают полосы на 1465 см−1 и 1450 см−1. Углеродные цепи с более чем четырьмя атомами углерода демонстрируют слабое поглощение на уровне около 725 см.−1.
ЯМР-спектроскопия
Протонные резонансы алканов обычно находятся при δЧАС = 0,5–1,5. Резонансы углерода-13 зависят от числа атомов водорода, присоединенных к углероду: δC = 8–30 (первичный, метил, –CH3), 15–55 (вторичный, метилен, –CH2-), 20–60 (третичный, метил, C – H) и четвертичный. Углерод-13-резонанс четвертичных атомов углерода обычно слабый из-за отсутствия ядерный эффект Оверхаузера и длинный время отдыха, и могут быть пропущены в слабых выборках или в выборках, которые не обрабатывались в течение достаточно долгого времени.
Масс-спектрометрии
Алканы обладают высоким энергия ионизации, а молекулярный ион обычно слабый. Характер фрагментации может быть трудно интерпретировать, но в случае алканов с разветвленной цепью углеродная цепь предпочтительно расщепляется по третичным или четвертичным атомам углерода из-за относительной стабильности образующихся свободные радикалы. Фрагмент, образовавшийся в результате потери одной метильной группы (M - 15) часто отсутствует, а другие фрагменты часто разделены интервалами в четырнадцать единиц массы, что соответствует последовательной потере СН2 группы.
Химические свойства
Алканы слабо реагируют с большинством химических соединений. В константа диссоциации кислоты (пKа) значения всех алканов оцениваются в диапазоне от 50 до 70, в зависимости от метода экстраполяции, следовательно, они являются чрезвычайно слабыми кислотами, которые практически инертны по отношению к основаниям (см .: угольные кислоты ). Они также являются чрезвычайно слабыми основаниями, не претерпевающими заметного протонирования в чистой серной кислоте (ЧАС0 ~ –12), хотя суперкислоты которые по крайней мере в миллионы раз сильнее, как известно, протонируют их с образованием гиперкоординированных ионов алкана (см .: ион метания ). Точно так же они проявляют реактивность только с самыми сильными электрофильными реагентами (например, диоксираны и соли, содержащие NF4+ катион ). Благодаря прочным связям C – H (~ 100 ккал / моль) и C-C (~ 90 ккал / моль, но обычно менее стерически доступным) они также относительно инертны по отношению к свободным радикалам, хотя многие электронодефицитные радикалы будет реагировать с алканами в отсутствие других богатых электронами связей (см. ниже). Эта инертность является источником термина парафины (со значением здесь «отсутствие близости»). В сырая нефть молекулы алканов оставались химически неизменными в течение миллионов лет.
Свободные радикалы, молекулы с неспаренными электронами, играют большую роль в большинстве реакций алканов, таких как крекинг и реформация, когда длинноцепочечные алканы превращаются в алканы с более короткой цепью, а алканы с прямой цепью - в изомеры с разветвленной цепью. Более того, окислительно-восстановительные реакции алканов с участием свободнорадикальных промежуточных соединений, в частности с кислородом и галогенами, возможны, поскольку атомы углерода находятся в сильно восстановленном состоянии; в случае метана углерод находится в самой низкой возможной степени окисления (-4). Реакция с кислородом (если присутствует в количестве, достаточном для протекания реакции стехиометрия ) приводит к горению без дыма с образованием углекислый газ и вода. Свободнорадикальное галогенирование происходят реакции с галогенами, приводящие к образованию галогеналканы. Кроме того, было показано, что алканы взаимодействуют с некоторыми комплексами переходных металлов и связываются с ними. Активация связи C – H реакции.
В сильно разветвленных алканах валентный угол может значительно отличаться от оптимального значения (109,5 °) для размещения объемных групп. Такие искажения вносят в молекулу напряжение, известное как стерическое препятствие или напряжение. Деформация существенно увеличивает реактивность.
Однако в целом и, возможно, удивительно, когда разветвление недостаточно обширно для создания крайне неблагоприятных 1,2- и 1,3-алкил-алкил-стерических взаимодействий (около 3,1 ккал / моль и ~ 3,7 ккал / моль в случае Затмевая конформации бутана и пентана соответственно) неизбежно, разветвленные алканы на самом деле более термодинамически стабильны, чем их линейные (или менее разветвленные) изомеры. Например, сильно разветвленный 2,2,3,3-тетраметилбутан примерно на 1,9 ккал / моль более стабилен, чем его линейный изомер, п-октан.[18] Из-за тонкости этого эффекта точные причины этого правила активно обсуждаются в химической литературе, но до сих пор не выяснены. Несколько объяснений, включая стабилизацию разветвленных алканов электронной корреляцией,[19] дестабилизация линейных алканов стерическим отталкиванием,[20] стабилизация нейтральным сверхсопряжением,[21][18] и / или электростатические эффекты[22] были выдвинуты как возможности. Споры связаны с вопросом о том, является ли традиционное объяснение гиперконъюгации основным фактором, определяющим стабильность алкильных радикалов.[23][20]
Реакции с кислородом (реакция горения)
Все алканы реагируют с кислород в горение реакции, хотя их становится все труднее воспламенить по мере увеличения количества атомов углерода. Общее уравнение полного сгорания:
- CпЧАС2п+2 + (3/2п + 1/2) O2 → (п + 1) H2O + п CO2
- или CпЧАС2п+2 + (3п + 1/2) O2 → (п + 1) H2O + п CO2
В отсутствие достаточного количества кислорода монооксид углерода или даже сажа могут быть сформированы, как показано ниже:
Например, метан:
- 2 канала4 + 3 O2 → 2 СО + 4 Н2О
- CH4 + 3/2 О2 → CO + 2 H2О
Увидеть алкановая теплота образования таблица для получения подробных данных. стандартное изменение энтальпии сгорания, ΔcЧАС⊖, для алканов увеличивается примерно на 650 кДж / моль на CH2 группа. Алканы с разветвленной цепью имеют более низкие значения ΔcЧАС⊖ чем линейные алканы с тем же числом атомов углерода, и поэтому можно видеть, что они несколько более стабильны.
Реакции с галогенами
Алканы реагируют с галогены в так называемом свободнорадикальное галогенирование реакция. Атомы водорода алкана постепенно заменяются атомами галогена. Свободные радикалы являются реактивными частицами, которые участвуют в реакции, которая обычно приводит к смеси продуктов. Реакция очень экзотермический, и может привести к взрыву.
Эти реакции являются важным промышленным путем получения галогенированных углеводородов. Есть три шага:
- Посвящение галогенные радикалы образуются гомолиз. Обычно требуется энергия в виде тепла или света.
- Цепная реакция или же Распространение затем происходит - радикал галогена отрывает водород от алкана с образованием радикала алкила. Это реагирует дальше.
- Завершение цепочки где радикалы рекомбинируют.
Эксперименты показали, что любое галогенирование дает смесь всех возможных изомеров, что указывает на то, что все атомы водорода восприимчивы к реакции. Полученная смесь, однако, не является статистической смесью: вторичные и третичные атомы водорода предпочтительно заменяются из-за большей стабильности вторичных и третичных свободных радикалов. Пример можно увидеть в монобромировании пропана:[14]

Растрескивание
При крекинге более крупные молекулы разбиваются на более мелкие. Это можно сделать термическим или каталитическим методом. Процесс термического крекинга следует за гомолитический механизм с образованием свободные радикалы. Процесс каталитического крекинга предполагает наличие кислота катализаторы (обычно твердые кислоты, такие как кремнезем-глинозем и цеолиты ), которые продвигают гетеролитический (асимметричный) разрыв связей с образованием пар ионов противоположных зарядов, обычно карбокатион и очень нестабильный гидрид анион. Свободные радикалы и катионы, локализованные в углероде, очень нестабильны и претерпевают процессы перегруппировки цепей, расщепления C – C в положении бета (т.е. растрескивание) и внутри- и межмолекулярный перенос водорода или гидрид передача. В обоих типах процессов соответствующие реактивные промежуточные продукты (радикалы, ионы) постоянно регенерируются, и поэтому они действуют по самораспространяющемуся цепному механизму. Цепочка реакций в конечном итоге обрывается рекомбинацией радикалов или ионов.
Изомеризация и реформирование
Драган и его коллега первыми сообщили об изомеризации алканов.[24] Изомеризация и реформирование - это процессы, в которых алканы с прямой цепью нагреваются в присутствии платина катализатор. При изомеризации алканы становятся изомерами с разветвленной цепью. Другими словами, он не теряет ни углеродов, ни водорода, сохраняя тот же молекулярный вес.[24] При реформации алканы становятся циклоалканы или же ароматические углеводороды с выделением водорода в качестве побочного продукта. Оба эти процесса повышают октановое число вещества. Бутан - наиболее распространенный алкан, подвергаемый изомеризации, поскольку он дает много разветвленных алканов с высокими октановыми числами.[24]
Другие реакции
Алканы будут реагировать с пар в присутствии никель катализатор давать водород. Алканы могут быть хлорсульфированный и нитрированный, хотя обе реакции требуют особых условий. В ферментация алканов в карбоновые кислоты имеет некоторое техническое значение. в Рид реакция, диоксид серы, хлор и свет конвертировать углеводороды в сульфонилхлориды. Нуклеофильная абстракция может использоваться для отделения алкана от металла. Алкильные группы могут переноситься от одного соединения к другому посредством трансметалляция реакции. Смесь пентафторид сурьмы (SbF5) и фторсульфоновая кислота (HSO3F), названный волшебная кислота, может протонировать алканы.[25]
Вхождение
Появление алканов во Вселенной

Алканы составляют небольшую часть атмосферы внешних газовых планет, таких как Юпитер (0,1% метана, 2промилле этан), Сатурн (0,2% метана, 5 частей на миллион этана), Уран (1,99% метана, 2,5 частей на миллион этана) и Нептун (1,5% метана, 1,5 частей на миллион этана). Титан (1,6% метана), спутник Сатурна, был исследован Гюйгенс зонд, что указывает на то, что атмосфера Титана периодически проливает жидкий метан на поверхность Луны.[26] Также на Титане миссия Кассини сфотографировала сезонные метановые / этановые озера около полярных областей Титана. Метан и этан также были обнаружены в хвосте кометы Хякутаке. Химический анализ показал, что содержания этана и метана примерно равны, что, как считается, означает, что его льды образовались в межзвездном пространстве, вдали от Солнца, которое испарило эти летучие молекулы.[27] Алканы также обнаружены в метеориты Такие как углеродистые хондриты.
Распространение алканов на Земле
Следы газообразного метана (около 0,0002% или 1745 частей на миллиард) встречаются в атмосфере Земли, главным образом, за счет метаногенный микроорганизмы, такие как Археи в кишечнике жвачных животных.[28]
Наиболее важными коммерческими источниками алканов являются природный газ и масло.[14] Природный газ содержит в основном метан и этан, с некоторыми пропан и бутан: масло представляет собой смесь жидких алканов и др. углеводороды. Эти углеводороды образовались, когда морские животные и растения (зоопланктон и фитопланктон) умерли и опустились на дно древних морей и были покрыты отложениями в аноксический окружающей среде и преобразованы в их нынешнюю форму за многие миллионы лет при высоких температурах и высоком давлении. Таким образом, природный газ образовался, например, в результате следующей реакции:
- C6ЧАС12О6 → 3 канала4 + 3 СО2
Эти залежи углеводородов, собранные в пористых породах, заключенных под непроницаемыми покрывающими породами, составляют промышленные нефтяные месторождения. Они формировались за миллионы лет, и однажды исчерпанные, их невозможно легко заменить. Истощение этих запасов углеводородов является основой так называемого энергетический кризис.
Метан также присутствует в том, что называется биогаз, производимые животными и разлагающимся веществом, что является возможным возобновляемый источник энергии.
Алканы плохо растворяются в воде, поэтому их содержание в океанах незначительно; однако при высоком давлении и низких температурах (например, на дне океанов) метан может совместно кристаллизоваться с водой с образованием твердого вещества. клатрат метана (гидрат метана). Хотя это не может быть коммерчески использовано в настоящее время, количество горючей энергии известных месторождений клатрата метана превышает энергосодержание всех месторождений природного газа и нефти вместе взятых. Таким образом, метан, извлеченный из клатрата метана, является кандидатом в качестве топлива в будущем.
Биологическое происхождение
Ациклические алканы встречаются в природе по-разному.
- Бактерии и археи

Определенные типы бактерий могут метаболизировать алканы: они предпочитают углеродные цепи с четными номерами, поскольку их легче разлагать, чем цепи с нечетными номерами.[29]
С другой стороны, определенные археи, то метаногены, производить большое количество метан метаболизмом углекислый газ или другой окисленный органические соединения. Энергия высвобождается при окислении водород:
- CO2 + 4 часа2 → CH4 + 2 часа2О
Метаногены также являются производителями болотный газ в водно-болотные угодья. Выход метана крупный рогатый скот и другие травоядные животные, который может выпускать от 30 до 50 галлонов в день,[30] и из термиты,[31] также связано с метаногенами. Они также производят этот простейший из алканов в кишечник людей. Следовательно, метаногенные археи находятся в конце цикл углерода, причем углерод выбрасывается обратно в атмосферу после фиксации фотосинтез. Вероятно, аналогично сформировались и наши нынешние месторождения природного газа.[32]
- Грибы и растения
Алканы также играют роль, хотя и второстепенную, в биологии трех эукариотический группы организмов: грибы, растения и животные. Некоторые специализированные дрожжи, например, Candida tropicale, Пичиа sp., Родоторула sp., могут использовать алканы в качестве источника углерода или энергии. Грибок Amorphotheca resinae предпочитает длинноцепочечные алканы в авиационное топливо, и может вызвать серьезные проблемы для самолетов в тропических регионах.[33]
В растениях твердые длинноцепочечные алканы находятся в кутикула растений и эпикутикулярный воск многих видов, но лишь изредка являются основными составляющими.[34] Они защищают растение от потери воды, предотвращают выщелачивание важных минералов дождем и защищает от бактерий, грибков и вредных насекомых. Углеродные цепи в алканах растений обычно имеют нечетные номера и имеют длину от 27 до 33 атомов углерода.[34] и производятся заводами декарбоксилирование четных жирные кислоты. Точный состав слоя воска не только зависит от вида, но также меняется в зависимости от сезона и таких факторов окружающей среды, как условия освещения, температура или влажность.[34]
Более летучие короткоцепочечные алканы также производятся и обнаруживаются в тканях растений. В Джеффри Пайн отличается исключительно высоким уровнем п-гептан в его смоле, по этой причине его дистиллят был обозначен как нулевая точка для одного октановое число. Также давно известно, что цветочные ароматы содержат летучие алкановые компоненты и п-нонан является важным компонентом аромата некоторых розы.[35] Выбросы газообразных и летучих алканов, таких как этан, пентан, и гексан от растений также зарегистрирован на низких уровнях, хотя обычно они не считаются основным компонентом биогенного загрязнения воздуха.[36]
Пищевые растительные масла также обычно содержат небольшие фракции биогенных алканов с широким спектром углеродных чисел, в основном от 8 до 35, обычно с пиком от низкого до верхнего 20, с концентрациями до десятков миллиграммов на килограмм (частей на миллион по весу) и sometimes over a hundred for the total alkane fraction.[37]
- Животные
Alkanes are found in animal products, although they are less important than unsaturated hydrocarbons. One example is the shark liver oil, which is approximately 14% pristane (2,6,10,14-tetramethylpentadecane, C19ЧАС40). They are important as феромоны, chemical messenger materials, on which insects depend for communication. In some species, e.g. the support beetle Xylotrechus colonus, pentacosane (C25ЧАС52), 3-methylpentaicosane (C26ЧАС54) and 9-methylpentaicosane (C26ЧАС54) are transferred by body contact. With others like the муха цеце Glossina morsitans morsitans, the pheromone contains the four alkanes 2-methylheptadecane (C18ЧАС38), 17,21-dimethylheptatriacontane (C39ЧАС80), 15,19-dimethylheptatriacontane (C39ЧАС80) and 15,19,23-trimethylheptatriacontane (C40ЧАС82), and acts by smell over longer distances. Waggle-dancing медоносные пчелы produce and release two alkanes, tricosane and pentacosane.[38]
Ecological relations

One example, in which both plant and animal alkanes play a role, is the ecological relationship between the sand bee (Андрена нигроаенеа ) и ранняя паучья орхидея (Ophrys sphegodes ); the latter is dependent for опыление on the former. Sand bees use pheromones in order to identify a mate; в случае A. nigroaenea, the females emit a mixture of tricosane (C23ЧАС48), pentacosane (C25ЧАС52) и heptacosane (C27ЧАС56) in the ratio 3:3:1, and males are attracted by specifically this odor. The orchid takes advantage of this mating arrangement to get the male bee to collect and disseminate its pollen; parts of its flower not only resemble the appearance of sand bees but also produce large quantities of the three alkanes in the same ratio as female sand bees. As a result, numerous males are lured to the blooms and attempt to copulate with their imaginary partner: although this endeavor is not crowned with success for the bee, it allows the orchid to transfer its pollen,which will be dispersed after the departure of the frustrated male to other blooms.
Производство
нефтепереработка
As stated earlier, the most important source of alkanes is natural gas and сырая нефть.[14] Alkanes are separated in an нефтеперегонный завод к фракционная перегонка and processed into many products.
Fischer–Tropsch
В Процесс Фишера-Тропша is a method to synthesize liquid hydrocarbons, including alkanes, from монооксид углерода and hydrogen. This method is used to produce substitutes for petroleum distillates.
Laboratory preparation
There is usually little need for alkanes to be synthesized in the laboratory, since they are usually commercially available. Also, alkanes are generally unreactive chemically or biologically, and do not undergo functional group interconversions cleanly. When alkanes are produced in the laboratory, it is often a side-product of a reaction. Например, использование п-бутиллитий как сильный основание gives the conjugate acid, п-butane as a side-product:
- C4ЧАС9Li + H2O → C4ЧАС10 + LiOH
However, at times it may be desirable to make a section of a molecule into an alkane-like functionality (алкил group) using the above or similar methods. Например, ethyl group is an alkyl group; when this is attached to a гидрокси group, it gives этиловый спирт, which is not an alkane. To do so, the best-known methods are гидрирование из алкены:
- RCH = CH2 + H2 → RCH2CH3 (R = алкил )
Alkanes or alkyl groups can also be prepared directly from алкилгалогениды в Corey–House–Posner–Whitesides reaction. В Деоксигенация Бартона – Маккомби[39][40] removes hydroxyl groups from alcohols e.g.
и Clemmensen reduction[41][42][43][44] removes carbonyl groups from aldehydes and ketones to form alkanes or alkyl-substituted compounds e.g.:
Preparation of alkanes from other organic compounds
Alkanes can be prepared from a variety of organic compounds.These include alkenes, alkynes, haloalkanes, alcohols, aldehydes and ketones and carboxylic acids.
From alkenes and alkynes
When alkenes and alkynes are subjected to hydrogenation reaction by treating them with hydrogen in the presence of palladium or platinum or nickel catalyst, they produce alkanes. In this reaction powdered catalyst is preferred to increase the surface area so that adsorption of hydrogen on the catalyst increases. In this reaction the hydrogen gets attached on the catalyst to form a hydrogen-catalyst bond which leads to weakening of H-H bond, thereby leading to the addition of hydrogen on alkenes and alkynes. The reaction is exothermic because the product alkane is stable as it has more sigma bonds than the reactant alkenes and alkynes due to conversion of pi bond to sigma bonds.[45]
From haloalkanes
Alkanes can be produced from haloalkanes using different methods.
Реакция Вюрца
When haloalkane is treated with sodium in dry ether, alkane with double the number of carbon atoms is obtained. This reaction proceeds through free radical intermediate and has possibility of alkene formation in case of tertiary haloalkanes and vicinal dihalides.
Corey-House-Synthesis
When haloalkane is treated with dialkyl lithium cuprite, which is otherwise known as Gilman's reagent, any higher alkane is obtained.
Reaction with metal hydride
When haloalkanes are treated with metal hydride ,eg, sodium hydride and lithium aluminium hydride.
Frankland reaction
When haloalkane is treated with zinc in ester, alkane is obtained.
Fittig reaction
When aryl halide is treated with sodium in dry ether, it forms biphenyl.
Ullmann biaryl synthesis
When aryl halide is treated with copper, it forms biphenyl.
Wurtz-Fittig reaction
When aryl halide is treated with haloalkane, we get alkyl benzene.
Приложения
The applications of alkanes depend on the number of carbon atoms. The first four alkanes are used mainly for heating and cooking purposes, and in some countries for electricity generation. Метан и этан are the main components of natural gas; they are normally stored as gases under pressure. It is, however, easier to transport them as liquids: This requires both compression and cooling of the gas.
Пропан и бутан are gases at atmospheric pressure that can be liquefied at fairly low pressures and are commonly known as сжиженный нефтяной газ (СНГ). Propane is used in propane gas burners and as a fuel for road vehicles,[46] butane in space heaters and disposable cigarette lighters. Both are used as propellants in aerosol sprays.
Из пентан к октан the alkanes are highly volatile liquids. They are used as fuels in двигатель внутреннего сгорания, as they vaporize easily on entry into the combustion chamber without forming droplets, which would impair the uniformity of the combustion. Branched-chain alkanes are preferred as they are much less prone to premature ignition, which causes стучать, than their straight-chain homologues. This propensity to premature ignition is measured by the октановое число of the fuel, where 2,2,4-trimethylpentane (изооктан) has an arbitrary value of 100, and гептан has a value of zero. Apart from their use as fuels, the middle alkanes are also good растворители for nonpolar substances.
Alkanes from нонан to, for instance, гексадекан (an alkane with sixteen carbon atoms) are liquids of higher вязкость, less and less suitable for use in gasoline. They form instead the major part of дизель и авиационное топливо. Diesel fuels are characterized by their cetane number, cetane being an old name for hexadecane. However, the higher melting points of these alkanes can cause problems at low temperatures and in polar regions, where the fuel becomes too thick to flow correctly.
Alkanes from hexadecane upwards form the most important components of горючее и смазочное масло. In the latter function, they work at the same time as anti-corrosive agents, as their hydrophobic nature means that water cannot reach the metal surface. Many solid alkanes find use as парафиновая свеча, например, в свечи. This should not be confused however with true воск, which consists primarily of сложные эфиры.
Alkanes with a chain length of approximately 35 or more carbon atoms are found in битум, used, for example, in road surfacing. However, the higher alkanes have little value and are usually split into lower alkanes by треск.
Some synthetic полимеры Такие как полиэтилен и полипропилен are alkanes with chains containing hundreds or thousands of carbon atoms. These materials are used in innumerable applications, and billions of kilograms of these materials are made and used each year.
Environmental transformations
Эта секция нуждается в расширении. Вы можете помочь добавляя к этому. (Август 2014 г.) |
Alkanes are chemically very inert apolar molecules which are not very reactive as organic compounds. This inertness yields serious ecological issues if they are released into the environment. Due to their lack of functional groups and low water solubility, alkanes show poor bioavailability for microorganisms.[47]
There are, however, some microorganisms possessing the metabolic capacity to utilize п-alkanes as both carbon and energy sources.[48] Some bacterial species are highly specialised in degrading alkanes; these are referred to as hydrocarbonoclastic bacteria.[49]
Опасности
Эта секция нуждается в расширении. Вы можете помочь добавляя к этому. (Сентябрь 2017 г.) |
Methane is flammable, explosive and dangerous to inhale; because it is a colorless, odorless gas, special caution must be taken around methane.[50] Ethane is also extremely flammable, explosive, and dangerous to inhale.[51] Both of them may cause suffocation.[50][51] Propane, too, is flammable and explosive,[52] and may cause drowsiness or unconsciousness if inhaled.[52] Butane presents the same hazards as propane.[53]
Alkanes also pose a threat to the environment. Branched alkanes have a lower biodegradability than unbranched alkanes.[54] Methane is considered to be the greenhouse gas that is most dangerous to the environment,[55] although the amount of methane in the atmosphere is relatively low.[55]
Смотрите также
Рекомендации
- ^ а б ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "алканы ". Дои:10.1351/goldbook.A00222
- ^ "Alkanes". Химия LibreTexts. 28 ноября 2016.
- ^ Arora, A. (2006). Hydrocarbons (Alkanes, Alkenes And Alkynes). Discovery Publishing House Pvt. Ограничено. ISBN 9788183561426.
- ^ Он-лайн энциклопедия целочисленных последовательностей (последовательность A000602 в OEIS )
- ^ IUPAC, Commission on Nomenclature of Organic Chemistry (1993). "R-2.2.1: Hydrocarbons". Руководство по номенклатуре органических соединений ИЮПАК (Рекомендации 1993 г.). Blackwell Scientific. ISBN 978-0-632-03488-8. Получено 12 февраля 2007.
- ^ Alkane Nomenclature В архиве 2 февраля 2012 г. Wayback Machine
- ^ Thus, the ending "-diene" is applied in some cases where von Hofmann had "-ine"
- ^ а б William Reusch. "Nomenclature – Alkanes". Виртуальный учебник органической химии. Архивировано из оригинал 21 мая 2016 г.. Получено 5 апреля 2007.
- ^ William Reusch. "Examples of the IUPAC Rules in Practice". Виртуальный учебник органической химии. Архивировано из оригинал 21 мая 2016 г.. Получено 5 апреля 2007.
- ^ "IUPAC Rules". www.chem.uiuc.edu. Получено 13 августа 2018.
- ^ Donald Mackay, Handbook of Physical-Chemical Properties and Environmental Fate for Organic Chemicals, ISBN 1420044397, п. 206
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) 29 октября 2013 г.. Получено 17 февраля 2014.CS1 maint: заархивированная копия как заголовок (связь)
- ^ "13. Hydrocarbons | Textbooks". textbook.s-anand.net. Архивировано из оригинал 8 мая 2011 г.. Получено 3 октября 2014.
- ^ а б c d е ж R. T. Morrison; R. N. Boyd (1992). Органическая химия (6-е изд.). Нью-Джерси: Прентис-Холл. ISBN 978-0-13-643669-0.
- ^ "Physical Properties of Cycloalkanes". Химия LibreTexts. 29 November 2015. Archived from оригинал 2 февраля 2018 г.. Получено 2 февраля 2018.
- ^ Boese R, Weiss HC, Blaser D (1999). "The melting point alternation in the short-chain п-alkanes: Single-crystal X-ray analyses of propane at 30 K and of п-butane to п-nonane at 90 K". Angew Chem Int Ed. 38: 988–992. Дои:10.1002/(SICI)1521-3773(19990401)38:7<988::AID-ANIE988>3.3.CO;2-S.
- ^ visualization of crystal structures.
- ^ а б Алабугин Игорь Валерьевич (профессор) (2016). Стереоэлектронные эффекты: мост между структурой и реактивностью. Чичестер, Великобритания. ISBN 978-1-118-90637-8. OCLC 957525299.
- ^ Wodrich, Matthew D.; Wannere, Chaitanya S.; Мо, Иронг; Jarowski, Peter D.; Houk, Kendall N .; Schleyer, Paul von Ragué (2007). "The Concept of Protobranching and Its Many Paradigm Shifting Implications for Energy Evaluations". Химия - Европейский журнал. 13 (27): 7731–7744. Дои:10.1002/chem.200700602. ISSN 1521-3765. PMID 17607688.
- ^ а б Gronert, Scott (1 February 2006). "An Alternative Interpretation of the C−H Bond Strengths of Alkanes". Журнал органической химии. 71 (3): 1209–1219. Дои:10.1021/jo052363t. ISSN 0022-3263. PMID 16438539.
- ^ Kemnitz, Carl R. (2013). "Electron Delocalization Explains much of the Branching and Protobranching Stability". Химия - Европейский журнал. 19 (33): 11093–11095. Дои:10.1002/chem.201302549. ISSN 1521-3765. PMID 23868617.
- ^ Ess, Daniel H.; Лю, Шубин; De Proft, Frank (16 December 2010). "Density Functional Steric Analysis of Linear and Branched Alkanes". Журнал физической химии A. 114 (49): 12952–12957. Bibcode:2010JPCA..11412952E. Дои:10.1021/jp108577g. ISSN 1089-5639. PMID 21086970.
- ^ Ingold, K. U.; DiLabio, Gino A. (1 December 2006). "Bond Strengths: The Importance of Hyperconjugation". Органические буквы. 8 (26): 5923–5925. Дои:10.1021/ol062293s. ISSN 1523-7060. PMID 17165895.
- ^ а б c Asinger, Friedrich (1967). Paraffins; Chemistry and Technology. Оксфорд: Pergamon Press.
- ^ George A. Olah, Schlosberg RH (1968). "Chemistry in Super Acids. I. Hydrogen Exchange and Polycondensation of Methane and Alkanes in FSO3H–SbF5 ("Magic Acid") Solution. Protonation of Alkanes and the Intermediacy of CH5+ and Related Hydrocarbon Ions. The High Chemical Reactivity of "Paraffins" in Ionic Solution Reactions". Журнал Американского химического общества. 90 (10): 2726–7. Дои:10.1021/ja01012a066.
- ^ Emily Lakdawalla. "Titan: Arizona in an Icebox?". Архивировано из оригинал 6 апреля 2008 г.. Получено 21 января 2004.
- ^ Mumma, M.J .; Disanti, M.A .; dello Russo, N.; Fomenkova, M.; Magee-Sauer, K.; Kaminski, C.D .; D.X., Xie (1996). "Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin". Наука. 272 (5266): 1310–4. Bibcode:1996Sci...272.1310M. Дои:10.1126/science.272.5266.1310. PMID 8650540. S2CID 27362518.
- ^ Janssen, P. H.; Kirs, M. (2008). "Structure of the Archaeal Community of the Rumen". Appl Environ Microbiol. 74 (12): 3619–3625. Дои:10.1128/AEM.02812-07. ЧВК 2446570. PMID 18424540.
- ^ "Metabolism of Alkanes and Fatty Acids – eQuilibrator 0.2 beta documentation". equilibrator.weizmann.ac.il. Получено 11 апреля 2018.
- ^ TodayIFoundOut.com, Matt Blitz -. "Do Cow Farts Actually Contribute to Global Warming?". Gizmodo. Получено 11 апреля 2018.
- ^ Бучковски, Гжегож; Bertelsmeier, Cleo (15 January 2017). "Invasive termites in a changing climate: A global perspective". Экология и эволюция. 7 (3): 974–985. Дои:10.1002/ece3.2674. ЧВК 5288252. PMID 28168033.
- ^ Society, National Geographic (24 July 2012). "natural gas". Национальное географическое общество. Получено 11 апреля 2018.
- ^ Hendey, N. I. (1964). "Some observations on Cladosporium resinae as a fuel contaminant and its possible role in the corrosion of aluminium alloy fuel tanks". Труды Британского микологического общества. 47 (7): 467–475. Дои:10.1016/s0007-1536(64)80024-3.
- ^ а б c EA Baker (1982) Chemistry and morphology of plant epicuticular waxes. pp. 139-165. In "The Plant Cuticle". edited by DF Cutler, KL Alvin and CE Price. Academic Press, Лондон. ISBN 0-12-199920-3
- ^ Kim, HyunJung; Kim, NamSun; Lee, DongSun (2000). "Determination of floral fragrances of Rosa hybrida using solid-phase trapping-solvent extraction and gas chromatography–mass spectrometry". Journal of Chromatography A. 902 (2): 389–404. Дои:10.1016/S0021-9673(00)00863-3. PMID 11192171.
- ^ Kesselmeier, J.; Staudt, N. (1999). "Biogenic Volatile Organic Compounds (VOC): An Overview on Emission, Physiology and Ecology" (PDF). Journal of Atmospheric Chemistry. 33 (1): 22–38. Bibcode:1999JAtC...33...23K. Дои:10.1023/A:1006127516791. S2CID 94021819. Архивировано из оригинал (PDF) 13 марта 2013 г.
- ^ Moreda, W.; Perez-Camino, M. C.; Cert, A. (2001). "Gas and liquid chromatography of hydrocarbons in edible vegetable oils". Journal of Chromatography A. 936 (1–2): 159–171. Дои:10.1016/s0021-9673(01)01222-5. PMID 11760997.
- ^ Thom; и другие. (21 August 2007). "The Scent of the Waggle Dance". PLOS Биология. 5 (9): e228. Дои:10.1371/journal.pbio.0050228. ЧВК 1994260. PMID 17713987.
- ^ Бартон, Д. Х. Р.; McCombie, S. W. (1975). "A new method for the deoxygenation of secondary alcohols". J. Chem. Soc., Perkin Trans. 1 (16): 1574–1585. Дои:10.1039/P19750001574.
- ^ Crich, David; Quintero, Leticia (1989). "Radical chemistry associated with the thiocarbonyl group". Chem. Ред. 89 (7): 1413–1432. Дои:10.1021/cr00097a001.
- ^ Martin, E. L. (1942). "The Clemmensen Reduction". Орг. Реагировать. 1: 155. Дои:10.1002/0471264180.or001.07.
- ^ Buchanan, J. G. St. C.; Woodgate, P. D. Кварта. Ред. 1969, 23, 522, (Review).
- ^ Vedejs, E. (1975). "Clemmensen Reduction of Ketones in Anhydrous Organic Solvents". Орг. Реагировать. 22: 401. Дои:10.1002/0471264180.or022.03.
- ^ Yamamura, S.; Nishiyama, S. Компр. Орг. Synth. 1991, 8, 309–313, (Review).
- ^ Harikiran.B, K E Mannanam, Kottayam
- ^ "Using propane as a fuel" (PDF). Архивировано из оригинал (PDF) 12 октября 2013 г.. Получено 27 ноября 2012.
- ^ Singh, S. N.; Kumari, B.; Mishra, Shweta (2012). "Microbial Degradation of Alkanes". In Singh, Shree Nath (ed.). Microbial Degradation of Xenobiotics. Springer. pp. 439–469. Дои:10.1007/978-3-642-23789-8_17. ISBN 978-3-642-23788-1.
- ^ Berthe-Corti, L.; Fetzner, S. (1 July 2002). "Bacterial Metabolism of п-Alkanes and Ammonia under Oxic, Suboxic and Anoxic Conditions". Acta Biotechnologica. 22 (3–4): 299–336. Дои:10.1002/1521-3846(200207)22:3/4<299::AID-ABIO299>3.0.CO;2-F. ISSN 1521-3846.
- ^ Dashti, Narjes; Ali, Nedaa; Eliyas, Mohamed; Khanafer, Majida; Sorkhoh, Naser A.; Radwan, Samir S. (March 2015). "Most Hydrocarbonoclastic Bacteria in the Total Environment are Diazotrophic, which Highlights Their Value in the Bioremediation of Hydrocarbon Contaminants". Микробы и окружающая среда. 30 (1): 70–75. Дои:10.1264/jsme2.ME14090. ISSN 1342-6311. ЧВК 4356466. PMID 25740314.
- ^ а б "CDC - METHANE - International Chemical Safety Cards - NIOSH". www.cdc.gov. Получено 19 сентября 2017.
- ^ а б "CDC - ETHANE - International Chemical Safety Cards - NIOSH". www.cdc.gov. Получено 19 сентября 2017.
- ^ а б "CDC - PROPANE - International Chemical Safety Cards - NIOSH". www.cdc.gov. Архивировано из оригинал 23 ноября 2017 г.. Получено 19 сентября 2017.
- ^ "CDC - BUTANE - International Chemical Safety Cards - NIOSH". www.cdc.gov. Получено 19 сентября 2017.
- ^ Woodside, Gayle; Kocurek, Dianna (26 May 1997). Environmental, Safety, and Health Engineering. Джон Вили и сыновья. ISBN 9780471109327.
- ^ а б "Pollutant Fact Sheet". apps.sepa.org.uk. Получено 19 сентября 2017.