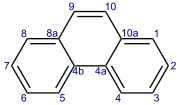
Фенантрен - Phenanthrene
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Фенантрен | |
| Другие имена Трицикло [8.4.0.02,7] тетрадека-1,3,5,7,9,11,13-гептаен | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 1905428 | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.001.437 |
| Номер ЕС |
|
| 28699 | |
| КЕГГ | |
| MeSH | C031181 |
PubChem CID | |
| UNII | |
| |
| |
| Свойства | |
| C14ЧАС10 | |
| Молярная масса | 178.234 г · моль−1 |
| Внешность | Бесцветное твердое вещество |
| Плотность | 1,18 г / см3[1] |
| Температура плавления | 101 ° С (214 ° F, 374 К)[1] |
| Точка кипения | 332 ° С (630 ° F, 605 К)[1] |
| 1,6 мг / л[1] | |
| -127.9·10−6 см3/ моль | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 171 ° С (340 ° F, 444 К)[1] |
| Структура | |
| C2v[2] | |
| 0 D | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Фенантрен является вероятным канцерогенным соединением, которое представляет большой риск токсичности для живых организмов. Это полициклический ароматический углеводород (ПАУ) - это большая группа органических соединений, встречающихся в группах по два или более. [3] Фенантрен встречается в природе, а также является химическим веществом, созданным человеком. Обычно люди подвергаются воздействию фенантрена при вдыхании сигаретного дыма, но существует множество путей воздействия. Доказательства, подтвержденные исследованиями на животных, показывают, что фенантрен является потенциальным канцерогеном. [3]. Он выглядит как бесцветное кристаллическое твердое вещество, но может также выглядеть желтым.[4]
Фенантрен используется для производства красителей, пластмасс и пестицидов, взрывчатых веществ и лекарств. Его также использовали для производства желчных кислот, холестерина и стероидов.[4]
Соединение с фенантреновым скелетом и атомами азота в положениях 4 и 5 известно как фенантролин.
Химия
Фенантрен почти нерастворим в воде, но растворим в большинстве органических растворителей с низкой полярностью, таких как толуол, четыреххлористый углерод, эфир, хлороформ, уксусная кислота и бензол.
В Синтез фенантрена Бардхана – Сенгупты. это классический способ получения фенантренов.[5]
Этот процесс включает электрофильное ароматическое замещение с помощью привязанного циклогексанол группа, использующая пятиокись дифосфора, который замыкает центральное кольцо на существующее ароматическое кольцо. Дегидрирование с помощью селен преобразует и другие кольца в ароматические. Ароматизация шестичленных колец селеном до конца не изучена, но она дает H2Se.
Фенантрен также можно получить фотохимическим путем из некоторых дневники.
Реакции фенантрена обычно происходят в положениях 9 и 10, в том числе:
- Органическое окисление к фенантренхинону с хромовая кислота[6]
- Органическое восстановление к 9,10-дигидрофенантрену с водород газ и Рэйни Никель[7]
- Электрофильное галогенирование к 9-бромфенантрену с бром[8]
- Ароматическое сульфирование к 2 и 3-фенантренсульфоновым кислотам с серная кислота[9]
- Озонолиз в дифенилальдегид[10]
Канонические формы
Фенантрен более стабилен, чем его линейный изомер антрацен. Классическое и хорошо обоснованное объяснение основано на Правило Клара. Новая теория призывает к так называемой стабилизации водородно-водородные связи между атомами водорода C4 и C5.
Природные явления
Раватит природный минерал, состоящий из фенантрена.[11] В небольших количествах он обнаружен среди нескольких мест сжигания угля. Раватит представляет собой небольшую группу органических минералов.
В растениях
Смотрите также
использованная литература
- ^ а б c d е Запись CAS RN 85-01-8 в базе данных веществ GESTIS Институт охраны труда и здоровья
- ^ Питер Аткинс, Дж. Д. П., Физическая химия Аткинса. Oxford: 2010. Pg.443.
- ^ а б «Фенантрена» (PDF). EPA.gov. Получено 3 октября 2020.
- ^ а б «Информационный бюллетень по фенантрену» (PDF). archive.epa.gov. Агентство по охране окружающей среды США. Получено 19 июля 2019.
- ^ «Синтез Бардхан Сенгупта». Комплексные органические названия реакций и реагенты. 49. 2010. С. 215–219. Дои:10.1002 / 9780470638859.conrr049.
- ^ Органический синтез, Сб. Vol. 4, стр.757 (1963); Vol. 34, стр.76 (1954). Ссылка на сайт
- ^ Органический синтез, Сб. Vol. 4, стр. 313 (1963); Vol. 34, стр.31 (1954). Ссылка на сайт.
- ^ Органический синтез, Сб. Vol. 3, с. 134 (1955); Vol. 28, стр.19 (1948) Ссылка на сайт.
- ^ Органический синтез, Сб. Vol. 2, стр. 482 (1943); Vol. 16, стр.63 (1936) Ссылка на сайт.
- ^ Органический синтез, Сб. Vol. 5, стр. 489 (1973); Vol. 41, стр.41 (1961) Ссылка на сайт.
- ^ Раватит Минеральные данные
внешние ссылки
- Фенантрен на сайте scorecard.org


