Гелицен - Helicene


В органическая химия, спирали находятся орто-конденсированный полициклический ароматические соединения в котором бензольные кольца или другие ароматические углеводороды имеют угловую форму аннулированный давать спирально -образный хиральные молекулы.[1] Химия геликенов привлекает постоянное внимание из-за их уникальной структуры, спектральный, и оптический Особенности.[2][3][4][5][6][7][8]
Структура и свойства
В систематическое именование для этого класса соединений основывается на количестве колец: [п] геликен представляет собой структуру, состоящую из п кольца. В соответствии с ИЮПАК, только конструкции, где п не менее 5 считаются спиралями.[1] Некоторые конкретные соединения также имеют альтернативные или банальные имена. По мере увеличения количества колец, начиная с четырех, структура становится неплоской, но вместо этого плоскости последовательных колец наклоняются, чтобы предотвратить стерический столкновения. Полученная спираль хиральная. Для спиралей с шестью бензольными звеньями совершается поворот на 360 °. В серии геликен двугранные углы между концами увеличивается при переходе от [4] геликена (26 °) к [6] геликена (58 °), а затем снова уменьшается, например, в [7] геликене (30 °).
Гелицены примечательны своей хиральностью, несмотря на отсутствие обоих асимметричный углерод и хиральные центры. Вместо этого есть осевая хиральность, который является результатом вращения самой спиральности. Спирали по часовой стрелке и против часовой стрелки не накладываются друг на друга. По соглашению левосторонняя спираль минус и помечены (M), правая спираль плюс и помечены (п). Свидетельства из КД спектроскопия предполагает, что левосторонние спирали левовращающий и правые спирали правовращающий.
Синтез
О первой геликеновой структуре сообщил Якоб Мейсенхаймер в 1903 г. как результат восстановления 2-нитронафталин.[9] [5] геликен был синтезирован в 1918 году Weitzenböck & Klingler.[10] Первый [6] геликен (также называемый гексагелицен) был синтезированный к М. С. Ньюман и Д. Ледничер в 1955 г. по схеме, в которой два центральных кольца замыкались Циклизация Фриделя – Крафтса из карбоновая кислота соединения.[11][12] С тех пор появилось несколько методов синтеза спиралей разной длины и заместители используются. Окислительный фотоциклизация из стильбен -тип предшественник чаще всего используется в качестве ключевого шага. Самый длинный геликен [14] был получен этим методом в 1975 г.
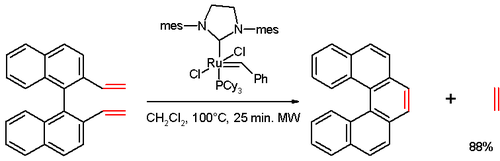
В одном исследовании[13] [5] геликен был синтезирован в метатезис олефинов реакция дивинильного соединения (полученного из 1,1'-би-2-нафтол (BINOL) в несколько шагов), с Катализатор второго поколения Граббса:
Другой подход также нефотохимический и основан на сборке бифенилил-нафталинов и их катализируемой платиной двойной циклоизомеризации, приводящей к различным [6] спиралям:[14]
Acenes линейные 1,3-конденсированные или метааналоги спиралей, и фенацены представляют собой зигзагообразную конфигурацию. Концептуально родственными соединениями являются циркулены.

[4] Гелицен
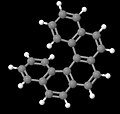
[5] Гелицен

[6] Гелицен

[6] Гелицен, прочие хиральность
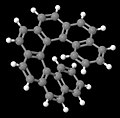
[7] Гелицен

[7] Гелицен, другая хиральность

[8] Гелицен

[9] Гелицен

[10] Гелицен

[11] Гелицен

[12] Гелицен

[13] Гелицен

[14] Гелицен

[15] Гелицен

[16] Гелицен

[18] Гелицен
Приложения
Гелицены были изучены относительно нелинейная оптика,[15] CPL,[16][17] органокатализ,[18] конформационный анализ,[19] определение хиральности,[20] химические датчики [21] и замещение гетероатома.[22][23][24][25]
Рекомендации
- ^ а б ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "спирали ". Дои:10.1351 / goldbook.H02762
- ^ Мартин, Р. Х. (1974), Гелицены. Энгью. Chem. Int. Эд. Engl., 13: 649–660. Дои:10.1002 / anie.197406491
- ^ Гелицены: синтез и применение Юнь Шэнь и Чуан-Фэн Чен делают химические обзоры статьи как можно скорее Дои:10.1021 / cr200087r
- ^ Добавки бензинов по Дильсу-Альхе в гелиценовые скелеты Дэвид Чжиган Ван, Томас Дж. Кац, Джеймс Голен и Арнольд Л. Рейнгольд J. Org. Chem .; 2004; 69 (22) стр. 7769–7771 Дои:10.1021 / jo048707h
- ^ Сто лет геликеновой химии. Часть 1: нестереоселективный синтез карбогелиценов Marc Gingras Chem. Soc. Ред., 2013,42, 968-1006 Дои:10.1039 / C2CS35154D
- ^ Сто лет геликеновой химии. Часть 2: стереоселективный синтез и хиральное разделение карбогелиценов Марк Жинграс, Гай Феликс и Ромен Пересутти Chem. Soc. Ред., 2013,42, 1007-1050 Дои:10.1039 / C2CS35111K
- ^ Сто лет геликеновой химии. Часть 3: применение и свойства карбогелиценов Marc Gingras Chem. Soc. Ред., 2013,42, 1051-1095 Дои:10.1039 / C2CS35134J
- ^ Недавние разработки синтеза гелицена Кен Камикава Журнал синтетической органической химии, Япония, Vol. 72 (2014) №1 с. 58-67 Дои:10,5059 / юкигосэйкёкаиси. 72,58
- ^ Meisenheimer, J. и Witte, K. (1903), Снижение фон 2-нитронафталина. Berichte der deutschen chemischen Gesellschaft, 36: 4153–4164. Дои:10.1002 / cber.19030360481
- ^ Synthese der isomeren Kohlenwasserstoffe 1, 2–5, 6-Dibenzanthracen и 3, 4–5, 6-Dibenzphenanthren Ричард Вайтценбёк и Альберт Клинглер Monatshefte für Chemie / Ежемесячный выпуск химии 39, номер 5, 315–323, Дои:10.1007 / BF01524529
- ^ Новый реагент для разделения комплексообразованием; разрешение фенантро- [3,4-c] фенантрена Мелвин С. Ньюман, Уилсон Б. Лутц и Дэниел Ледникер. Журнал Американского химического общества, 1955 г. 77 (12), 3420–3421 Дои:10.1021 / ja01617a097
- ^ Синтез и разделение гексагелицена. Мелвин С. Ньюман и Дэниел Ледникер. Журнал Американского химического общества, 1956 г. 78 (18), 4765–4770 Дои:10.1021 / ja01599a060
- ^ Получение гелиценов через метатезис олефинов Шон К. Коллинз, Ален Гранбуа, Мартин П. Вашон, Жюли Котэ Angewandte Chemie International Edition Том 45, выпуск 18, страницы 2923–2926 2006 Дои:10.1002 / anie.200504150
- ^ Синтез гексагелицена и 1-метоксигексагелицена циклоизомеризацией производных бифенилил-нафталина. Сторх Й., Сикора Я., Чермак Я., Карбан Я., Цисаржова И., Ружичка А. J. Org. Chem. 2009, 74, 3090. Дои:10.1021 / jo900077j
- ^ Красители Helquat: гелиценоподобные двухтактные системы с большими нелинейными оптическими характеристиками второго порядкаБенджамин Дж. Коу, Даниэла Русанова, Вишвас Д. Джоши, Серджио Санчес, Ян Вавра, Душант Хобрагаде, Лукаш Севера, Ивана Цисаржова, Давид Шаман, Радек Поль, Коэн Клейс, Griet Depotter, Брюс С. Бруншвейн и Журнал органической химии 2016 81 (5), 1912-1920 Дои:10.1021 / acs.joc.5b02692
- ^ Синтетический контроль динамики возбужденного состояния и циркулярно поляризованной люминесценции флуоресцентных «пуш-пул» спиралей тетратиа [9] Y. Yamamoto, H. Sakai, J. Yuasa, Y. Araki, T. Wada, T. Sakanoue, T. Takenobu, T. Kawai, T. Hasobe, Chem. Евро. J. 2016, 22, 4263. Дои:10.1002 / chem.201504048
- ^ Управляемая динамика возбужденного состояния и свойство повышенной флуоресценции геликена тетрасульфона [9] с помощью простого процесса синтеза Юки Ямамото, Хаято Сакаи, Дзюнпей Юаса, Ясуюки Араки, Такехико Вада, Томо Саканоуэ, Тайши Такенобу, Цуёси Кавай и Таку Хасобе The Journal of Physical Chemistry C 2016 120 (13), 7421-7427 Дои:10.1021 / acs.jpcc.6b01123
- ^ Производные тетратиа [7] геликена фосфора: экспериментальные и теоретические исследования электронных свойств и предварительные применения в качестве органокатализаторов D. Dova, L. Viglianti, P. R. Mussini, S. Prager, A. Dreuw, A. Voituriez, E. Licandro, S. Cauteruccio, Asian J. Org. Chem. 2016, 5, 537. Дои:10.1002 / ajoc.201600025
- ^ Синтез и структурные особенности четверных гелиценов: сильно искаженные π-системы, обеспечиваемые накоплением спиральных отталкиваний Такао Фудзикава, Ясутомо Сегава и Кеничиро Итами Журнал Американского химического общества, 2016 138 (10), 3587-3595 Дои:10.1021 / jacs.6b01303
- ^ Хиральный β-циклодекстрин, модифицированный азонией [6] геликеном: синтез, характеристика и определение хиральности недериватизированных аминокислот в воде Циньфэй Хуан, Лянвэй Цзян, Вэньдин Лян, Цзяньчан Гуй, Динго Сюй, Ванхуа Ву, Ёсито Накай, Масаки Нисидзима, Гаку Фукухара, Тадаси Мори, Ёсихиса Иноуэ и Ченг Ян Журнал органической химии, 2016, стр. 34: 30 81 (834) Дои:10.1021 / acs.joc.6b00130
- ^ Электрохимический емкостный K+ Химический сенсор ЭМИС на основе геликена дибромаза [7] в качестве ионофора для обнаружения ионов калия M. Tounsi, M. BenBraiek, A. Baraket, M. Lee, N. Zine, M. Zabala, J. Bausells, F. Aloui, B. BenHassine, A. Maaref, A. Errachid, Electroanalysis 2016, 28, 2892 . Дои:10.1002 / elan.201600104
- ^ Радикальный катион и нейтральный радикал геликена азатия [7] с инверсией энергетических уровней SOMO – HOMO Ин Ван, Хуэй Чжан, Марен Пинк, Арнон Оланкитванит, Сухада Райка и Анджей Райка Журнал Американского химического общества, 2016 138 (23), 7298-7304 Дои:10.1021 / jacs.6b01498
- ^ Синтез и исследование структурных свойств производных окса [5] геликена. М. Шьям Сундара, Сибапрасад Сахуб, Ашутош В. Бедекара, Тетраэдр: асимметрия Том 27, выпуск 16, 1 сентября 2016 г., страницы 777–781 Дои:10.1016 / j.tetasy.2016.06.020
- ^ Синтез и фотофизические свойства аза [n] спиралей. Гурав М. Упадхьяй, Хариш Р. Талеле и Ашутош В. Бедекар Журнал органической химии 2016 81 (17), 7751-7759 Дои: 10.1021 / acs.joc.6b01395
- ^ Гетеро [5] геликен на основе сультама: синтез, структура и усиление эмиссии, вызванное кристаллизацией. Тарунприт С. Вирк, Ниранджан В. Илаве, Гуосян Чжан, Крейг П. Ю, Брайан М. Вонг, Джулиан М. В. Чан. СКУД Омега 2016; 1(6), 1336–1342 Дои:10.1021 / acsomega.6b00335
- Общие ссылки
- Чуан-Фэн; Юнь Шен (2017). Химия гелицена: от синтеза к применению. Springer. Дои:10.1007/978-3-662-53168-6. ISBN 978-3-662-53168-6.

















