Этан - Википедия - Ethane
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Этан[1] | |||
| Систематическое название ИЮПАК Дикарбан (никогда не рекомендуется[1]) | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 1730716 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.741 | ||
| Номер ЕС |
| ||
| 212 | |||
| MeSH | Этан | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1035 | ||
| |||
| |||
| Свойства | |||
| C2ЧАС6 | |||
| Молярная масса | 30.070 г · моль−1 | ||
| Внешность | Бесцветный газ | ||
| Запах | Без запаха | ||
| Плотность |
544,0 кг / м3 (жидкость при -88,5 ° C) | ||
| Температура плавления | -182,8 ° С; -296,9 ° F; 90,4 тыс. | ||
| Точка кипения | -88,5 ° С; -127,4 ° F; 184,6 тыс. | ||
| 56,8 мг л−1[3] | |||
| Давление газа | 3,8453 МПа (при 21,1 ° C) | ||
Закон Генри постоянный (kЧАС) | 19 нмоль Па−1 кг−1 | ||
| Кислотность (пKа) | 50 | ||
| Основность (пKб) | -36 | ||
| Конъюгированная кислота | Этан | ||
| -37.37·10−6 см3/ моль | |||
| Термохимия | |||
Теплоемкость (C) | 52,49 Дж К−1 моль−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −84 кДж моль−1 | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | −1561,0–−1560,4 кДж моль−1 | ||
| Опасности | |||
| Паспорт безопасности | Увидеть: страница данных inchem.org | ||
| Пиктограммы GHS |  | ||
| Сигнальное слово GHS | Опасность | ||
| H220, H280 | |||
| P210, P410 + 403 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -135 ° С (-211 ° F, 138 К) | ||
| 472 ° С (882 ° F, 745 К) | |||
| Пределы взрываемости | 2.9–13% | ||
| Родственные соединения | |||
Родственные алканы | |||
Родственные соединения | |||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Этан (/ˈɛθeɪп/ или /ˈяθeɪп/) является органический химическое соединение с участием химическая формула C
2ЧАС
6. В стандартная температура и давление, этан - бесцветный, без запаха газ. Как и многие углеводороды, этан изолированные в промышленных масштабах от натуральный газ и как нефтехимический побочный продукт нефтепереработка. Его основное использование - как сырье для этилен производство.
Родственные соединения могут быть образованы путем замены атома водорода другим функциональная группа; этан часть называется этильная группа. Например, этильная группа, связанная с гидроксил группа дает этиловый спирт, алкоголь в напитках.
История
Этан был впервые синтезирован в 1834 г. Майкл Фарадей, применяя электролиз из ацетат калия решение. Он принял углеводородный продукт этой реакции за метан и больше не исследовал это.[4] В период 1847–1849 гг., Пытаясь оправдать радикальная теория из органическая химия, Герман Кольбе и Эдвард Франкленд произвел этан за счет сокращения пропионитрил (этилцианид )[5] и этилйодид[6] с участием калий металла, и, как это сделал Фарадей, электролизом водный ацетаты. Они приняли продукт реакции за метильный радикал а не димер метила, этана. Эта ошибка была исправлена в 1864 г. Карл Шорлеммер, который показал, что продуктом всех этих реакций был этан.[7] Было обнаружено, что этан растворен в Пенсильванский свет сырая нефть от Эдмунд Рональдс в 1864 г.[8][9]
Название этан происходит из Номенклатура органической химии ИЮПАК. "Eth-" происходит от немецкого слова "питьевой спирт" (этанол),[10] и «-ан» относится к наличию одинарной связи между атомами углерода.
Свойства
При стандартной температуре и давлении этан представляет собой бесцветный газ без запаха. Он имеет температуру кипения -88,5 ° C (-127,3 ° F) и точку плавления -182,8 ° C (-297,0 ° F). Твердый этан существует в нескольких модификациях.[11] При охлаждении при нормальном давлении первой появляется модификация: пластиковый кристалл, кристаллизующийся в кубической системе. В этой форме положения атомов водорода не фиксированы; молекулы могут свободно вращаться вокруг длинной оси. Охлаждение этого этана ниже ок. 89,9 К (-183,2 ° C; -297,8 ° F) превращает его в моноклинный метастабильный этан II (космическая группа П 21 / н).[12] Этан очень плохо растворяется в воде.
Параметры связи этана были измерены с высокой точностью методами микроволновой спектроскопии и электронной дифракции: рC – C = 1,528 (3) Å, рC – H = 1.088 (5) Å и ∠CCH = 111.6 (5) ° микроволновым и рC – C = 1,524 (3) Å, рC – H = 1,089 (5) Å и CCH = 111,9 (5) ° по дифракции электронов (числа в скобках представляют погрешности в последних цифрах).[13]
Химия
Этан можно рассматривать как два метильные группы присоединился, то есть димер метильных групп. В лаборатории этан можно легко синтезировать с помощью Электролиз Кольбе. В этой технике водный раствор ацетат соль электролизованный. На анод, ацетат окисляется с образованием углекислый газ и метил радикалы и высокореакционные метильные радикалы объединяются с образованием этана:
Синтез окислением уксусный ангидрид от перекиси, концептуально похож.
Химия этана включает в основном свободнорадикальные реакции. Этан может реагировать с галогены, особенно хлор и бром, от свободнорадикальное галогенирование. Эта реакция протекает через распространение этил радикальный:
Поскольку галогенированные этаны могут подвергаться дальнейшему свободнорадикальному галогенированию, в результате этого процесса образуется смесь нескольких галогенированных продуктов. В химической промышленности для производства любого конкретного двухуглеродного галогеналкана используются более селективные химические реакции.
Горение
Полный горение этана выделяет 1559,7 кДж / моль, или 51,9 кДж / г тепла, и производит углекислый газ и воды согласно химическое уравнение
Горение также может происходить без избытка кислорода, образуя смесь аморфного углерода и монооксид углерода.
- 2 С2ЧАС6 + 3 О2 → 4 С + 6 ЧАС2О + энергия
- 2 С2ЧАС6 + 5 О2 → 4 СО + 6 ЧАС2О + энергия
- 2 С2ЧАС6 + 4 О2 → 2 С + 2 СО + 6 ЧАС2О + энергия и т. д.
Горение происходит в результате сложной серии свободнорадикальных реакций. Компьютерное моделирование из химическая кинетика горения этана включали сотни реакций. Важной серией реакций при горении этана является сочетание этильного радикала с кислород, и последующий распад образовавшихся перекись на этокси и гидроксильные радикалы.
Основными углеродсодержащими продуктами неполного сгорания этана являются одноуглеродные соединения, такие как монооксид углерода и формальдегид. Один важный маршрут, по которому углерод-углеродная связь в этане разлагается, с образованием этих одноуглеродных продуктов происходит разложение этокси радикальный в метил радикал и формальдегид, которые, в свою очередь, могут подвергаться дальнейшему окислению.
- C2ЧАС5O • → CH3• + CH2О
Некоторые второстепенные продукты неполного сгорания этана включают: ацетальдегид, метан, метанол, и этиловый спирт. При более высоких температурах, особенно в диапазоне 600–900 ° C (1112–1652 ° F), этилен это важный продукт. Он возникает в результате таких реакций:
Подобные реакции (с другими агентами, кроме кислорода в качестве отводящего водорода) участвуют в производстве этилена из этана в паровой крекинг.
Этановый барьер
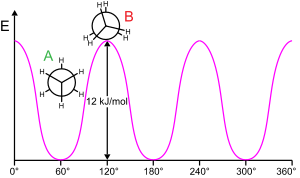
Для вращения молекулярной субструктуры вокруг скручивающейся связи обычно требуется энергия. Минимальная энергия для вращения связи на 360 ° называется вращательный барьер.
Этан является классическим и простым примером такого барьера вращения, который иногда называют «этановым барьером». Одно из первых экспериментальных доказательств существования этого барьера (см. Диаграмму слева) было получено путем моделирования энтропии этана.[15] Три атома водорода на каждом конце могут свободно вращаться вокруг центральной углерод-углеродной связи при наличии энергии, достаточной для преодоления барьера. Физическое происхождение барьера до сих пор полностью не установлено,[16] хотя перекрытие (обмен) отталкивание[17] между атомами водорода на противоположных концах молекулы, пожалуй, самый сильный кандидат со стабилизирующим эффектом сверхсопряжение на ступенчатом строении, способствующем явлению.[18] Однако теоретические методы, использующие подходящую начальную точку (ортогональные орбитали), обнаруживают, что гиперспряжение является наиболее важным фактором в возникновении барьера вращения этана.[19][20]
Еще в 1890–1891 гг. Химики предположили, что молекулы этана предпочитают шахматную конформацию, при которой два конца молекулы наклонены друг относительно друга.[21][22][23][24]
Производство
После метан, этан - второй по величине компонент натуральный газ. Содержание этана в природном газе из различных газовых месторождений варьируется от менее 1% до более 6% по объему. До 1960-х годов этан и более крупные молекулы обычно не отделялись от метанового компонента природного газа, а просто сжигались вместе с метаном в качестве топлива. Сегодня этан является важным нефтехимический сырье и отделен от других компонентов природного газа на большинстве хорошо разработанных газовых месторождений. Этан также можно отделить от нефтяной газ, смесь газообразных углеводородов, образующихся как побочный продукт нефтепереработка. Однако экономика строительства и эксплуатации перерабатывающих предприятий может измениться. Если относительная ценность отправки необработанного природного газа потребителю превышает ценность извлечения этана, извлечение этана может не начаться, что может вызвать эксплуатационные проблемы, связанные с изменением качества газа в последующих системах.[нужна цитата ]
Этан наиболее эффективно отделяется от метана путем его сжижения при криогенных температурах. Существуют различные стратегии охлаждения: наиболее экономичный процесс, широко используемый в настоящее время, включает турбодетандер, и может восстановить более 90% этана в природном газе. В этом процессе охлажденный газ расширяется через турбина, снижая температуру примерно до -100 ° C (-148 ° F). При такой низкой температуре газообразный метан можно отделить от сжиженного этана и более тяжелых углеводородов путем дистилляция. Дальнейшая перегонка отделяет этан от пропан и более тяжелые углеводороды.
Этан может образовываться из электролиз из ацетат соли:[нужна цитата ]
2 канала3COONa + 2 H2О → С2ЧАС6 + 2 СО2 + H2 + 2 NaOH
Использует
Основное использование этана - производство этен (этилен) от паровой крекинг. При разбавлении паром и кратковременном нагревании до очень высоких температур (900 ° C или более) тяжелые углеводороды распадаются на более легкие углеводороды и насыщенные углеводороды становиться ненасыщенный. Этан предпочтительнее для производства этена, потому что паровой крекинг этана довольно селективен для этена, в то время как паровой крекинг более тяжелых углеводородов дает смесь продуктов с более низким содержанием этена и более высоким содержанием более тяжелых углеводородов. алкены (олефины), такие как пропен (пропилен) и бутадиен, И в ароматические углеводороды.
Экспериментально этан исследуется как сырье для других товарных химикатов. Окислительный хлорирование этана долгое время считалось потенциально более экономичным способом винилхлорид чем хлорирование этена. Многие способы получения этой реакции были запатентованный, но плохая селективность для винилхлорид и разъедающий условия реакции (в частности, реакционная смесь, содержащая соляная кислота при температурах выше 500 ° C) препятствовали коммерциализации большинства из них. На данный момент, INEOS эксплуатирует 1000 т / год (тонны на год ) Опытная установка по производству этана в винилхлориде на Вильгельмсхафен в Германия.
Точно так же Саудовский фирма САБИК объявила о строительстве завода мощностью 30 000 тонн в год для производства уксусная кислота окислением этана при Янбу. Экономическая жизнеспособность этого процесса может зависеть от низкой стоимости этана вблизи саудовских нефтяных месторождений, и он может быть неконкурентоспособным с карбонилирование метанола в другом месте в мире.
Этан можно использовать в качестве хладагента в криогенных холодильных системах. В гораздо меньших масштабах в научных исследованиях жидкий этан используется для остекловывать богатые водой образцы для электронная микроскопия (криоэлектронная микроскопия ). Тонкая пленка воды, быстро погруженная в жидкий этан при температуре -150 ° C или ниже, замерзает слишком быстро, чтобы вода кристаллизовалась. Методы более медленного замораживания могут привести к образованию кубических кристаллов льда, которые могут нарушить мягкие конструкции за счет повреждения образцов и снижения качества изображения за счет рассеивания электронного луча до того, как он достигнет детектора.
Здоровье и безопасность
При комнатной температуре этан является чрезвычайно легковоспламеняющимся газом. При смешивании с воздухом в концентрации 3,0–12,5% по объему он образует взрывной смесь.
При хранении этана в виде криогенной жидкости необходимы некоторые дополнительные меры предосторожности. Прямой контакт с жидким этаном может привести к тяжелым обморожение. Пока они не нагреются до комнатной температуры, пары жидкого этана тяжелее воздуха и могут течь по полу или земле, собираясь в низких местах; если пары сталкиваются с источником возгорания, химическая реакция может вернуться к источнику этана, из которого они испарились.
Этан может вытеснить кислород и стать удушье опасность. Этан не вызывает острых или хронических заболеваний токсикологический риск. Это не канцероген.[25]
Атмосферный и внеземной этан

Этан присутствует как следовой газ в Атмосфера Земли, в настоящее время концентрация уровень моря 0,5 ppb,[26] хотя его доиндустриальная концентрация, вероятно, составляла всего около 0,25 части на миллиард, поскольку значительная часть этана в сегодняшней атмосфере могла образоваться как ископаемое топливо. Мировые количества этана со временем менялись, вероятно, из-за пылающий в месторождения природного газа.[27] Глобальные темпы выбросов этана снизились с 1984 по 2010 год,[27] хотя увеличился сланцевый газ производство на Формация Баккен в США остановил спад вдвое.[28][29]
Хотя этан парниковый газ, он гораздо менее распространен, чем метан, имеет срок службы всего несколько месяцев по сравнению с более чем десятилетием,[30] а также менее эффективно поглощает излучение по сравнению с массой. Фактически, этан потенциал глобального потепления в значительной степени является результатом его преобразования в атмосфере в метан.[31] Он был обнаружен как следовой компонент в атмосферах всех четырех планеты-гиганты, и в атмосфере Сатурн луна Титан.[32]
Атмосферный этан является результатом солнечного фотохимический воздействие на газообразный метан, также присутствующий в этих атмосферах: ультрафиолетовый фотоны более коротких длины волн чем 160 нм может фотодиссоциировать молекулу метана в метил радикальный и водород атом. Когда два метильных радикала рекомбинируют, получается этан:
- CH4 → CH3• + • H
- CH3• + • CH3 → С2ЧАС6
В атмосфере Земли гидроксильные радикалы превращают этан в метанол пар с периодом полураспада около трех месяцев.[30]
Когда-то было широко высказано предположение[кем? ] этан, произведенный таким образом на Титане, снова выплеснулся на поверхность Луны и со временем накапливался в углеводородных морях или океанах, покрывающих большую часть поверхности Луны. Инфракрасные телескопические наблюдения ставят под сомнение эту гипотезу, и Зонд Гюйгенса, который приземлился на Титане в 2005 году, не обнаружил никаких жидкостей на поверхности, хотя сфотографировал детали, которые в настоящее время могут быть сухими дренажными каналами. В декабре 2007 г. Зонд Кассини нашел по крайней мере одно озеро на южном полюсе Титана, которое теперь называется Онтарио Лакус из-за того, что площадь озера аналогична Озеро Онтарио на Земле (примерно 20000 км2). Дальнейший анализ данных инфракрасной спектроскопии представлен в июле 2008 г.[33] предоставили более убедительные доказательства присутствия жидкого этана в озере Онтарио.
В 1996 г. этан был обнаружен в Комета Хиякутаке,[34] и с тех пор он был обнаружен в некоторых других кометы. Наличие этана в этих далеких телах Солнечной системы может указывать на этан как на изначальный компонент солнечная туманность из которого, как полагают, образовались Солнце и планеты.
В 2006 году Дейл Крукшанк из НАСА / Исследовательского центра Эймса (a Новые горизонты соисследователь) и его коллеги объявили о спектроскопическом открытии этана на Плутон поверхность.[35]
Смотрите также
- Биогаз: углеродно-нейтральная альтернатива природному газу
- Биорефайнинг
- Биоразлагаемый пластик
- Вставной биопластик
- Мель актива
использованная литература
- ^ а б Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 4. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Точно так же сохраненные названия «этан», «пропан» и «бутан» никогда не заменялись систематическими названиями «дикарбан», «трикарбан» и «тетракарбан», как рекомендовалось для аналогов силана, «дисилан»; фосфан, «трифосфан»; и сульфан, «тетрасульфан».
- ^ «Этан - Резюме соединения». PubChem Compound. США: Национальный центр биотехнологической информации. 16 сентября 2004 г.. Получено 7 декабря 2011.
- ^ Лиде, Д. Р., изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. п. 8,88. ISBN 0-8493-0486-5.
- ^ Фарадей, Майкл (1834). «Экспериментальные исследования в электричестве: Седьмая серия». Философские труды. 124: 77–122. Bibcode:1834РСПТ..124 ... 77Ф. Дои:10.1098 / рстл.1834.0008. S2CID 116224057.
- ^ Кольбе, Германн; Франкленд, Эдвард (1849). «О продуктах действия калия на цианид этила». Журнал химического общества. 1: 60–74. Дои:10.1039 / QJ8490100060.
- ^ Франкленд, Эдвард (1850). «О выделении органических радикалов». Журнал химического общества. 2 (3): 263–296. Дои:10.1039 / QJ8500200263.
- ^ Шорлеммер, Карл (1864). "Ueber die Identität des Aethylwasserstoffs und des Methyls". Annalen der Chemie und Pharmacie. 132 (2): 234–238. Дои:10.1002 / jlac.18641320217.
- ^ Roscoe, H.E .; Шорлеммер, К. (1881). Трактат по химии. 3. Макмиллан. С. 144–145.
- ^ Уоттс, Х. (1868). Словарь по химии. 4. п. 385.
- ^ "определение этила". Dictionary.com. Получено 2016-03-12.
- ^ Van Nes, G.J.H .; Вос, А. (1978). «Монокристаллические структуры и распределения электронной плотности этана, этилена и ацетилена. I. Рентгеноструктурные определения монокристаллов двух модификаций этана» (PDF). Acta Crystallographica Раздел B. 34 (6): 1947. Дои:10.1107 / S0567740878007037.
- ^ «Этан как твердое вещество». Получено 2019-12-10.
- ^ Гармония, Марлин Д. (1990-11-15). «Равновесная длина одинарной связи углерод-углерод в этане». Журнал химической физики. 93 (10): 7522–7523. Bibcode:1990ЖЧФ..93.7522Н. Дои:10.1063/1.459380. ISSN 0021-9606.
- ^ Дж., Макмерри (2012). Органическая химия (8-е изд.). Бельмонт, Калифорния: Брукс. п. 95. ISBN 9780840054449.
- ^ Kemp, J.D .; Питцер, Кеннет С. (1937). «Энтропия этана и третий закон термодинамики. Затрудненное вращение метильных групп». Журнал Американского химического общества. 59 (2): 276. Дои:10.1021 / ja01281a014.
- ^ Эрколани, Г. (2005). «Определение вращательного барьера в этане с помощью колебательной спектроскопии и статистической термодинамики». J. Chem. Образовательный. 82 (11): 1703–1708. Bibcode:2005JChEd..82.1703E. Дои:10.1021 / ed082p1703.
- ^ Питцер, Р. (1983). «Барьер внутреннего вращения в этане». Соотв. Chem. Res. 16 (6): 207–210. Дои:10.1021 / ar00090a004.
- ^ Mo, Y .; Wu, W .; Песня, Л .; Lin, M .; Zhang, Q .; Гао, Дж. (2004). "Величина гиперконъюгации в этане: перспектива теории связи валентности Ab Initio". Энгью. Chem. Int. Эд. 43 (15): 1986–1990. Дои:10.1002 / anie.200352931. PMID 15065281.
- ^ Pophristic, V .; Гудман, Л. (2001). «Гиперконъюгация нестерического отталкивания приводит к шахматной структуре этана». Природа. 411 (6837): 565–8. Bibcode:2001Натура.411..565П. Дои:10.1038/35079036. PMID 11385566. S2CID 205017635.
- ^ Шрайнер П. Р. (2002). «Обучение правильным причинам: уроки ошибочного происхождения барьера вращения в этане». Angewandte Chemie International Edition. 41 (19): 3579–81, 3513. Дои:10.1002 / 1521-3773 (20021004) 41:19 <3579 :: AID-ANIE3579> 3.0.CO; 2-S. PMID 12370897.
- ^ Бишофф, Калифорния (1890 г.). "Ueber die Aufhebung der freien Drehbarkeit von einfach verbundenen Kohlenstoffatomen". Chem. Бер. 23: 623. Дои:10.1002 / cber.18900230197.
- ^ Бишофф, Калифорния (1891). "Теоретическая эргебниссе дер Студиен ин дер Бернштейнаурегруппа". Chem. Бер. 24: 1074–1085. Дои:10.1002 / cber.189102401195.
- ^ Бишофф, Калифорния (1891). "Die Dynamische Hypothese в ихрере Anwendung auf die Bernsteinsäuregruppe". Chem. Бер. 24: 1085–1095. Дои:10.1002 / cber.189102401196.
- ^ Bischoff, C.A .; Уолден, П. (1893). "Die Anwendung der Dynamischen Hypothese auf Ketonsäurederivate". Berichte der Deutschen Chemischen Gesellschaft. 26 (2): 1452. Дои:10.1002 / cber.18930260254.
- ^ Валлеро, Даниэль (7 июня 2010 г.). «Факторы наклона рака». Экологическая биотехнология: биосистемный подход. Академическая пресса. п. 641. Дои:10.1016 / B978-0-12-375089-1.10014-5. ISBN 9780123750891.
- ^ Следовые газы (в архиве). Atmosphere.mpg.de. Проверено 8 декабря 2011.
- ^ а б Симпсон, Изобель Дж .; Sulbaek Andersen, Mads P .; Мейнарди, Симоне; Брюхвайлер, Лори; Блейк, Никола Дж .; Хельмиг, Детлев; Роуленд, Ф. Шервуд; Блейк, Дональд Р. (2012). «Долгосрочное снижение глобальной концентрации этана в атмосфере и последствия для метана». Природа. 488 (7412): 490–494. Bibcode:2012Натура.488..490S. Дои:10.1038 / природа11342. PMID 22914166. S2CID 4373714.
- ^ Kort, E. A .; Smith, M. L .; Мюррей, Л. Т .; Гвахария, А .; Brandt, A. R .; Peischl, J .; Ryerson, T. B .; Суини, К .; Трэвис, К. (2016). «Неорганизованные выбросы из сланца Баккен иллюстрируют роль сланцевой добычи в глобальном изменении этана». Письма о геофизических исследованиях. 43 (9): 4617–4623. Bibcode:2016GeoRL..43,4617K. Дои:10.1002 / 2016GL068703.
- ^ «Одно нефтяное месторождение - главный виновник глобального увеличения выбросов этана». Университет Мичигана. 26 апреля 2016 г.
- ^ а б Айдын, Камил Мурат; Уильямс, М. и Saltzman, E.S .; «Возможность восстановления палеоатмосферных записей отдельных алканов, метилгалогенидов и серных газов из кернов льда Гренландии»; Журнал геофизических исследований; том 112, D07312
- ^ Ходнеброг, Ойвинд; Далсорен, Стиг Б. и Мире, Гуннар; «Время жизни, прямое и косвенное радиационное воздействие и потенциалы глобального потепления этана (C2ЧАС6), пропан (C3ЧАС8) и бутан (C4ЧАС10)’; Письма об атмосфере; 2018; 19: e804
- ^ Браун, Боб; и другие. (2008). «НАСА подтверждает жидкое озеро на Луне Сатурна». Лаборатория реактивного движения НАСА.
- ^ Brown, R.H .; Содерблом, Л. А .; Soderblom, J.M .; Clark, R.N .; Jaumann, R .; Barnes, J. W .; Сотин, Ц .; Buratti, B .; и другие. (2008). «Идентификация жидкого этана в озере Онтарио на Титане». Природа. 454 (7204): 607–10. Bibcode:2008Натура.454..607Б. Дои:10.1038 / природа07100. PMID 18668101. S2CID 4398324.
- ^ Мумма, Майкл Дж .; и другие. (1996). «Обнаружение большого количества этана и метана, а также окиси углерода и воды в комете C / 1996 B2 Hyakutake: свидетельства межзвездного происхождения». Наука. 272 (5266): 1310–1314. Bibcode:1996Научный ... 272.1310М. Дои:10.1126 / science.272.5266.1310. PMID 8650540. S2CID 27362518.
- ^ Стерн, А. (1 ноября 2006 г.). "Делаем старые горизонты новыми". Перспектива ИП. Лаборатория прикладной физики Университета Джона Хопкинса. Архивировано из оригинал 28 августа 2008 г.. Получено 2007-02-12.