Гидрид группы 14 - Википедия - Group 14 hydride
Группа 14 гидриды находятся химические соединения состоит из водород атомы и группа 14 атомов (элементы группы 14 - углерод, кремний, германий, банка, вести и флеровий ).
Тетрагидриды
Тетрагидридный ряд имеет химическую формулу XH4, где X представляет любой из углеродного семейства. Метан обычно является результатом разложения органических веществ и парниковый газ. Остальные гидриды обычно нестабильны, ядовиты. гидриды металлов.
Они принимают пирамидальную структуру и, как таковые, не являются полярными молекулами, как другие. p-блок гидриды.
В отличие от других легких гидридов, таких как аммиак, воды и фтороводород, метан не проявляет аномальных эффектов, связанных с водородная связь, и поэтому его свойства хорошо соответствуют преобладающей тенденции более тяжелых гидридов группы 14.
| Сложный | Химическая формула | Длина скрепления | Модель заполнения пространства |
|---|---|---|---|
| тетрагидрид углерода карбид водорода метан (карбан) | CH4 | 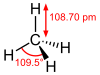 |  |
| тетрагидрид кремния силицид водорода (силан) | SiH4 | 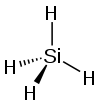 |  |
| тетрагидрид германия германид водорода (немецкий) | GeH4 |  |  |
| тетрагидрид олова станнид водорода (станнане) | SnH4 |  |  |
| тетрагидрид свинца водородный свинец (отвес) | PbH4 | 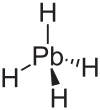 |  |
Гексагидриды
Эта серия имеет химическую формулу X2ЧАС6. Этан обычно встречается вместе с метаном в натуральный газ. Другие гидриды даже менее стабильны, чем тетрагидриды.
| Сложный | Химическая формула | Длина скрепления | модель |
|---|---|---|---|
| гексагидрид дикарбона этан (дикарбан) | C2ЧАС6 | 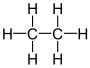 |  |
| гексагидрид дис кремния (дисилан) | Si2ЧАС6 |  |  |
| гексагидрид дигермания (дигерман) | Ge2ЧАС6 |  |  |
| гексагидрид дитина (distannane) | Sn2ЧАС6 |  |  |
Гидриды высшей группы 14
Все насыщенные гидриды группы 14 с прямой цепью подчиняются формуле XпЧАС2п+2, та же формула для алканы.
Известны многие другие гидриды группы 14. Углерод образует огромное количество разнообразных углеводороды (с пропан и бутан после метана и этана среди алканов, но также включая алкены, алкины, циклические и разветвленные соединения, а также ароматические углеводороды, такие как бензол, толуол и лимонен ), изучение которых составляет основу органическая химия.[1]
Наряду с водородом углерод может образовывать соединения с химически близкими галогены, формируя галогеналканы. Самый простой из этой серии - галометаны, содержат такие соединения, как дихлорметан и йодоформ. Другие такие важные химические вещества включают: винилхлорид, который используется в производстве ПВХ.
Другие элементы группы 14 имеют более низкую склонность к катетеризации. Силаны SiпЧАС2п+2 известны п = 1–8 (термостойкость убывает как п увеличивается), как и циклосиланы Si5ЧАС10 и Si6ЧАС12. Они очень реактивные, пирофорный бесцветные газы или летучие жидкости. Их волатильность занимает промежуточное положение между алканы и немцы.[2] Ненасыщенные силаны, силены и силинс, охарактеризованы спектроскопически. Первыми членами каждого соответственно являются Disilene и Дисилин кремниевые аналоги этилен и ацетилен ). Первые пять немцев GeпЧАС2п+2 известны и довольно похожи на силаны.[3] Станнан, сильный восстановитель, медленно разлагается при комнатной температуре на олово и газообразный водород и разлагается концентрированными водными кислотами или щелочами; distannane, Sn2ЧАС6 все еще более нестабилен, и более длинные станнаны неизвестны. Plumbane очень плохо охарактеризован и известен только в следовых количествах: даже при низких температурах методы синтеза, которые дают другие MH4 соединения не дают PbH4. Никаких других плюмбанов не известно.[4]
Известны соединения, содержащие водород и несколько элементов группы 14, одним из самых известных из которых является тетраэтилсвинец.
Смотрите также
Радикал гидридов 14 группы:
Рекомендации
Библиография
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.








