Циклооктатетраен - Википедия - Cyclooctatetraene
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Циклоокта-1,3,5,7-тетраен[1] | |||
| Другие имена [8] Аннулен (1Z,3Z,5Z,7Z) -Циклоокта-1,3,5,7-тетраен 1,3,5,7-Cyclooctatetraene СОТ | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.010.074 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C8ЧАС8 | |||
| Молярная масса | 104,15 г / моль | ||
| Внешность | Ясно желтый | ||
| Плотность | 0,9250 г / см3, жидкость | ||
| Температура плавления | От −5 до −3 ° C (от 23 до 27 ° F, от 268 до 270 K) | ||
| Точка кипения | От 142 до 143 ° C (от 288 до 289 ° F, от 415 до 416 K) | ||
| несмешиваемый | |||
| -53.9·10−6 см3/ моль | |||
| Опасности | |||
| Пиктограммы GHS |    | ||
| Сигнальное слово GHS | Опасность | ||
| H225, H304, H315, H319, H335 | |||
| P210, P233, P240, P241, P242, P243, P261, P264, P271, P280, P301 + 310, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P312, P321, P331, P332 + 313, P337 + 313, P362, P370 + 378, P403 + 233, P403 + 235, P405 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -11 ° С (12 ° F, 262 К) | ||
| 561 ° С (1042 ° F, 834 К) | |||
| Родственные соединения | |||
Связанный углеводороды | Циклооктан Тетрафенилен | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
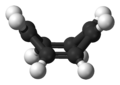
1,3,5,7-Cyclooctatetraene (СОТ) является ненасыщенный производная из циклооктан, с формулой C8ЧАС8. Он также известен как [8]аннулен. Этот полиненасыщенный углеводород представляет собой легковоспламеняющуюся жидкость от бесцветного до светло-желтого цвета при комнатной температуре. Из-за его стехиометрического отношения к бензол, COT был предметом многих исследований и некоторых противоречий.
В отличие от бензола, C6ЧАС6, циклооктатетраен, C8ЧАС8, не является ароматный, хотя его дианион, C
8ЧАС2−
8 (циклооктатетраенид ), является. Его реакционная способность характерна для обычного полиен, т.е. подвергается реакции присоединения. Бензол, напротив, обычно подвержен реакции замещения, а не дополнения.
История
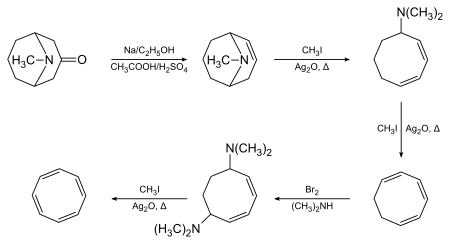
1,3,5,7-Циклооктатетраен был первоначально синтезирован Ричард Вильштеттер в Мюнхене в 1905 г., используя псевдопеллетерин в качестве исходного материала и Устранение Хофмана в качестве ключевого преобразования:[2][3]
Вильштеттер отметил, что соединение не проявляет ожидаемой ароматичности. Между 1939 и 1943 годами химики по всей территории США безуспешно пытались синтезировать СОТ. Они обосновали свое отсутствие успеха заключением, что Вильштеттер на самом деле синтезировал не соединение, а его изомер, стирол. Вильштеттер ответил на эти обзоры в своей автобиографии, где он отметил, что американские химики «не обеспокоены» восстановлением его циклооктатетраена до циклооктана (реакция невозможна для стирола). Во время Второй мировой войны Уолтер Реппе в BASF Людвигсхафен разработал простой одностадийный синтез циклооктатетраена из ацетилена, получив материал, идентичный материалу, полученному Willstätter.[4] Все оставшиеся сомнения в точности оригинального синтеза Вильштеттера были разрешены, когда Артур Коуп и его коллеги из Массачусетский технологический институт сообщил в 1947 году о полном повторении синтеза Вильштеттера, шаг за шагом, с использованием первоначально описанных методов. Они получили тот же циклооктатетраен,[5] и впоследствии они сообщили о современных спектральных характеристиках многих промежуточных продуктов, что еще раз подтвердило точность оригинальной работы Вильштеттера.[6]
Структура и склеивание

Ранние исследования показали, что COT не проявляет химический состав ароматического соединения.[7] Затем ранние эксперименты по дифракции электронов пришли к выводу, что расстояния связи C-C идентичны.[8] Однако данные дифракции рентгеновских лучей Х.С. Кауфмана продемонстрировали, что циклооктатетраен может принимать несколько конформации и содержать два различных расстояния связи C – C.[9] Этот результат показал, что СОТ является аннулен с фиксированными чередующимися одинарными и двойными связями C-C.
В своем нормальном состоянии циклооктатетраен не является плоским и принимает форму ванны с углами C = C − C = 126,1 ° и C = C − H = 117,6 °.[10] Точечная группа циклооктатетраена - это D2d.[11]
В своем плоском переходном состоянии D4ч переходное состояние более устойчиво, чем D8ч переходное состояние из-за Эффект Яна – Теллера.[12]
Синтез
Оригинальный синтез Ричарда Вильштеттера (4 последовательных реакции элиминации на циклооктановом каркасе) дает относительно низкие выходы. Реппе синтез циклооктатетраена, который включает лечение ацетилен при высоком давлении теплой смесью цианид никеля и карбид кальция, было намного лучше, с химические выходы около 90%:[4]
COT также может быть подготовлен фотолиз из Barrelene, один из структурные изомеры, реакция протекает через другой выделяемый изомер, полубулвален.[13] Производные COT также могут быть синтезированы посредством промежуточных соединений полубулвалена. В последовательности, показанной ниже, октаэтилциклооктатетраен (C8Et8) формируется термическая изомеризация октаэтилсемибулвалена, образованного бромид меди (I) опосредованный циклодимеризация 1,2,3,4-тетраэтил-1,4-дилитио-1,3-бутадиена.[14]
Поскольку СОТ нестабилен и легко образует взрывоопасные органические пероксиды, небольшое количество гидрохинон обычно добавляется к имеющемуся в продаже материалу. Рекомендуется провести анализ на перекиси при использовании ранее открытой бутылки; белые кристаллы вокруг горлышка бутылки могут состоять из пероксида, который может взорваться при механическом воздействии.
Естественное явление
Циклооктатетраен был выделен из некоторых грибов.[15]
Реакции
Π-связи в СОТ реагируют как обычно для олефинов, а не как ароматические кольцевые системы. Моно- и полиэпоксиды может быть произведено реакцией СОТ с пероксикислоты или с диметилдиоксиран. Известны также различные другие реакции присоединения. Более того, полиацетилен можно синтезировать через полимеризация с раскрытием кольца циклооктатетраена.[16] Сам COT - а также аналоги с боковыми цепями - использовались в качестве лигандов металлов и в сэндвич-смеси.
Циклооктатетраен также подвергается реакции перегруппировки формировать ароматическое кольцо системы. Например, окисление с водный сульфат ртути (II) формы фенилацетальдегид[4][17] и фотохимический перестановка его моно-эпоксид формы бензофуран.[18]
Циклооктатетраенид как лиганд и предшественник лиганда

COT легко реагирует с калий металл с образованием соли K2COT, содержащий дианион C
8ЧАС2−
8.[19] Дианион бывает плоским, восьмиугольным и ароматный с Электронный счет Хюккеля из 10.
Формы циклооктатетраена металлоорганические комплексы с некоторыми металлами, в том числе иттрий, лантаноиды, и актиниды.[20] В сэндвич-компаунд ураноцен (U (СОТ)2) имеет два ῃ8 -COT лиганды. В бис (циклооктатетраен) железо (Fe (COT)2) один СОТ равен ῃ6 а другой ῃ4. (Циклооктатетраен) трикарбонил железа особенности ῃ4-COT. Комнатная температура 1Спектры ЯМР 1Н этих комплексов железа представляют собой синглеты, что свидетельствует о текучесть.[21]

Циклооктатетраен хлорированный чтобы получить [4.2.0] -бициклический соединение, которое далее реагирует с диметилацетилендикарбоксилат в Реакция Дильса-Альдера (DA). Retro-DA при 200 ° C высвобождает цис-дихлорциклобутен. Это соединение реагирует с ди железо нонакарбонил давать циклобутадиен, трикарбонил железа.[22][23]
Смотрите также
- Циклобутадиен
- Пентален
- Barrelene, структурный изомер циклооктатетраена
- Гептафульвене, структурный изомер циклооктатетраена
- Семибулвален
- Бензол
Рекомендации
- ^ «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. С. P001 – P004. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Мейсон, С. (февраль 1997 г.). «Наука и гуманизм Лайнуса Полинга (1901–1994)». Chem. Soc. Ред. 26: 29–39. Дои:10.1039 / CS9972600029.
- ^ Вильштеттер, Ричард; Васер, Эрнст (1911). «Убер Циклооктатетраен» [О циклооктатетраене]. Berichte der Deutschen Chemischen Gesellschaft. 44 (3): 3423–3445. Дои:10.1002 / cber.191104403216.
- ^ а б c Реппе, Уолтер; Шлихтинг, Отто; Клагер, Карл; Тепель, Тим (1948). "Циклическая полимеризация по ацетилену. I. Убер циклооктатетраен" [Кольцевая полимеризация ацетилена. I. Циклооктатетраен. Юстус Либигс Аннален дер Хеми. 560 (1): 1–92. Дои:10.1002 / jlac.19485600102.
- ^ Коуп, Артур С .; Овербергер, К. Г. (1947). «Синтез циклооктатетраена из псевдопеллетиерина». Журнал Американского химического общества. 69 (4): 976. Дои:10.1021 / ja01196a513. PMID 20292490.
- ^ Коуп, Артур С .; Овербергер, К. Г. (1947). «Циклические полиолефины. I. Синтез циклооктатетраена из псевдопеллетиерина». Журнал Американского химического общества. 70 (4): 1433–1437. Дои:10.1021 / ja01184a041. PMID 18915758.
- ^ Джонсон, А. В. (1947). "Органическая химия". Sci. Прогр. 35 (139): 506–515. JSTOR 43413011.
- ^ Bastiensen, O .; Hassel, O .; Лангсет, А. (1947). «Окта-бензол», циклооктатетраен (C8ЧАС8)". Природа. 160 (4056): 128. Bibcode:1947 г.Натура.160..128Б. Дои:10.1038 / 160128a0.
- ^ Кауфман, Х. С .; Fankuchen, I .; Х., Марк (1948). «Строение циклооктатетраена». Природа. 161 (4083): 165. Bibcode:1948 г., природа, 161..165 тыс.. Дои:10.1038 / 161165a0.
- ^ Thomas, P. M .; Вебер, А. (1978). «Рамановская спектроскопия высокого разрешения газов с лазерными источниками. XIII - чистые вращательные спектры 1,3,5,7-циклооктатетраена и 1,5-циклооктадиена». Дж. Раман Спектр. 7 (6): 353–357. Bibcode:1978JRSp .... 7..353T. Дои:10.1002 / jrs.1250070614.
- ^ Клаус, К. Х .; Крюгер, К. (15 сентября 1988 г.). «Строение циклооктатетраена при 129 К». Acta Crystallogr. C. 44 (9): 1632–1634. Дои:10.1107 / S0108270188005840.
- ^ Нишинага, Тору; Омаэ, Такеши; Иёда, Масахико (5 февраля 2010 г.). «Последние исследования ароматичности и антиароматичности плоского циклооктатетраена». Симметрия. 2 (1): 76–97. Дои:10.3390 / sym2010076.
- ^ Zimmerman, H.E .; Грюневальд, Г. Л. (1966). "Химия баррелена. III. Уникальная фотоизомеризация до полубулвалена" (PDF). Варенье. Chem. Soc. 88 (1): 183–184. Дои:10.1021 / ja00953a045.
- ^ Wang, C .; Yuan, J .; Li, G .; Wang, Z .; Zhang, S .; Си, З. (2006). «Металл-опосредованный эффективный синтез, структурные характеристики и перестройка скелета октазамещенных полубулваленов». Варенье. Chem. Soc. 128 (14): 4564–4565. Дои:10.1021 / ja0579208. PMID 16594680.
- ^ Стинсон, М .; Ezra, D .; Hess, W. M .; Sears, J .; Штробель, Г. (2003). "Эндофитный Gliocladium sp. из Eucryphia cordifolia производство селективных летучих антимикробных соединений ». Завод науки. 165 (4): 913–922. Дои:10.1016 / S0168-9452 (03) 00299-1.
- ^ Мурхед, Эрик Дж .; Венцель, Анна Г. (август 2009 г.). «Два студенческих эксперимента в органических полимерах: получение полиацетилена и телехелического полиацетилена с помощью метатезисной полимеризации с раскрытием кольца». J. Chem. Educ. 86 (8): 973. Bibcode:2009JChEd..86..973M. Дои:10.1021 / ed086p973.
- ^ Куничика, Санго (1953). «Циклополиолефины, полученные из ацетилена». Бюллетень Института химических исследований Киотского университета. 31 (5): 323–335. HDL:2433/75368.
- ^ Головка, Ж. М .; Gardner, P.D .; Strow, C. B .; Hill, M. L .; Ван Аукен, Т. В. (1968). «Фотолиз и фотоизомеризация оксида циклооктатетраена». Журнал Американского химического общества. 90 (18): 5041–5043. Дои:10.1021 / ja01020a058.
- ^ Кац, Томас Дж. (1960). «Циклооктатетраенилдианион». Варенье. Chem. Soc. 82 (14): 3784–3785. Дои:10.1021 / ja01499a077.
- ^ Основные моменты проекта JST по наноструктурированным материалам - презентация профессора Накадзимы
- ^ Коттон, Ф. Альберт; Хантер, Дуглас Л. (1976). «Ядерно-магнитный резонанс углерода-13. Исследование флюсового поведения циклооктатетраентрикарбонилированного железа и -рутения». Журнал Американского химического общества. 98 (6): 1413–1417. Дои:10.1021 / ja00422a022.
- ^ Р. Петтит и Дж. Хенери (1970). "СНГ-дихлорциклобутен ». Органический синтез. 50: 36. Дои:10.15227 / orgsyn.050.0036.
- ^ «ЦИКЛОБУТАДИЕН В СИНТЕЗЕ: ЭНДО-ТРИЦИКЛО [4.4.0.02,5] ДЕКА-3,8-ДИЕН-7,10-ДИОН». Органический синтез. 55: 43. 1976. Дои:10.15227 / orgsyn.055.0043.