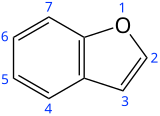
Бензофуран - Benzofuran
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 1-бензофуран[1] | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 107704 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.005.439 | ||
| Номер ЕС |
| ||
| 260881 | |||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1993 | ||
| |||
| |||
| Характеристики | |||
| C8ЧАС6О | |||
| Молярная масса | 118.135 г · моль−1 | ||
| Температура плавления | -18 ° С (0 ° F, 255 К) | ||
| Точка кипения | 173 ° С (343 ° F, 446 К) | ||
| Опасности | |||
| Пиктограммы GHS |   | ||
| Сигнальное слово GHS | Предупреждение | ||
| H226, H351, H412 | |||
| P201, P202, P210, P233, P240, P241, P242, P243, P273, P280, P281, P303 + 361 + 353, P308 + 313, P370 + 378, P403 + 235, P405, P501 | |||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 500 мг / кг (мыши).[2] | ||
| Родственные соединения | |||
Родственные соединения | Бензотиофен, Индол, Indene | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Бензофуран это гетероциклическое соединение состоящий из слитных бензол и фуран кольца. Эта бесцветная жидкость входит в состав каменноугольная смола. Бензофуран является «родителем» многих родственных соединений с более сложной структурой. Например, псорален представляет собой производное бензофурана, которое встречается в нескольких растениях.
Производство
Бензофуран добывают из каменноугольной смолы. Его также получают дегидрирование 2-этилафенол.[2]
Лабораторные методы
Бензофураны можно получить различными методами в лаборатории. Известные примеры включают:
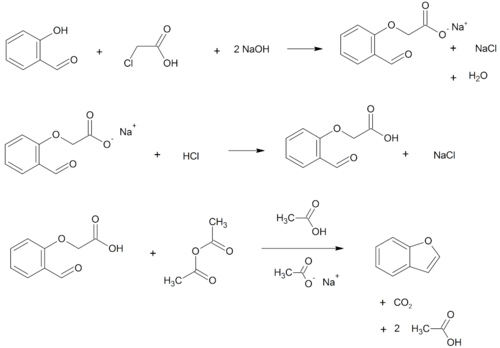
- О-алкилирование салициловый альдегид с хлоруксусная кислота с последующим обезвоживание (цикличность) полученного эфир и декарбоксилирование.[3]
- Реакция Дильса – Альдера из нитровинил фураны с различными диенофилы:[7]
Родственные соединения
- Замещенные бензофураны
- Фуран, аналог без предохранителя бензол звенеть.
- Индол, аналог с азот вместо кислород атом.
- Бензотиофен, аналог с сера вместо кислород атом.
- Изобензофуран, изомер с кислородом в соседнем положении.
- Аурон
- Тунбергинол F
- Бензофурановая база Шиффа
Рекомендации
- ^ а б «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 218. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ а б Collin, G .; Хёке, Х. (2007). «Бензофураны». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.l03_l01. ISBN 978-3527306732.
- ^ Burgstahler, A. W .; Уорден, Л. Р. (1966). «Кумарон» (PDF). Органический синтез. 46: 28.; Коллективный объем, 5, п. 251
- ^ Перкин, В. Х. (1870). «XXIX. О некоторых новых производных брома кумарина». Журнал химического общества. 23: 368–371. Дои:10.1039 / JS8702300368.
- ^ Перкин, В. Х. (1871). «IV. О некоторых новых производных кумарина». Журнал химического общества. 24: 37–55. Дои:10.1039 / JS8712400037.
- ^ Bowden, K .; Баттах, С. (1998). «Реакции карбонильных соединений в основных растворах. Часть 32. Перегруппировка Перкина». Журнал химического общества, Perkin Transactions 2. 1998 (7): 1603–1606. Дои:10.1039 / a801538d.
- ^ Kusurkar, R. S .; Бхосейл, Д. К. (1990). «Новый синтез бензозамещенных бензофуранов с помощью реакции Дильса-Альдера». Синтетические коммуникации. 20 (1): 101–109. Дои:10.1080/00397919008054620.
- ^ Фюрстнер, Алоис и Дэвис, Пол (2005). «Гетероциклы, катализируемые PtCl2 внутримолекулярным карбоалкоксилированием или карбоаминированием алкинов». Журнал Американского химического общества. 127 (43): 15024–15025. Дои:10.1021 / ja055659p. HDL:11858 / 00-001M-0000-0025-AA5A-1. PMID 16248631.