Ненасыщенный углеводород - Unsaturated hydrocarbon

Ненасыщенные углеводороды находятся углеводороды которые имеют двойной или тройной ковалентные связи между соседними углерод атомы. Термин «ненасыщенный» означает более водород атомы могут быть добавлены к углеводороду, чтобы сделать его насыщенным (т.е. состоящим из одинарных связей). Конфигурация ненасыщенных углеродов включает прямую цепь, такую как алкены и алкины, а также разветвленные цепи и ароматические соединения.
Кроме ароматические соединения, ненасыщенные углеводороды в основном реакционноспособны и подвергаются множественным реакциям с их кратными связями.
Номенклатура
Для более четкого общения и уменьшения недопонимания необходима последовательная система именования, которая дает начало номенклатуре ИЮПАК.
Некоторые стандартные шаги, которым необходимо следовать при присвоении названий молекулам ненасыщенных углеводородов номенклатуре ИЮПАК, описаны ниже.
- 1. Найдите и подсчитайте количество атомов углерода в самой длинной углеродной цепи и используйте соответствующий префикс числа. Например, если самая длинная углеродная цепь содержит три атома углерода, используйте префикс «проп-». Префикс числа атомов углерода от 1 до 10 представлен в таблице ниже.
| количество атомов углерода в самой длинной углеродной цепи | префикс | количество атомов углерода в самой длинной углеродной цепи | префикс |
|---|---|---|---|
| 1 | мет- | 2 | эт- |
| 3 | опора | 4 | но- |
| 5 | пент- | 6 | шестнадцатеричный |
| 7 | гепт- | 8 | окт- |
| 9 | не- | 10 | дека- |
- 2. Определите суффикс в зависимости от типа углеводород.
- Если присутствует одна или несколько двойных связей, используйте суффикс «-ene ”.
- Если присутствует одна или несколько тройных связей, используйте суффикс «-yne ”.
- Если присутствуют как двойные, так и тройные связи, используйте оба суффикса «-ene» и «-yne». «-Ene» обычно стоит перед «-yne», поскольку «e» лексикографически предшествует «y».
- 3. Подсчитайте количество двойных или тройных связей и укажите это числовым префиксом перед «-ene» или «-yne». Например, углеродная цепь с 4 атомами углерода, содержащая 2 двойные связи, будет называться «бутадиен”.
- 4. Добавьте числа между префиксом числа атомов углерода и «-ен» или «-ин», чтобы указать положение исходного углерода двойных или тройных связей. Например, углеродная цепь с 4 атомами углерода, содержащая двойную связь между вторым и третьим углеродом, будет называться «бут-2-ен”.
- 5. Наконец, используйте префикс перед префиксом количества атомов углерода, чтобы указать любой боковые цепи настоящее время. Прямая углеродная боковая цепь называется просто добавлением «-yl» после префикса, представляющего количество атомов углерода в этой цепи. Например, если этильная группа присоединена ко второму атому углерода в пент-2-ен, молекула будет называться «2-этилпент-2-ен». Для наименования более сложной боковой цепи обратитесь к Номенклатура органической химии ИЮПАК. Префиксы боковых цепей добавляются к окончательному названию лексикографически, что означает, что этильная группа появится раньше, чем метильная группа.
- Если соединение круглое, используйте префикс «цикло- ». Например, углеродное кольцо с 5 атомами углерода, содержащее 1 двойную связь, будет называться «циклопентен”.
Структура
Изомерия
В органическая химия, цис- и транс- префиксы используются для описания положения функциональных групп, прикрепленных к углерод атомы в двойной связи. На латыни цис и транс означают «с этой стороны» и «с другой стороны» соответственно. Следовательно, если функциональные группы находятся на одной стороне углеродной цепи, связь назначается цис- конфигурации, в противном случае (т.е. функциональные группы находятся на противоположной стороне углеродной цепи) связь назначается транс- конфигурация.

структура цис-2-бутена

структура транс-2-бутена

(E) -Бут-2-ен

(Z) -Бут-2-ен
Цис- и транс-конфигурация требует наличия углеродной цепи или хотя бы одного функциональная группа прикрепленный к каждому углероду одинаков. E- и Z-конфигурация может использоваться вместо этого в более общем случае, когда все четыре функциональные группы, присоединенные к атомам углерода в двойной связи, различны. E- и Z- являются сокращения немецких слов Zusammen (вместе) и Entgegen (противоположный). В E- и Z-изомерии каждой функциональной группе назначается приоритет на основе Правила приоритета Кана – Ингольда – Прелога. Если две группы с более высоким приоритетом находятся на одной стороне двойной связи, связь назначается Z- конфигурации, в противном случае (т.е. две группы с более высоким приоритетом находятся на противоположной стороне двойной связи) связь назначается E- конфигурация. Обратите внимание, что цис- и транс-конфигурация не имеет фиксированной связи с E- и Z-конфигурацией.
Орбитальная гибридизация
Углерод, как известно, имеет электронную конфигурацию 1 с.2 2 с2 2p2. Поскольку единственные неспаренные электроны, которые у него есть, это два на 2p-орбиталях, углерод теоретически способен образовывать только 2 одинарные связи. Однако это определенно неверно, поскольку в действительности каждый углерод в этене образует 2 одинарные связи и 1 двойную связь, тогда как каждый углерод в этине образует 1 одинарную связь и 1 тройную связь. Фактически, это странное явление возникает из-за орбитальной гибридизации.
В этиноподобных молекулах, где углерод образует 1 тройную связь и 1 одинарную связь, атом углерода подвергается sp-гибридизации, что означает, что 2s-орбиталь и одна 2p-орбиталь объединяются вместе с образованием двух sp-орбиталей, а две другие 2p-орбитали остаются неизменными. Угол между двумя sp-орбиталями составляет 180 °, и первая неизменная 2p-орбиталь перпендикулярна двум sp-орбиталям, в то время как вторая неизмененная 2p-орбиталь перпендикулярна обеим sp-орбиталям и первой неизменной 2p-орбитали. 4 электрона с 2s и 2p-орбиталей равномерно распределяются между двумя sp-орбиталями и двумя 2p-орбиталями (то есть по одному электрону на каждой орбитали). Во время образования связи одна sp-орбиталь углерода образует одинарную σ-связь с одним другим атомом, и в то же время оставшиеся одна sp-орбиталь и две 2p-орбитали образуют σ-связь, а также две π-связи (тройную связь) с другой атом, что приводит к линейной геометрии молекулы.
В этеноподобных молекулах, где углерод образует 1 двойную связь и 2 одинарные связи, атом углерода претерпевает sp2 гибридизация, означающая, что 2s-орбиталь и две 2p-орбитали объединяются вместе, чтобы сформировать три sp2 орбитали, а одна оставшаяся 2p-орбиталь остается неизменной. Три зр2 орбитали находятся в одной плоскости с углом 60 ° между каждыми двумя из них, а неизмененная 2p орбиталь перпендикулярна всем трем sp.2 орбитали. 4 электрона с 2s и 2p орбиталей равномерно распределяются между тремя sp2 орбитали и неизмененная 2p-орбиталь (то есть по одному электрону на каждой орбитали). При образовании связи два sp2 орбитали углерода образуют две отдельные одинарные σ-связи с двумя другими атомами соответственно, и в то же время оставшаяся одна sp-орбиталь и неизмененная 2p-орбиталь образуют σ-связь, а также π-связь (двойную связь) с другим атомом, приводя к тригональной плоской молекулярной геометрии.
Также есть зр3 гибридизация, при которой 2s-орбитали и все три 2p-орбитали объединяются вместе с образованием четырех sp3 орбитали. Углерод с зр3 гибридизация будет иметь тетраэдрическую молекулярную геометрию и, следовательно, является насыщенной.[1]
Степень ненасыщенности
Степень ненасыщенности - это расчет, используемый для измерения количества π связи в ненасыщенном органическая молекула. В общем соединении, состоящем из углерод, водород, кислород, азот, и галоген, формулу степени ненасыщенности можно выразить следующим образом:
- DU = 2C + N-F-H + 2/2
- C = количество атомов углерода в соединении
- N = количество атомов азота в соединении
- F = количество атомов галогена в соединении
- H = количество атомов водорода в соединении
- количество атомов кислорода или любое другое двухвалентные атомы не способствует степени ненасыщенности
Степень ненасыщенности также означает, что к соединению можно добавить не более 2х атомов водорода DU, чтобы сделать его насыщенным.
Физические свойства
Температура кипения и плавления
Это список, показывающий температуры кипения и плавления насыщенных и ненасыщенных углеводородов с одинаковым количеством атомов углерода.[2][3]
| Количество углерода | Температура плавления / кипения (° C ) | Алкан | Алкен | Алкин |
|---|---|---|---|---|
| 2 | Температура плавления | этан -183 | этен -169 | этин -80.7 |
| Точка кипения | этан -89 | этен -104 | этин -84.7 | |
| 3 | Температура плавления | пропан -190 | пропен -185 | пропин -102.7 |
| Точка кипения | пропан -42 | пропен -47 | пропин -23.2 | |
| 4 | Температура плавления | бутан -138 | 1-бутен -185.3 | 1-бутин -125.7 |
| Точка кипения | бутан -0.5 | 1-бутен -6.2 | 1-бутин 8.0 | |
| 5 | Температура плавления | пентан -130 | 1-пентен -165.2 | 1-пентин -90.0 |
| Точка кипения | пентан 36 | 1-пентен 29.9 | 1-пентин 40.1 |
Как и их насыщенный аналоги, ненасыщенные углеводороды обычно неполярный. Это означает, что межмолекулярные силы между молекулами ненасыщенных углеводородов в основном слабые. Сила Ван-дер-Ваальса. Точка кипения и точка плавления ненасыщенных углеводородов обычно аналогичны их насыщенным аналогам с таким же количеством углерода.
Температура плавления и кипения непредельных углеводородов по сравнению с насыщенными определяется двумя противоположными факторами. С одной стороны, сила Сила Ван-дер-Ваальса зависит от количества электронов в молекуле. У ненасыщенных углеводородов меньше электронов, чем у насыщенных, поэтому температура кипения и плавления может уменьшаться как межмолекулярная сила уменьшается. С другой стороны, делокализованные π-электроны, существующие в ненасыщенных углеводородах, облегчают поток электронов внутри одной молекулы, поэтому легче формировать временные диполи. Таким образом, сила Ван-дер-Ваальса также может увеличиваться из-за делокализации электронов. Оказывается, что алкины больше подвержены делокализации электронов и обычно имеют более высокие температуры кипения, чем алканы с таким же количеством углерода. Алкены больше зависят от количества электронов и имеют более низкие температуры кипения, чем алканы.[2]
Температуры кипения и плавления также зависят от стереохимии. В СНГ алкены из-за своей U-образной формы не могут располагаться так близко, как транс-алкены, поэтому они будут иметь более низкие температуры кипения и плавления.[2]
Для более длинных цепочек ненасыщенных углеводородов вышеуказанные эффекты все еще применимы. В более длинных цепочках стереохимический «зигзагообразный» эффект ненасыщенных углеводородов становится доминирующим эффектом, поэтому ненасыщенные длинноцепочечные углеводороды обычно имеют более низкие температуры кипения и плавления.[4] Разница в температуре плавления насыщенных и ненасыщенных толстый внутри человеческого тела также приводит к проблемам со здоровьем.
Растворимость
Ненасыщенные углеводороды, как и насыщенные, также неполярны. В результате они также обычно имеют низкую растворимость в воде. Их легче растворять в неполярных органических растворителях, таких как бензол.
Спектроскопические свойства
В сравнении с насыщенные углеводороды, ненасыщенные углеводороды не только содержат связи C − C и связи C − H, но также имеют C = C двойные связи и C≡C тройные облигации. В результате спектр будет также содержать характеристики этих π-связей. Подобно алканам, спектроскопия непредельных углеводородов не покажет характеристики других функциональные группы Такие как алкоголь (-OH) и карбоновая кислота (-COOH).
ИК-спектроскопия
Растяжение связи C = C даст ИК пик поглощения при 1670–1600см−1, в то время как изгиб связи C = C поглощает между 1000–650 см−1 длина волны. Растяжение связи C≡C поглощает 2100–2140 см−1(монозамещенные) и 2190–2260 см−1(дизамещенный).[5] Сила этих пиков поглощения зависит от места и количества двойных или тройных связей.
Из-за делокализованные π электроны в ароматный группы, изгиб связи C = C в этих группах обычно поглощает между 1500–1700 см−1.[6]
В то же время пики поглощения Связь C – H и C – C, которые являются общими с насыщенными углеводородами, также отображаются в ИК-спектре непредельных углеводородов.
ЯМР-спектроскопия
В 1ЧАС ЯМР спектроскопия, водород связанный с углеродом, прилегающим к двойным связям, даст δЧАС 4,5–6,5промилле Двойная связь также Deshield водород, присоединенный к атомам углерода, прилегающим к sp2 углерода, и это порождает δЧАС= 1,6–2. пики ppm. Ароматические группы будут иметь δЧАС= Пики 6,5–8,5 частей на миллион.[7] Поскольку π-связи образуют цис / транс-изомеры, изомеры ненасыщенных углеводородов будут выглядеть по-разному из-за различных J-муфта эффект. СНГ вицинальный константы взаимодействия водорода будут в диапазоне 6–14Гц, в то время как транс будет иметь константу связи 11–18 Гц.[8]
В 13Спектроскопия ЯМР 13С, по сравнению с насыщенными углеводородами, двойные и тройные связи также расщепляют атомы углерода, благодаря чему они имеют низкий сдвиг поля. Двойные связи C = C обычно имеют химический сдвиг около 100–170 м.д.[8]
Химические свойства
Горение
Как и большинство других углеводороды, непредельные углеводороды могут горение реакции, которые вызывают углекислый газ и воды в полное сгорание. Уравнение реакции:
- CИксЧАСу + y + 2x/2О2 → yH2O + xCO2
В отсутствие кислород, горение превратится в неполное сгорание и производить монооксид углерода и углерод.
Ненасыщенные углеводороды будут производить продукты неполного сгорания легче, чем насыщенные. В результате сгорание непредельных углеводородов обычно имеет желтый цвет. пламя, отличные от голубого пламени насыщенных. Это указывает на то, что горение ненасыщенных углеводородов будет включать многоступенчатые механизмы, а горение углерода дает желтый цвет пламени.
Поскольку в непредельных углеводородах меньше водорода, они производят меньше воды и уменьшают пламя. влага, а также уменьшить использование кислорода. Ацетилен (этин ), например, можно использовать в качестве топлива.[9]
По сравнению с синглом σ C − C связи в насыщенных углеводородах ненасыщенные имеют электронную плотность в π связи, которые не имеют большого перекрытия электронной плотности, как σ. В результате химическая энергия хранится в одной двойной связи меньше, чем в двух одинарных связях. Таким образом, при сжигании непредельных углеводородов, которое разрывает углерод-углеродные связи с высвобождением энергии, выделяется меньше энергии, чем при сжигании того же молярность насыщенных с таким же количеством атомов углерода. Эта тенденция хорошо видна в списке стандартная энтальпия горения углеводородов.[10]
| Количество углерода | Вещество | Тип | Формула | ЧАСcø(кДж / моль) |
|---|---|---|---|---|
| 2 | этан | насыщенный | C2ЧАС6 | −1559.7 |
| этен | ненасыщенный | C2ЧАС4 | −1410.8 | |
| этин | ненасыщенный | C2ЧАС2 | −1300.8 | |
| 3 | пропан | насыщенный | CH3CH2CH3 | −2219.2 |
| пропен | ненасыщенный | CH3CH = CH2 | −2058.1 | |
| пропин | ненасыщенный | CH3C≡CH | −1938.7 | |
| 4 | бутан | насыщенный | CH3CH2CH2CH3 | −2876.5 |
| бут-1-ен | ненасыщенный | CH2= CH − CH2CH3 | −2716.8 | |
| но-1-ин | ненасыщенный | CH≡C-CH2CH3 | −2596.6 |
Электрофильная добавка
Двойные или тройные связи, которые должны присутствовать в ненасыщенных углеводородах, обеспечивают высокую электронная плотность которые делают молекулы идеальными пятнами для реакции электрофильного присоединения. В реакции такого типа одна π-связь между атомами углерода разрывается на 2 отдельные σ-связи между каждым атомом углерода и добавленной группой. А карбокатион средний обычно участвует в механизме.

Гидрирование
Гидрирование - это электрофильное добавление водородный газ к непредельным углеводородам. В результате получится более насыщенный углеводород, но не обязательно станет насыщенным. Например, полугидрирование алкин может сформировать алкен. Тем не менее, общее количество π-связи должно уменьшаться в процессе. Для этого процесса также необходима связь π углерод – углерод.
Уравнение реакции гидрирования этен формировать этан является:
- ЧАС2C = CH2 + H2→ H3C − CH3
Реакция гидрирования обычно требует катализаторы увеличить ставка.
Общее количество водорода, которое может быть добавлено к ненасыщенному углеводороду, зависит от его степень ненасыщенности. Ненасыщенный углеводород с формулой CИксЧАСY может иметь не более 2X + 2-Y добавленных атомов водорода. Это сделает молекулу насыщенной.
Галогенирование
Подобно водороду, гетеролиз из галоген (ИКС2) создаст электрофильный Икс+ ион, после чего он будет атакован электроном по π связи. В отличие от водорода, галогенирование дает ионы галония в качестве промежуточного звена вместо карбокатионов в большинстве других случаев. Катион галония оставляет ограниченное пространство для X− ион для атаки и превратится только в транс товар. Конечным результатом галогенирования является уменьшение одной π связи и увеличение двух углерод-галогеновых σ-связей на 2 атомах углерода.

Уравнение реакции присоединения брома к этен, например, это:
- ЧАС2C = CH2 + Br2→ H2CBr − CH2Br (транс)
Бромный тест используется для проверки насыщенности углеводородами.[11] Тест включает добавление бромной воды к неизвестному углеводороду; Если бромная вода обесцвечивается углеводородом в результате реакции галогенирования, тогда можно сделать вывод, что углеводород является ненасыщенным. Если он не обесцвечен, значит, он насыщенный.
Тест на бром также может использоваться как индикатор степень ненасыщенности для непредельных углеводородов. Бромное число определяется как грамм брома, способного реагировать со 100 г продукта.[12] Подобно гидрированию, галогенирование брома также зависит от числа π-связи. Более высокое бромное число указывает на более высокую степень ненасыщенности.
Гидратация
Π-связь непредельных углеводородов также готова принять H+ и ОЙ− из воды. Реакция обычно включает сильная кислота в качестве катализатор.[13] Это потому, что первая стадия механизма гидратации включает депротонат π связи a H+ из сильной кислоты с образованием карбокатион. Конечным результатом реакции будет алкоголь.
Уравнение реакции гидратации этена:
- ЧАС2C = CH2 + H2O →ЧАС3C-CH2ОЙ
Π-связи в тройной связи также могут гидратироваться в кислых условиях и образовывать енолы. Тем не менее энол будет не продуктом, а промежуточным звеном, а конечный продукт будет кетон.[14] Промежуточный енол попадает под таутомеризация и образуют более стабильный кетон.
Уравнение реакции гидратации этина с образованием ацетальдегид является:
- HC≡CH + H2O → H2С = СН-ОН
- ЧАС2С = СН-ОН ⇌ Н3C − CHO
Гидрогалогенирование

Гидрогалогенирование включает добавление H-X к ненасыщенным углеводородам. Это уменьшит одну связь π C = C и приведет к образованию 2 связей C − H и C − X σ с двумя отдельными атомами углерода. Образование промежуточного карбокатиона является селективным и следует Правило марковникова. Гидрогалогенирование алкена приведет к галогеналкан, и гидрогалогенирование алкина приведет к винилгалогенид. Гидрогалогенирование алкина происходит намного медленнее, чем алкена.[15]
Уравнение реакции добавления HBr к этену:
- ЧАС2C = CH2 + HBr →ЧАС3C − CH2Br
Окисление
Окисление непредельных углеводородов зависит от прочности окислитель. Слабый окислитель приведет к дигидроксилирование, удаление одной π-связи с образованием двух σ-связей с кислород. Дигидроксилирование алкена дает диол,[16] и дигидроксилирование алкина дает вицинальный дикарбонил.[17]
Более сильный окислитель, например KMnO4 или же озон, приведет к окислительное расщепление. В этом случае π-связь разрывается с σ-связью, разделяя молекулу углеводорода на две. Кислород связывается с двумя оставшимися π-связями отдельно. Окислительное расщепление алкена дает кетоны или же альдегиды, в зависимости от места двойной связи,[18] и расщепление алкинов производит карбоновая кислота.[19]
Аллильное замещение
Связь π в ненасыщенных углеводородах будет понижать энергию диссоциации аллильных связей C − H, которые являются связями C − H углерода, примыкающего к sp.2 углерода. В результате замещение свободных радикалов реакция будет предпочтительнее реакций присоединения.[20]
Примером этого является NBS реакция бромирования алкеном. Связь N-Br в NBS является слабой, поэтому образуется много свободных радикалов Br. Свободный радикал атакует ослабленные аллильные водороды и замещает их атомами брома. Уравнение реакции:
- RCH2CH = CH2 + (CH2CO)2NBr → RCHBrCH = CH2 + RCH = CHCH2Br + (CH2CO)2N[21]
В результате реакции образуются два изомера с бромом, присоединенным к разным атомам углерода. Для реакции требуется большое количество свободных радикалов Br вместо электрофильного Br.+ ионы, которые пойдут на реакцию присоединения. NBS необходимо для создания такого условия.[22]
Если к аллильному углероду присоединены углеводородные группы, это сделает этот углерод более насыщенным. В соответствии с Правило Зайцева, этот углерод будет образовывать более стабильный промежуточный карбокатион. Как результат, аллильная перегруппировка произойдет, и π-связь переместится к этому углероду. Это приведет к образованию основного продукта брома, замещенного по четвертой углеродной связи от углеводородной группы.[23]
Циклоприсоединение

Для ненасыщенных углеводородов кольцевая структура и π-связи могут увеличивать степень ненасыщенности, при определенных условиях может происходить взаимообмен между кольцевой структурой и π-связями. Например, для сопряженный диен и замененный алкен, Реакция Дильса-Альдера произойдет, что образует циклогексен. Такая реакция очень избирательна в стереохимии.[24]
Алкины, например, под действием металлических катализаторов. кобальт, может также подвергаться реакции циклоприсоединения, называемой тримеризация алкинов. Три алкина подвергаются реакции циклизации «2 + 2 + 2» и быстро соединяются вместе с образованием бензол.Тримеризация различных алкенов обычно не является селективной, но специально разработанные катализаторы могут повысить селективность.[25]
Реагировать как лиганд

Делокализованная π-связь в ненасыщенных углеводородах обеспечивает высокую электронную плотность, что позволяет молекуле стать металлом. лиганд. В алкеновый лиганд, связующую структуру можно описать как Модель Дьюара – Чатта – Дункансона.[26] В этом случае π-электронная плотность передается d-орбиталям металла. Чем сильнее пожертвование, тем сильнее обратное соединение от d-орбитали металла к π * антисвязывающей орбитали алкена. Этот эффект снижает порядок связи алкена и увеличивает C-C длина облигации. В результате металл образует небольшую кольцевую структуру с двумя атомами углерода.
Модель DCD также может описывать алкин строение лиганда. Металлический комплекс также может быть промежуточным звеном тримеризация алкинов, поэтому металлы могут быть катализаторами реакции.
В синтез комплексов алкен-лиганд можно описать как электрофильная добавка реакция.
Подобно линейным ненасыщенным углеводородам, арен также имеет делокализованные π-связи, способные отдавать металлам с образованием сложный. В случаях вроде бензол, атомы углерода отдают металлу одинаковую электронную плотность, тогда как в некоторых других случаях атомы углерода отдают металлу по-разному, вызывая изгиб или деароматизацию арена.[27]
Заявление
Ненасыщенные углеводороды широко используются как пестициды, топливо, краски, и многое другое. Ниже представлена таблица некоторых распространенных промышленных ненасыщенных углеводородов.
| Имя | Структура | Использовать |
|---|---|---|
| этен |  |
|
| 1,3-бутадиен |  |
|
| бензол |  |
|
| толуол | 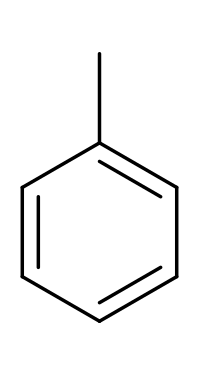 |
|
| нафталин |  |
|
Ненасыщенные углеводороды также используются во многих химических реакциях, чтобы синтезировать Другой соединения. Одна из их полезностей в этой области - использование в качестве мономеры в полимеризация реакции.В этих реакциях простые молекулы мономерных звеньев реагируют и связываются друг с другом либо линейно, либо нелинейно, чтобы синтезировать макромолекулы, давая либо полимер цепи или трехмерные конструкции. Во время полимеризации двойная связь в мономерах обычно превращается в одинарная облигация так что две другие молекулы мономера могут присоединяться с обеих сторон. Некоторые продукты реакций полимеризации тесно связаны с нашей повседневной жизнью. Например, один из распространенных видов пластика, полиэтилен, - полимеризация товар из этилен. Также, Пенополистирол (полистирол) синтезируется в результате полимеризации стирол.[28]
Смотрите также
Рекомендации
- ^ «Гибридизация». Химия LibreTexts. 2013-10-02. Получено 2019-06-03.
- ^ а б c Нгуен, Трунг; Кларк, Джим (23 апреля 2019 г.). «Физические свойства алкенов». Химия LibreTexts. Получено 27 мая, 2019.
- ^ Офардт, Чарльз (2003). «ТОЧКИ КИПЕНИЯ И СТРУКТУРЫ УГЛЕВОДОРОДОВ». Виртуальный чембук. Получено 27 мая, 2019.
- ^ Офардт, Чарльз (2003). "Жирные кислоты". Виртуальный чембук. Получено 29 мая, 2019.
- ^ «Таблица и диаграмма ИК-спектра». Сигма-Олдрич. Получено 5 мая, 2019.
- ^ Мерлик, Крейг А. «Таблица ИК-поглощений». Webspectra. Получено 5 мая, 2019.
- ^ Хэнсон, Джон. «Обзор химических сдвигов в H-ЯМР». ups.edu. Получено 5 мая, 2019.
- ^ а б «Ядерный магнитный резонанс (ЯМР) алкенов». Химия LibreTexts. 23 апреля 2019 г.,. Получено 5 мая, 2019.
- ^ «Ацетилен Самый горячий и самый эффективный топливный газ». Linde. Получено 5 мая, 2019.
- ^ «Органические соединения: физические и термохимические данные». ucdsb.on.ca. Получено 5 мая, 2019.
- ^ Р.Л. Шрайнер, К.К.Ф. Германн, Т. Моррилл, Д. Куртин, Р. Фусон (1997). Систематическая идентификация органических соединений. Джон Вили и сыновья. ISBN 0-471-59748-1.CS1 maint: несколько имен: список авторов (связь)
- ^ «Бромное число». Компания Hach. Получено 5 мая, 2019.
- ^ Кларк, Джим (ноябрь 2007 г.). «Механизм кислотно-катализируемой гидратации этена». Chemguide. Получено 6 мая, 2019.
- ^ «Увлажнение алкинов». Chem LibreTexts. 2 мая, 2019. Получено 6 мая, 2019.
- ^ «Реакции алкинов - добавление HX и X»2". Chem LibreTexts. 2 мая, 2019. Получено 6 мая, 2019.
- ^ Кеннепол, Дитмар; Фермер, Стивен (13 февраля 2019 г.). «Окисление алкенов - эпоксидирование». Химия LibreTexts. Получено 27 мая, 2019.
- ^ Кеннепол, Дитмар; Фермер, Стивен (13 февраля 2019 г.). «Окисление алкинов». Химия LibreTexts. Получено 27 мая, 2019.
- ^ Кеннепол, Дитмар; Фермер, Стивен (22 мая 2019 г.). «Окисление алкенов - расщепление до карбонильных соединений». Химия LibreTexts. Получено 27 мая, 2019.
- ^ Кеннепол, Дитмар; Фермер, Стивен (10 мая 2019 г.). «Окислительное расщепление алкинов». Химия LibreTexts. Получено 27 мая, 2019.
- ^ «Радикальное аллильное галогенирование». Chem LibreTexts. 30 июня 2018 г.. Получено 6 мая, 2019.
- ^ Ройш, Уильям (19 октября 2013 г.). «Аллильная замена». Chem LibreTexts. Получено 6 мая, 2019.
- ^ Эшенхерст, Джеймс (25 ноября 2013 г.), «Аллильное бромирование», Магистр органической химии, получено 6 мая, 2019
- ^ Эшенхерст, Джеймс (2 декабря 2013 г.), «Дополнительная тема: аллильные перестановки», Магистр органической химии, получено 6 мая, 2019
- ^ "Реакция Дильса-Альдера". Портал органической химии. Получено 27 мая, 2019.
- ^ Галан, Брэндон; Ровис, Томислав (7 июля 2010 г.). "Beyond Reppe: Создание замещенных бензолов с помощью [2 + 2 + 2] циклоприсоединений алкинов". Angew Chem Int Ed Engl. 48 (16): 2830–4. Дои:10.1002 / anie.200804651. ЧВК 2898745. PMID 19229917.
- ^ Тореки, Роб (31 марта 2015 г.). «Алкеновые комплексы». Металлоорганический гипертекст. Получено 29 мая, 2019.
- ^ Эванс, Майкл (15 октября 2018 г.). "π Системы". Химия LibreTexts. Получено 29 мая, 2019.
- ^ S, Роберт. «Ненасыщенный углеводород: определение и примеры». study.com. Получено 31 мая, 2019.







