Правила приоритета Кана – Ингольда – Прелога - Cahn–Ingold–Prelog priority rules
Эта статья нужны дополнительные цитаты для проверка. (Февраль 2016 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
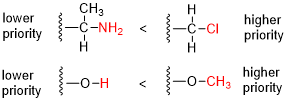
В Кан – Ингольд – Прелог (CIP) правила последовательности, названный в честь химики-органики Роберт Сидни Кан, Кристофер Келк Ингольд, и Владимир Прелог - альтернативно названный Правила приоритета CIP, система, или же условности - стандартный процесс, используемый в органическая химия полностью и однозначно назвать стереоизомер молекулы.[1][2]:26 Целью системы CIP является присвоение р или же S дескриптор каждому стереоцентру и E или же Z дескриптор к каждой двойной связи, так что конфигурация всей молекулы может быть определена однозначно путем включения дескрипторов в ее систематическое имя. Молекула может содержать любое количество стереоцентры и любое количество двойные связи, и каждый обычно дает два возможных изомера. Молекула с целым числом п описывая количество своих стереогенные центры обычно будет 2п стереоизомеры, и 2п−1 диастереомеры, каждый из которых имеет связанную пару энантиомеров.[3][4] Правила последовательности CIP способствуют точному названию каждого стереоизомера каждого органический и металлоорганический молекула со всеми атомами связка менее 4 (но включая также лигантность 6, этот термин относится к «числу соседних атомов», связанных с центром).[2]:26f[4]
Ключевая статья, устанавливающая правила последовательности CIP, была опубликована в 1966 году.[5] и последовали дальнейшие уточнения,[6] прежде, чем это было включено в правила Международный союз теоретической и прикладной химии (IUPAC), официальный орган, определяющий органическая номенклатура, в 1974 г.[2]:26ff С тех пор правила были пересмотрены, последний раз в 2013 году.[7] как часть книги ИЮПАК Номенклатура органической химии. Представленные ИЮПАК правила представляют собой официальный формальный стандарт для их использования, и в нем отмечается, что «метод был разработан для охвата всех соединений с лигансией до 4 ... и ... [расширен на случай] лигантности 6 ... [а также] для всех конфигураций и конформаций таких соединений ".[2]:26ff Тем не менее, хотя документация ИЮПАК представляет собой подробное введение, она включает предупреждение о том, что «важно изучить исходные статьи, особенно статью 1966 года, прежде чем использовать правило последовательности для иных, чем довольно простых случаев».[2]:26f
В недавней статье приводятся доводы в пользу изменения некоторых правил (правила последовательности 1b и 2) для обращения к определенным молекулам, для которых правильные дескрипторы не были ясны.[8] Однако остается другая проблема: в редких случаях два разных стереоизомера одной и той же молекулы могут иметь одинаковые дескрипторы CIP, поэтому система CIP не может однозначно назвать стереоизомер, и другие системы могут быть предпочтительнее.[9](27)
Шаги по именованию
Шаги для наименования молекул с использованием системы CIP часто представлены как:
- Идентификация стереоцентры и двойные связи;
- Присвоение приоритетов группам, присоединенным к каждому стереоцентру или атому с двойной связью; и
- Присвоение р/S и E/Z дескрипторы.
Распределение приоритетов
р/S и E/Z дескрипторы назначаются с использованием системы ранжирования приоритета групп, прикрепленных к каждому стереоцентру. Эта процедура, часто известная как правила последовательности, является сердцем системы CIP. Обзор в этом разделе опускает некоторые правила, которые необходимы только в редких случаях.
- Сравните атомный номер (Z) атомов, непосредственно связанных со стереоцентром; группа, имеющая атом с большей атомной массой, получает более высокий приоритет.
- Если есть связь, мы должны рассматривать атомы на расстоянии 2 от стереоцентра - так как список составляется для каждой группы атомов, связанных с группой, непосредственно присоединенной к стереоцентру. Каждый список упорядочен в порядке убывания атомного номера. Затем списки сравниваются атом за атомом; при самом раннем различии группа, содержащая атом с более высоким атомным номером, получает более высокий приоритет.
- Если связь все еще существует, каждый атом в каждом из двух списков заменяется подсписком других атомов, связанных с ним (на расстоянии 3 от стереоцентра), подсписки располагаются в порядке убывания атомного номера, и все подсписки структура снова сравнивается атом за атомом. Этот процесс повторяется рекурсивно, каждый раз с атомами на одну связь дальше от стереоцентра, пока связь не будет разорвана.
Изотопы
Если две группы отличаются только изотопы, то чем больше атомная масса используется для установки приоритета.
Двойные и тройные связи

Если атом A имеет двойную связь с атомом B, A рассматривается как одинарно связанный с двумя атомами: B и «призрачный атом», который является дубликатом B (имеет тот же атомный номер), но не связан ни с чем. за исключением A. Когда B заменяется списком присоединенных атомов, A сам A, но не его «призрак», исключается в соответствии с общим принципом отсутствия удвоения по только что выполненной связи. Тройная связь обрабатывается так же, за исключением того, что каждый из A и B связан с двумя призрачными атомами другого.[2]:28
Геометрические изомеры
Если два заместителя у атома геометрические изомеры друг друга, Z-изомер имеет более высокий приоритет, чем E-изомер.
Циклические молекулы
Для работы с молекулой, содержащей один или несколько циклы, необходимо сначала разложить его на дерево (называется иерархический орграф), проходя связи по всем возможным путям, начиная со стереоцентра. Когда обход встречает атом, через который уже прошел текущий путь, генерируется призрачный атом, чтобы дерево оставалось конечным. Один атом исходной молекулы может появляться во многих местах (некоторые как призраки, некоторые нет) на дереве.[10](572)
Назначение дескрипторов
Стереоцентры: р/S

После заместители из стереоцентр были назначены их приоритеты, молекула ориентирована в пространстве так, что группа с самым низким приоритетом направлена в сторону от наблюдателя. Если заместители пронумерованы от 1 (высший приоритет) до 4 (низший приоритет), то направление вращения кривой, проходящей через 1, 2 и 3, отличает стереоизомеры. Центр с направлением вращения по часовой стрелке - это р (прямая мышца) центр и центр с направлением вращения против часовой стрелки является S (зловещий) центр. Имена происходят от латинский для «правого» и «левого» соответственно.[11][12]

Практический метод определения того, является ли энантиомер р или же S с помощью правило правой руки: оборачивают молекулу пальцами в направлении 1 → 2 → 3. Если большой палец указывает в сторону четвертого заместителя, энантиомер р; в противном случае это S.
В редких случаях возможно, что два заместителя у атома отличаются только своей абсолютной конфигурацией (р или же S). Если необходимо установить относительные приоритеты этих заместителей, р имеет приоритет над S. Когда это происходит, дескриптор стереоцентра представляет собой строчную букву (р или же s) вместо обычно используемой заглавной буквы.[13]
Двойные связи: E/Z
Для алкенов и аналогичных молекул с двойной связью применяется тот же процесс определения приоритетов для заместителей. В этом случае имеет значение размещение двух заместителей с наивысшим приоритетом по отношению к двойной связи. Если оба высокоприоритетных заместителя находятся на одной стороне двойной связи, т.е. СНГ конфигурация, то стереоизомер назначается Z (Zusammen). Если, напротив, они находятся в транс конфигурация, то стереоизомеру присваивается E (Entgegen). В этом случае идентифицирующие буквы происходят от Немецкий для «вместе» и «напротив» соответственно.
Примеры
Ниже приведены примеры применения номенклатуры.[14]
р/S задания для нескольких соединений 
Гипотетическая молекула бромхлорфториодметан показано в его (р) -конфигурация будет очень простым хиральным соединением. Приоритеты назначаются исходя из атомный номер (Z): йод (Z = 53) > бром (Z = 35) > хлор (Z = 17) > фтор (Z = 9). Позволяя фтору (самый низкий приоритет) указывать в сторону от зрителя, вращение происходит по часовой стрелке, следовательно, р назначение. 
В поручении L-серин наивысший приоритет отдается азот атом (Z = 7) в аминогруппа (NH2). Оба гидроксиметил группа (CH2ОН) и карбоновая кислота группа (COOH) имеет атомы углерода (Z = 6), но приоритет отдается последнему, потому что атом углерода в группе COOH связан со вторым кислородом (Z = 8), тогда как в CH2Группа ОН углерод подключен к водород атом (Z = 1). Наименьший приоритет дается атому водорода, и, поскольку этот атом направлен в сторону от наблюдателя, уменьшение приоритета против часовой стрелки над тремя оставшимися заместителями завершает присвоение, как S. 
Стереоцентр в (S) -карвон связан с одним атомом водорода (не показан, приоритет 4) и тремя атомами углерода. В изопропенил группа имеет приоритет 1 (только атомы углерода), а для двух оставшихся атомов углерода приоритет определяется атомами углерода, двумя связями, удаленными из стереоцентра, одной части кето группа (O, O, C, приоритет 2) и одна часть алкена (C, C, H, приоритет 3). В результате вращение против часовой стрелки приводит к S.
Описание нескольких центров
Если соединение имеет более одного стереоцентра, каждый центр обозначается либо р или же S. Например, эфедрин существует с обоими (1р,2S) и (1S,2р) конфигурация, известная как энантиомеры. Это соединение также существует с (1р,2р) и (1S,2S) конфигурация. Последние два стереоизомера не эфедрин, а псевдоэфедрин. Все изомеры представляют собой 2-метиламино-1-фенил-1-пропанол в систематической номенклатуре. Псевдоэфедрин химически отличается от эфедрина только трехмерной конфигурацией в пространстве, как указано в правилах Кана-Ингольда-Прелога. Два соединения, эфедрин и псевдоэфедрин, являются диастереомеры или стереоизомеры, которые не являются энантиомерами. У них разные названия, потому что как диастереомеры они имеют разные химические свойства.
В парах энантиомеров все дескрипторы противоположны: (р,р) и (S,S), или же (р,S) и (S,р). У диастереомеров есть один общий дескриптор: (р,S) и (р,р), или же (S,р) и (S,S). Это верно для соединений с более чем двумя стереоцентрами; если хотя бы один дескриптор одинаков в обеих парах, соединения являются диастереомерами. Если все стереоцентры противоположны, они энантиомеры.
Относительная конфигурация
Относительная конфигурация двух стереоизомеры могут быть обозначены дескрипторами р и S с звездочка (*). (р*,р*) означает два центра одинаковой конфигурации, (р,р) или же (S,S); (р*,S*) означает два центра, имеющих противоположные конфигурации, (р,S) или же (S,р). Для начала стереогенному центру с наименьшим номером (согласно систематической нумерации IUPAC) дается р* дескриптор.
Обозначить два аномеры используются относительные стереодескрипторы альфа (α) и бета (β). В α-аномере аномерный атом углерода и эталонный атом имеют противоположные конфигурации (р,S) или же (S,р), тогда как в β-аномере они такие же (р,р) или же (S,S).[15]
Лица
Стереохимия также играет роль лица к тригональным молекулам, таким как кетоны. А нуклеофил в нуклеофильное присоединение может приблизиться к карбонил группа с двух противоположных сторон или лиц. Когда атакует ахиральный нуклеофил ацетон, обе грани идентичны и есть только один продукт реакции. Когда нуклеофил атакует бутанон, лица не идентичны (энантиотопный ) и рацемический продукт полученные результаты. Когда нуклеофил хиральный молекула диастереоизомеры сформированы. Когда одна грань молекулы экранирована заместителями или геометрическими ограничениями по сравнению с другой гранью, эти грани называются диастереотопный. Те же правила, которые определяют стереохимию стереоцентра (р или же S) также применимы при назначении грани молекулярной группы. Затем лица называются Re-лицо и Si-лицо. В примере, показанном справа, соединение ацетофенон рассматривается с Re-лицо. Добавление гидрида, как в процессе восстановления с этой стороны, сформирует (S) -энантиомер и атака с противоположной стороны Si-face даст (р) -энантиомер. Однако следует отметить, что добавление химической группы к прохиральному центру от Re-face не всегда приводит к (S) -стереоцентр, так как необходимо учитывать приоритет химической группы. То есть абсолютная стереохимия продукта определяется сама по себе, а не с учетом того, с какой стороны он подвергся атаке. В приведенном выше примере, если хлористый (Z = 17) были добавлены к прохиральному центру из Re-face, это приведет к (р) -энантиомер.
Рекомендации
- ^ Марш, Джерри; Майкл Б., Смит (2007). Продвинутая органическая химия марта: реакции, механизмы и структура (6. изд.). Хобокен, Нью-Джерси: Wiley-Interscience. С. 155–162. ISBN 978-0-471-72091-1.
- ^ а б c d е ж Кросс, L.C; Клайн, В. (1974). Правила номенклатуры органической химии: Раздел E: Стереохимия (Рекомендации 1974 г.) (PDF). ISBN 978-0-08-021019-3. Архивировано из оригинал (PDF) на 2016-04-07.
- ^ Клейден, Джонатан; Гривс, Ник и Уоррен, Стюарт (2012). Органическая химия (2-е изд.). Оксфорд, Великобритания: Издательство Оксфордского университета. стр. 316f. ISBN 978-0199270293. Получено 2 февраля 2016.
- ^ а б «Обычно» основано на том факте, что молекулы с хиральными центрами, тем не менее, могут иметь зеркальные плоскости симметрии, например мезосоединения, которые делают некоторые из стереоизомеров «вырожденными» (идентичными), так что это математическое выражение переоценивает их число. См. Clayden, op. соч., стр. 317.
- ^ Кан, Р.; Ингольд, К.; Прелог, В. (1966). «Спецификация молекулярной хиральности». Angewandte Chemie International Edition. 5 (4): 385–415. Дои:10.1002 / anie.196603851.
- ^ Прелог, В. & Гельмхен, Г. (1982). «Основные принципы CIP-системы и предложения по доработке». Angewandte Chemie International Edition. 21 (8): 567–58. Дои:10.1002 / anie.198205671.
- ^ Отдел химической номенклатуры и структуры ИЮПАК (2013 г.). «П-9». In Favre, Henri A .; Пауэлл, Уоррен Х. (ред.). Номенклатура органической химии: рекомендации и предпочтительные наименования ИЮПАК, 2013 г.. ИЮПАК –RSC. ISBN 978-0-85404-182-4.
- ^ Хэнсон, Роберт М .; Мэйфилд, Джон; Вайнио, Микко; Ерин, Андрей; Редькин Дмитрий Владимирович; Мусаккио, София (30 июля 2018 г.). "Алгоритмический анализ правил стереохимии Кана-Ингольда-Прелога: предложения по пересмотренным правилам и руководство по машинной реализации". Журнал химической информации и моделирования. 58 (9): 1755–1765. Дои:10.1021 / acs.jcim.8b00324. PMID 30059222.
- ^ Мэйфилд, Джон; Лоу, Дэниел; Сэйл, Роджер (2017). Сравнение реализаций CIP: необходимость открытой CIP. Тезисы докладов Американского химического общества. 254. Получено 2020-07-22. Аннотация на сайте издателя

- ^ Прелог, Владлмир; Хельмхен, Гюнтер (август 1982 г.). «Основные принципы CIP-системы и предложения по доработке». Angewandte Chemie International Edition на английском языке. 21 (8): 567–583. Дои:10.1002 / anie.198205671.
- ^ Кляйн, Дэвид Р. (31 декабря 2013 г.). Органическая химия (2-е изд.). Вайли. п. 203. ISBN 978-1118454312.
- ^ Кан, Р. С. (март 1964 г.). «Введение в правило последовательности: система для спецификации абсолютной конфигурации». Журнал химического образования. 41 (3): 116. Bibcode:1964JChEd..41..116C. Дои:10.1021 / ed041p116.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "псевдоасимметричный атом углерода ". Дои:10.1351 / goldbook.P04921
- ^ Гарольд Харт; Кристофер М. Хадад; Лесли Э. Крейн; Дэвид Дж. Харт (1 января 2011 г.). Органическая химия: краткий курс. Cengage Learning. С. 177–. ISBN 978-1-133-17283-3.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "Относительная конфигурация ". Дои:10.1351 / goldbook.R05260




