Деоксигенация Бартона – Маккомби - Barton–McCombie deoxygenation
| Деоксигенация Бартона – Маккомби | |
|---|---|
| Названный в честь | Дерек Гарольд Ричард Бартон Стюарт В. Маккомби |
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | Бартон-Маккомби-реакция |
| RSC ID онтологии | RXNO: 0000134 |
В Деоксигенация Бартона – Маккомби является органическая реакция в котором гидрокси функциональная группа в органическое соединение заменяется на водород дать алкильная группа.[1][2] Он назван в честь британских химиков сэр Дерек Гарольд Ричард Бартон (1918–1998) и Стюарт В. Маккомби.

Эта реакция деоксигенации радикальное замещение. В связанных Декарбоксилирование Бартона реагент - это карбоновая кислота.
Механизм
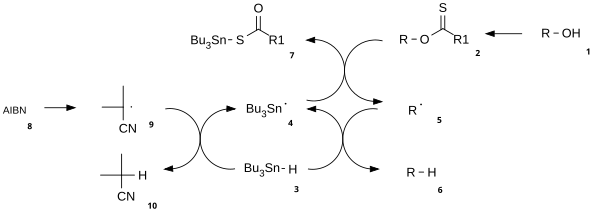
В механизм реакции состоит из стадии каталитического инициирования радикала и стадии распространения.[3] В алкоголь (1) сначала превращается в реакционноспособный карбонотиоиловый промежуточный продукт, такой как тионоэфир или же ксантогенат 2. Отопление AIBN приводит к его гомолитическому расщеплению с образованием двух 2-цианопроп-2-ильных радикалов 9 каждый из которых извлекает протон из трибутилстаннан 3 производить трибутилстаннил радикалы 4 и неактивный 10. Радикал трибутилолова отрывает ксантогенатную группу от 2 атакой 4 у атома серы с одновременным гомолитическим разрывом π-связи C-S. В результате остается углерод-центрированный радикал, который образует π-связь C-O посредством гомолитического расщепления σ-связи R-O, давая алкил радикальный 5 и ксантогенат трибутилолова 7. В сера банка связь в этом соединении очень прочная и обеспечивает движущая сила для этой реакции. Алкильный радикал 5 затем отрывает атом водорода от новой молекулы трибутилстаннана с образованием желаемого дезоксигенированного продукта (6) и новый радикальный вид, готовый к размножению.
Вариации
Альтернативные источники водорода
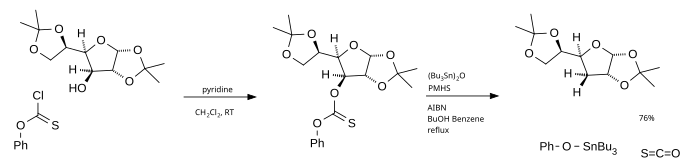
Основным недостатком этой реакции является использование трибутилстаннана, который токсичен, дорог и трудно удаляется из реакционной смеси. Одна альтернатива - использование оксид трибутилолова как радикальный источник и поли (метилгидридсилоксан) (PMHS) как водород источник.[4] Фенилхлортионоформиат, используемый в качестве исходного материала, в конечном итоге дает карбонилсульфид.
Триалкилбораны
Еще более удобный донор водорода - это триалкилборан -водные комплексы [5] Такие как триметилборан загрязнен небольшим количеством воды.
В этом каталитический цикл реакция инициируется воздухом окисление триалкилборана 3 по воздуху к метильному радикалу 4. Этот радикал реагирует с ксантогенатом. 2 в S-метил-S-метилдитиокарбонат 7 и радикальный интермедиат 5. (CH3)3B.H2О комплекс 3 обеспечивает водород для рекомбинации с этим радикалом в алкан 6 оставляя после себя диэтилборную кислоту и новый метильный радикал.
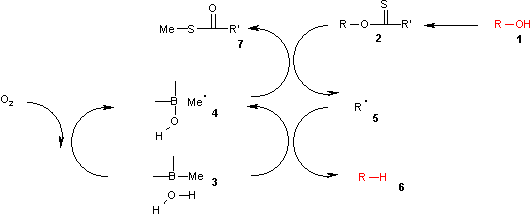
Это найдено теоретические расчеты что OH гомолиз реакция в комплексе боран-вода эндотермический с энергией, подобной реакции гомолиза в трибутилстаннане, но намного ниже, чем реакция гомолиза чистой воды.
Объем
Вариант этой реакции был использован в качестве одного из шагов в полный синтез из азадирахтин:[6]
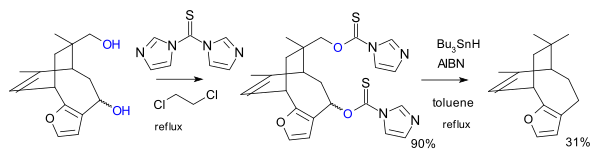
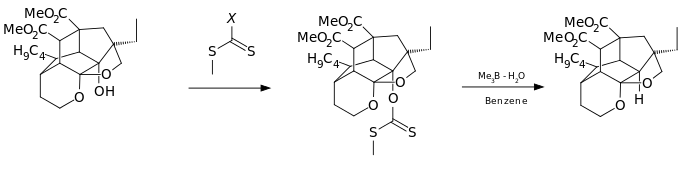
В другом варианте реагентом является имидазол 1,1'-тиокарбонилдиимидазол (TCDI), например, при полном синтезе паллеценсина B.[7] TCDI особенно хорош для первичных спиртов, поскольку отсутствует резонансная стабилизация ксантогената, так как одиночная пара азота участвует в ароматическом секстете.
Реакция также распространяется на S-алкилксантаты. С триэтилборан В качестве нового реагента, не содержащего металлов, необходимые атомы водорода извлекаются из протонных растворителей, стенок реактора или даже (в строго безводных условиях) самого борана.[8]
Смотрите также
Рекомендации
- ^ Бартон, Д. Х. Р.; Маккомби, С. В. (1975). «Новый метод деоксигенации вторичных спиртов». J. Chem. Soc., Perkin Trans. 1. 16 (16): 1574–1585. Дои:10.1039 / P19750001574.
- ^ Crich, D .; Кинтеро, Л. (1989). «Радикальная химия, связанная с тиокарбонильной группой». Chem. Ред. 89 (7): 1413–1432. Дои:10.1021 / cr00097a001.
- ^ Forbes, J.E .; Зард, С.З. (Январь 1989 г.). «Новая радикальная цепная реакция ангидридов ксантовой кислоты. Дальнейшие наблюдения за взаимодействием алкокситиокарбонильных радикалов в реакции Бартона-МакКомби». Буквы Тетраэдра. 30 (33): 4367–4370. Дои:10.1016 / с0040-4039 (00) 99362-6.
- ^ Тормо, Дж .; Фу, Г. С. (2002). «α-D-Рибо-гексофураноза, 3-дезокси-1,2: 5,6-бис-O- (1-метилэтилиден)». Орг. Синтезатор. 78: 239. Дои:10.15227 / orgsyn.078.0239.
- ^ Деоксигенация спиртов с использованием воды в качестве источника атома водорода Дэвид А. Шпигель, Кеннет Б. Виберг, Лаура Н. Шахерер, Мэтью Р. Медейрос и Джон Л. Вуд Варенье. Chem. Soc. 2005, 127, 12513-12515. (Дои:10.1021 / ja052185l )
- ^ Синтез азадирахтина: долгий, но успешный путь Джемма Э. Вейтч, Эдит Бекманн, Бренда Дж. Берк, Алистер Бойер, Сара Л. Маслен и Стивен В. Лей Энгью. Chem. Int. Эд. 2007, Дои: 10.1002 / anie.200703027
- ^ Первый полный синтез (±) -паллеценсина B Вэнь-Чэн Лю и Чун-Чен Ляо Chem. Commun., 1999, 117–118 117 Статья
- ^ Часть 2. Механические аспекты снижения S-алкил-тионокарбонаты в присутствии триэтилборана и воздуха Аллаис Ф., Бойвин Дж., Нгуен В. Beilstein J. Org. Chem., 2007 3:45 (12 декабря 2007 г.) Дои:10.1186/1860-5397-3-46