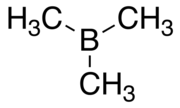
Триметилборана - Trimethylborane
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Триметилборана[1] | |||
| Другие имена Триметилборн Триметилборон | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.008.926 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| |||
| |||
| Характеристики | |||
| C3ЧАС9B | |||
| Молярная масса | 55,92 г / моль | ||
| Внешность | Бесцветный газ или жидкость | ||
| Плотность | 0,625 г / см3 при −100 ° C[3] | ||
| Температура плавления | -161,5 ° С (-258,7 ° F, 111,6 К) | ||
| Точка кипения | -20,2 ° С (-4,4 ° F, 253,0 К) | ||
| Незначительный, очень реактивный | |||
| Структура | |||
| Δ | |||
| Опасности | |||
| Главный опасности | Спонтанно воспламеняется на воздухе; вызывает ожоги | ||
| Пиктограммы GHS |    | ||
| Сигнальное слово GHS | Опасность | ||
| H220, H250, H280, H314 | |||
| P210, P222, P260, P264, P280, P301 + 330 + 331, P302 + 334, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P363, P370 + 378, P377, P381, P403, P405, P410 + 403, P422, P501 | |||
| точка возгорания | Не применимо, пирофорный газ | ||
| -40 ° С (-40 ° F, 233 К)[4] | |||
| Родственные соединения | |||
Родственные соединения | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Триметилборан (TMB) токсичен, пирофорный газ с формулой B (CH3)3 (который также можно записать как Me3B, где Я представляю метил ).
Характеристики
Как жидкость бесцветный. Самая сильная линия в инфракрасный спектр находится на высоте 1330 см−1 с последующими линиями на 3010 см−1 и 1185 см−1.
Его температура плавления составляет -161,5 ° C, а температура кипения -20,2 ° C.
Давление пара определяется как бревно п = 6,1385 + 1,75 лог Т − 1393.3/Т − 0.007735 Т, куда Т это температура в кельвины.[5] Молекулярный вес 55,914. Теплота испарения составляет 25,6 кДж / моль.[4]
Подготовка
Триметилборан был впервые описан в 1862 г. Эдвард Франкленд,[6] который также упомянул его аддукт с аммиаком.[7] Из-за своей опасной природы соединение больше не изучалось до 1921 года, когда Альфред Сток и Фридрих Цейдлер воспользовался реакцией между трихлорид бора газ и диметилцинк.[8] Хотя вещество можно приготовить с использованием Реактивы Гриньяра выход загрязнен нежелательными продуктами из растворителя. Триметилборан может быть получен в небольших масштабах с выходом 98% путем взаимодействия триметилалюминий в гексан с трибромид бора в дибутиловый эфир как растворитель.[5] Все же другие методы реагируют трибутилборат с хлоридом триметилалюминия или тетрафторборатом калия с триметилалюмием.[9] Еще один способ - добавить трифторид бора в эфире иодид метилмагния.[10]
Реакции
Триметилборан спонтанно воспламеняется на воздухе, если концентрация достаточно высока. Он горит зеленым пламенем, образуя сажу.[11]Более медленное окисление кислородом в растворителе или в газовой фазе может дать диметилтриоксадиборалан, который содержит кольцо из двух атомов бора и трех атомов кислорода. Однако основным продуктом является диметилборилметилпероксид, который быстро разлагается до диметоксиметилборана.[12]
Триметилборан - сильный Кислота Льюиса. B (CH3)3 может образовывать аддукт с аммиак: (NH3): B (CH3)3.[13] а также другие базы Льюиса. Кислотные свойства Льюиса (B (CH3)3 были проанализированы Модель ECW уступая EА= 2.90 и CА= 3,60. Когда триметилборан образует аддукт с триметиламин, стерическое отталкивание между метильными группами на B и N. Модель ECW может обеспечить меру этого стерического эффекта.
Триметилборан реагирует с водой и хлором при комнатной температуре. Он также вступает в реакцию со смазкой, но не с Тефлон или стекло.[5]
Триметилборан реагирует с диборан непропорционально форме монометилдиборан и диметилдиборан: (CH3) BH2.BH3 и (CH3)2BH.BH3.
Он реагирует как газ с триметилфосфин с образованием твердой соли Льюиса с теплотой образования -41 ккал на моль. Этот аддукт имеет теплоту сублимации -24,6 ккал / моль. Никакой реакции не происходит с триметиларсин или же триметилстибин.[10]
Метилитий, реагируя с триметилбораном, дает тетраметилборатную соль: LiB (CH3)4.[14] Ион тетраметилбората имеет отрицательный заряд и изоэлектронный с неопентан, тетраметилсилан, а тетраметиламмоний катион.
Использовать
Триметилборан использовался в качестве счетчика нейтронов. Для этого он должен быть очень чистым.[13] Он также используется в химическое осаждение из паровой фазы где бор и углерод должны осаждаться вместе.
Рекомендации
- ^ «ГЛАВА P-6. Приложения к определенным классам соединений». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 974. Дои:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ Graner, G .; Hirota, E .; Иидзима, Т .; Kuchitsu, K .; Ramsay, D.A .; Vogt, J .; Фогт, Н. (2001). «C3H9B Триметилборан». Молекулы, содержащие три или четыре атома углерода. Ландольт-Бернштейн - молекулы и радикалы группы II. 25C. п. 1. Дои:10.1007/10688787_381. ISBN 978-3-540-66774-2.
- ^ http://www.voltaix.com/images/doc/Msb000_TMB.pdf MSDS от Voltaix
- ^ а б Триметилборана
- ^ а б c Уильям С. Рис младший и др. (1990). Элвин П. Гинзберг (ред.). Триметилборана. Неорганические синтезы. 27. п. 339.
- ^ Э. Франкленд (1862). "Ueber eine neue Reihe Organischer Verbindungen, welche Bor enthalten". Justus Liebigs Ann. Chem. 124: 129–157. Дои:10.1002 / jlac.18621240102.
- ^ Р. Нишиябу, Ю. Кубо, Т.Д. Джеймс и Дж. С. Фосси (2011). «Строительные блоки борной кислоты: инструменты для самостоятельной сборки». Chem. Сообщество. 47 (4): 1124–1150. Дои:10.1039 / C0CC02921A. PMID 21113558.CS1 maint: несколько имен: список авторов (связь)
- ^ А. Шток и Ф. Цейдлер (1921). "Zur Kenntnis des Bormethyls und Boräthyls". Бер. Dtsch. Chem. Ges. А / Б. 54 (3): 531–541. Дои:10.1002 / cber.19210540321.
- ^ Роланд Кестер, Пауль Бингер, Вильгельм В. Дальхофф (1973). «Удобный препарат триметилборана и триэтилборана». Синтез и реакционная способность в неорганической и металлоорганической химии. 3 (4): 359–367. Дои:10.1080/00945717308057281.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Дональд Чарльз Менте (май 1975 г.). "Реакции триметильной группы оснований Льюиса с простыми борными кислотами Льюиса" (PDF).
- ^ Герберт Эллерн (1968). Военная и гражданская пиротехника. Химическая издательская компания. п.24. CiteSeerX 10.1.1.137.1104.
- ^ Бартон, Лоуренс; Крамп, Джон М .; Уитли, Джеффри Б. (июнь 1974 г.). «Триоксадибороланы от окисления метилдиборана». Журнал металлоорганической химии. 72 (1): C1 – C3. Дои:10.1016 / s0022-328x (00) 82027-6.
- ^ а б Гейлон С. Росс; и другие. (2 октября 1961 г.). «Получение триметилборана высокой чистоты» (PDF). Журнал исследований Национального бюро стандартов Раздел A. 66 (1).
- ^ Георг Виттиг в 1958 году