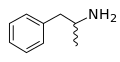
Формула скелета - Википедия - Skeletal formula
В скелетная формула, также называемый формула линейного угла или же сокращенная формула, из органическое соединение это тип молекулярного структурная формула который служит сокращенным представлением молекула с связь и некоторые подробности его молекулярная геометрия. Скелетная формула показывает скелетная структура или же скелет молекулы, которая состоит из скелетные атомы которые составляют молекулу.[1] Он представлен в двух измерениях, как на листе бумаги. Он использует определенные условные обозначения для представления углерод и водород атомы, которые являются наиболее распространенными в органической химии.
Ранняя форма этого представления была впервые разработана химиком-органиком. Фридрих Август Кекуле фон Страдониц, в то время как современная форма тесно связана и находится под влиянием Структура Льюиса (точка) молекул и их валентных электронов. По этой причине их иногда называют Кекуле структуры[2] или же Структуры Льюиса-Кекуле. Формулы скелета стали повсеместными в органическая химия отчасти потому, что их относительно быстро и просто рисовать, а также потому, что изогнутая стрелка обозначения, используемые для обсуждения механизма реакции и / или делокализация легко накладываются друг на друга.
Несколько других методов изображения химических структур также широко используются в органической химии (хотя и реже, чем скелетные формулы). Например, конформационные структуры похожи на скелетные формулы и используются для изображения приблизительного положения атомов молекулы в трехмерном пространстве в виде перспективного рисунка. Другие типы представлений, например, Прогнозы Ньюмана, Прогнозы Хаворта и Проекции Фишера, также чем-то похожи на скелетные формулы. Однако есть небольшие различия в используемых условных обозначениях, и читатель должен знать о них, чтобы понять структурные детали, которые закодированы в этих изображениях. В то время как скелетные и конформационные структуры также используются в металлоорганический и неорганическая химия, используемые условные обозначения также несколько различаются.
Скелет
Терминология
Скелетная структура органического соединения - это последовательность атомов, связанных вместе, которые образуют основную структуру соединения. Каркас может состоять из цепочек, разветвлений и / или колец связанных атомов. Атомы скелета, кроме углерода или водорода, называются гетероатомы.[3]
В скелете есть водород и / или различные заместители связаны с его атомами. Водород является наиболее распространенным неуглеродным атомом, который связан с углеродом и для простоты явно не изображен. Кроме того, атомы углерода обычно не помечаются как таковые напрямую (то есть с помощью "C"), тогда как гетероатомы всегда явно указываются как таковые (т.е. с использованием "N" для азот, "O" для кислород, так далее.)
Гетероатомы и другие группы атомов, которые вызывают относительно высокие скорости химической реактивности или вносят специфические и интересные характеристики в спектры соединений, называются функциональные группы, поскольку они придают молекуле функцию. Гетероатомы и функциональные группы вместе известны как «заместители», так как они считаются заместителями атома водорода, который может присутствовать в исходном углеводород рассматриваемого органического соединения.
Базовая структура
Как и в структурах Льюиса, ковалентные связи обозначаются сегментами линии, причем удвоенный или тройной сегмент линии указывает двойной или же тройное соединение, соответственно. Точно так же скелетные формулы указывают официальные обвинения связаны с каждым атомом (хотя одиночные пары обычно необязательны, Смотри ниже). Фактически, скелетные формулы можно рассматривать как сокращенные структуры Льюиса, в которых соблюдаются следующие упрощения:
- Атомы углерода представлены вершинами (пересечениями или концами) отрезков прямых. Для ясности метильные группы часто явно обозначаются как Me или CH3, а (гетеро)кумулен угли часто представлены тяжелым центральная точка.
- Подразумеваются атомы водорода, присоединенные к углероду. Под немеченой вершиной понимается углерод, присоединенный к количеству атомов водорода, необходимых для удовлетворения Правило октета, в то время как вершина, помеченная формальным зарядом и / или несвязывающим электроном (ами), считается имеющей количество атомов водорода, необходимое для придания атому углерода этих указанных свойств. Необязательно, ацетиленовый и формильный атомы водорода могут быть показаны явно для ясности.
- Явно показаны атомы водорода, присоединенные к гетероатому. Присоединенные к нему гетероатом и атомы водорода обычно показаны как одна группа (например, OH, NH2) без явного указания связи водород – гетероатом. Гетероатомы с простыми алкильными или арильными заместителями, такие как метокси (OMe) или диметиламино (NMe2), иногда изображаются таким же образом, по аналогии.
- Неподеленные пары на карбеновых атомах углерода должны быть указаны явно, тогда как неподеленные пары в других случаях не являются обязательными и показаны только для акцента. Напротив, формальные заряды и неспаренные электроны на элементах основной группы всегда явно показаны.
В стандартном изображении молекулы каноническая форма (резонансная структура) с наибольшим вкладом. Однако считается, что скелетная формула представляет «реальную молекулу», то есть средневзвешенное значение всех способствующих канонических форм. Таким образом, в случаях, когда две или более канонических форм имеют равный вес (например, в бензоле или карбоксилат-анионе) и одна из канонических форм выбрана произвольно, скелетная формула должна отражать истинную структуру, содержащую эквивалентные связи дробный порядок, даже если делокализованные связи изображены как неэквивалентные одинарные и двойные связи.
Современные графические условности
Со времени появления скелетных структур во второй половине XIX века их внешний вид претерпел значительную эволюцию. Графические условные обозначения, используемые сегодня, относятся к 1980-м годам. Благодаря принятию ChemDraw программный комплекс как де-факто промышленный стандарт[как? ] (к Американское химическое общество, Королевское химическое общество, и Gesellschaft Deutscher Chemiker публикации, например),[оригинальное исследование? ] эти условные обозначения стали почти универсальными в химической литературе с конца 1990-х годов. Несколько незначительных традиционных вариаций, особенно в отношении использования стереоблигаций, продолжают существовать в результате различий в практике США, Великобритании и континентальной Европы или в силу личных предпочтений.[4] В качестве еще одной незначительной вариации между авторами официальные обвинения могут быть показаны со знаком плюс или минус в кружке или без кружка. Набор соглашений, которым следуют большинство авторов, приводится ниже вместе с иллюстративными примерами.
(1) Связи между sp2 и / или sp3 гибридизированный углерод или гетероатомы обычно представляются с использованием углов 120 °, когда это возможно, с самой длинной цепочкой атомов, следующей зигзагообразным узором, если она не прерывается СНГ двойная связь. Если все четыре заместителя не указаны явно, это верно, даже когда стереохимия изображена с использованием клиновидных или штриховых связей (Смотри ниже).[5]

(2) Если все четыре заместителя у тетраэдрического углерода явно показаны, связи с двумя заместителями в плоскости все еще встречаются при 120 °; однако два других заместителя обычно показаны с клиновидными и пунктирными связями (для изображения стереохимии) и образуют меньший угол 60–90 °.

(3) Линейная геометрия sp-гибридизированных атомов обычно изображается отрезками линии, пересекающимися под углом 180 °.

(4) Карбо- и гетероциклы (3-8-членные) обычно представлены в виде правильных многоугольников; кольца большего размера, как правило, представлены вогнутыми многоугольниками.

(5) Атомы в группе упорядочены так, что связь исходит от атома, который непосредственно прикреплен к скелету. Например, нитрогруппа (NO2), обозначается -NO2 или O2N—, в зависимости от размещения облигации. Напротив, изомерная нитритная группа обозначается ONO, причем связь появляется с обеих сторон.

Неявные атомы углерода и водорода
Например, на изображении ниже скелетная формула гексан Показано. Атом углерода, обозначенный C1 По всей видимости, он имеет только одну связь, поэтому с ним также должно быть связано три атома водорода, чтобы общее количество связей составляло четыре. Атом углерода, обозначенный C3 имеет две связи с другими атомами углерода и, следовательно, также связан с двумя атомами водорода. А клюшка действительной молекулярной структуры гексана, как определено Рентгеновская кристаллография, показана для сравнения, в которой атомы углерода изображены черными шарами, а атомы водорода - белыми.


ПРИМЕЧАНИЕ. Не имеет значения, с какого конца цепочки вы начинаете нумерацию, если вы последовательно рисуете диаграммы. Краткая формула или название ИЮПАК подтвердят ориентацию. Некоторые молекулы станут знакомыми независимо от ориентации.
Явные гетероатомы и атомы водорода
Все атомы, не являющиеся углеродом или водородом, обозначены их химический символ, например Cl для хлор, O для кислород, Na для натрий, и так далее. В контексте органической химии эти атомы обычно известны как гетероатомы (где префикс гетеро- происходит от греческого слова ἕτερος [héteros], что означает «другой»).
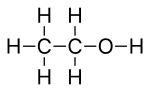
Любые атомы водорода, связанные с гетероатомами находятся нарисовано явно. В этиловый спирт, С2ЧАС5ОН, например, атом водорода, связанный с кислородом, обозначается символом H, тогда как атомы водорода, которые связаны с атомами углерода, не показаны напрямую.
Линии, представляющие связи гетероатом-водород, обычно опускаются для ясности и компактности, поэтому функциональная группа, такая как гидроксил группа чаще всего пишется -OH вместо -O-H. Эти связи иногда растягиваются полностью, чтобы подчеркнуть их присутствие, когда они участвуют в механизмы реакции.
Ниже для сравнения показана модель с мячом и клюшкой (вверху) настоящего трехмерная структура молекулы этанола в газовой фазе, как определено микроволновая спектроскопия, это Структура Льюиса (в центре) и его скелетная формула (внизу).

Символы псевдоэлементов
Есть также символы, которые кажутся символы химических элементов, но представляют собой некоторые очень распространенные заместители или указывают на неуказанный член группы элементов. Они известны как символы псевдоэлементов или органических элементов и рассматриваются как одновалентные «элементы» в скелетных формулах.[6] Список широко используемых символов псевдоэлементов показан ниже:
Общие символы
- X для любого (псевдо )галоген атом (в родственных Обозначение MLXZ, X представляет собой одноэлектронный донорный лиганд)
- L или же Lп для лиганд или лиганды (в соответствующем обозначении MLXZ L представляет собой двухэлектронный донорный лиганд)
- M или же Встретил для любого металл атом ([M] используется для обозначения лигированного металла, MLп, когда идентичность лигандов неизвестна или не имеет значения)
- E или же Эль для любого электрофил (в некоторых контекстах E также используется для обозначения любого p-блок элемент)
- Ну для любого нуклеофил
- Z для конъюгирования электроноакцепторных групп (в родственной записи MLXZ Z представляет собой лиганд с нулевым донором электронов; в несвязанном использовании Z также является аббревиатурой карбоксибензильной группы.)
- D для дейтерий (2H) атом
- Т для тритий (3H) атом
Алкильные группы
- R для любого алкил группа или даже любой органил группа (Alk может использоваться для однозначного обозначения алкильной группы)
- Я за метильная группа
- Et для этильная группа
- Пр, п-Пр, или же пПр для (нормальный) пропил группа (Pr также является символом элемента празеодим. Однако, поскольку пропильная группа является одновалентной, в то время как празеодим почти всегда трехвалентен, неоднозначность на практике возникает редко, если вообще возникает.)
- i-Pr или же яPr (я часто выделяется курсивом) для изопропил группа
- Все для аллильная группа (редко)
- Бу, п-Bu или же пБу для (нормальный) бутил группа
- i-Bu или же яБу (я часто выделяется курсивом) для изобутил группа
- s-Bu или же sБу для вторичный бутил группа
- т-Bu или же тБу для высшее бутил группа
- Pn для пентил группа (или же Am для синонима амил группа, хотя Am также является символом америций.)
- Np или же Neo для неопентил группа (Предупреждение: химики-металлоорганики часто используют Np для связанных неофил группа, PhMe2C–. Np также является символом элемента нептуний.)
- Сай или же Chx для циклогексил группа
- Объявление для 1-адамантил группа
- Тр или же Trt для тритил группа
Ароматические и ненасыщенные заместители
- Ар для любого ароматный заместитель (Ar также является символом элемента аргон. Однако аргон инертен во всех обычных условиях, встречающихся в органической химии, поэтому использование Ar для обозначения арильного заместителя никогда не вызывает путаницы.)
- Het для любого гетероароматический заместитель
- Млрд или же Bzl для бензил группа (не путать с Бз для бензоил группа; Однако старая литература может использовать Bz для бензильной группы.)
- Дипп для 2,6-диизопропилфенильной группы
- Mes для мезитил группа
- Ph, Φ, или же φ для фенильная группа (Использование фи для фенила снижается)
- Тол для толил группа
- Является или же Типп для 2,4,6-триизопропилфенильной группы (первый символ происходит от синонима изитил)
- Cp для циклопентадиенил группа (Cp было символом кассиопея, бывшего названия лютеций )
- Cp * для пентаметилциклопентадиенил группа
- Vi для виниловая группа (редко)
Функциональные группы
- Ac для ацетил группа (Ac также является символом элемента актиний. Однако актиний почти никогда не встречается в органической химии, поэтому использование Ас для обозначения ацетильной группы никогда не вызывает путаницы);
- Бз для бензоил группа; OBz - это бензоат группа
- Piv для пивалил (т-бутилкарбонил) группа; OPiv - пивалатная группа
- Bt для 1-бензотриазолильной группы
- Im для 1-имидазолильной группы
- NPhth для фталимид-1-ильной группы
Сульфонил / сульфонатные группы
Сложные эфиры сульфоновой кислоты часто уходящие группы в реакциях нуклеофильного замещения. См. Статьи на сульфонил и сульфонат группы для получения дополнительной информации.
- BS для Brosyl (п-бромбензолсульфонил) группа; OB - это группа брозилата
- Г-жа для месил (метансульфонильная) группа; OMs - это мезилат группа
- Ns для носил (п-нитробензолсульфонил) группа (Ns - бывший химический символ бориум, затем назвал Нильсомбориум ); ONs - это группа нозилата
- Tf для мелочь (трифторметансульфонил) группа; OTf - это тройной группа
- Ts для тозил (п-толуолсульфонил) группа (Ts также является символом элемента Tennessine. Однако теннессин никогда не встречается в органической химии, поэтому использование Ts для обозначения тозильной группы никогда не вызывает путаницы); ОТС - это тозилат группа
Защита групп
А защитная группа или защитная группа вводится в молекулу путем химической модификации функциональной группы для получения хемоселективности в последующей химической реакции, облегчая многоступенчатый органический синтез.
- Boc для т-бутоксикарбонил группа
- КБЗ или же Z для карбоксибензил группа
- Fmoc для флуоренилметоксикарбонил группа
- Alloc для аллилоксикарбонильной группы
- Troc для трихлорэтоксикарбонильной группы
- TMS, TBDMS, TES, TBDPS, TIPS, ... для различных силиловый эфир группы
- PMB для 4-метоксибензильной группы
- MOM для метоксиметильной группы
- THP для 2-тетрагидропиранильной группы
Множественные облигации
Два атома могут быть связаны друг с другом более чем одной парой электронов. Обычными связями с углеродом являются одинарные, двойные и тройные связи. Одинарные связи являются наиболее распространенными и представлены в скелетной формуле единственной сплошной линией между двумя атомами. Двойные связи обозначены двумя параллельными линиями, а тройные связи показаны тремя параллельными линиями.
В более продвинутых теориях связи нецелое число ценности ордер на облигации существовать. В этих случаях комбинация сплошных и пунктирных линий указывает целую и нецелую части порядка облигаций, соответственно.

Гекс-3-ен имеет внутренний углерод-углеродная двойная связь 
Гекс-1-ен имеет концевую двойную связь 
Шестигранник-3-ин имеет внутренний углерод-углеродная тройная связь 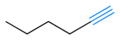
Гекс-1-ин имеет концевую тройную связь углерод-углерод.
Примечание: в галерее выше двойные связи показаны красным, а тройные - синим. Это было добавлено для ясности - множественные связи обычно не окрашиваются в скелетные формулы.
Бензольные кольца
В былые времена, бензол обычно изображается в виде шестиугольника с чередующимися одинарными и двойными связями, что очень похоже на структуру, первоначально предложенную Кекуле в 1872 г. Как упоминалось выше, чередующиеся одинарные и двойные связи «1,3,5-циклогексатриена» понимаются как изображение одной из двух эквивалентных канонических форм бензола, в которой все углерод-углеродные связи эквивалентны length и имеют порядок связывания 1,5. Для арильных колец в целом две аналогичные канонические формы почти всегда вносят основной вклад в структуру, но они неэквивалентны, поэтому одна структура может вносить немного больший вклад, чем другая, а порядки связи могут несколько отличаться от 1,5.
Альтернативное представление, которое подчеркивает эту делокализацию, использует круг, нарисованный внутри правильного шестиугольника одинарных связей. Этот стиль, основанный на стиле, предложенном Йоханнес Тиле, был очень распространен в вводных учебниках по органической химии и до сих пор часто используется в неформальной обстановке. Однако, поскольку это изображение не отслеживает электронные пары и не может показать точное движение электронов, оно было в значительной степени вытеснено изображением Кекулеана в педагогическом и формальном академическом контексте.[7]
Стереохимия

Стереохимия удобно обозначать в каркасных формулах:[8]

Шариковая модель из
(р) -2-хлор-2-фторпентан
Скелетная формула
(р) -2-хлор-2-фторпентан
Скелетная формула
(S) -2-хлор-2-фторпентан
Соответствующие химические связи можно изобразить несколькими способами:
- Сплошные линии представляют облигации в плоскости бумаги или экрана.
- Сплошные клинья представляют собой связи, указывающие из плоскости бумаги или экрана в сторону наблюдателя.
- Клинья с решеткой или пунктирные линии (толстые или тонкие) представляют собой связи, которые указывают на плоскость бумаги или экрана вдали от наблюдателя.[9]
- Волнистые линии представляют либо неизвестную стереохимию, либо смесь двух возможных стереоизомеров в этой точке.
- Устаревший[10] изображение водородной стереохимии, которая раньше была распространена в стероидный препарат химия - это использование закрашенного круга с центром в вершине (иногда называемого H-точка / H-тире / H-круг соответственно) для направленного вверх атома водорода и двух меток решетки рядом с вершиной или полого круга для направления вниз атом водорода.
 Маленький закрашенный кружок представляет водород, направленный вверх, а две решетки - направленный вниз.
Маленький закрашенный кружок представляет водород, направленный вверх, а две решетки - направленный вниз.
Раннее использование этого обозначения восходит к Ричард Кун который в 1932 г. использовал в публикации сплошные толстые и пунктирные линии. Современный сплошные и коленчатые клинья были представлены в 1940-х годах Джулио Натта изобразить структуру высокого полимеры и широко популяризируется в учебнике 1959 г. Органическая химия к Дональд Дж. Крам и Джордж С. Хэммонд.[11]
Скелетные формулы могут изобразить СНГ и транс изомеры алкенов. Волнистые одинарные связи являются стандартным способом представления неизвестной или неопределенной стереохимии или смеси изомеров (как с тетраэдрическими стереоцентрами). Иногда использовалась перекрестная двойная связь; больше не считается приемлемым стилем для общего использования, но все еще может требоваться компьютерным программным обеспечением.[8]

Водородные связи

Водородные связи обычно обозначаются пунктирными или штриховыми линиями. В других контекстах пунктирные линии также могут представлять частично сформированные или разорванные связи в переходное состояние.
Рекомендации
- ^ Стокер, Х. Стивен (2012). Общая, органическая и биологическая химия (6-е изд.). Cengage. ISBN 978-1133103943.[страница нужна ]
- ^ Этот термин неоднозначен, потому что «структура Кекуле» также относится к знаменитому предложению Кекуле о гексагональных чередующихся двойных связях для структуры бензола.
- ^ Рекомендации ИЮПАК 1999 г., пересмотренный раздел F: Замена скелетных атомов
- ^ Бречер, Джонатан (2008). «Стандарты графического представления диаграмм химической структуры (Рекомендации IUPAC 2008 г.)». Чистая и прикладная химия. 80 (2): 277–410. Дои:10.1351 / pac200880020277. ISSN 1365-3075.
- ^ Чтобы предотвратить возникновение «перегиба», из-за которого структура занимала бы слишком много вертикального пространства на странице, IUPAC (Brecher, 2008, p. 352) делает исключение для длинной цепочки СНГ-олефины (например, олеиновая кислота ), позволяя СНГ двойная связь внутри них должна быть изображена под углом 150 °, так что зигзаги по обе стороны от двойной связи могут распространяться горизонтально.
- ^ Клейден, Джонатан; Гривс, Ник; Уоррен, Стюарт; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. п. 27. ISBN 978-0-19-850346-0.
- ^ Например, в знаменитом учебнике Моррисона и Бойда 1959 г. (6-е издание, 1992 г.) в качестве стандартного описания арильного кольца используется обозначение Тиле, а в учебнике 2001 г. Клейдена, Гривса, Уоррена и Уотерса (2-е издание, 2012 г.) нотация Кекуле повсюду и предостерегает студентов от использования нотации Тиле при написании механизмов (стр. 144, 2-е изд.).
- ^ а б Бречер, Джонатан (2006). «Графическое представление стереохимической конфигурации (Рекомендации IUPAC 2006 г.)» (PDF). Pure Appl. Chem. 78 (10): 1897–1970. Дои:10.1351 / pac200678101897.
- ^ Американские и европейские химики используют несколько разные условные обозначения для хешированной связи. В то время как большинство американских химиков рисуют хэшированные связи с короткими метками рядом со стереоцентром и длинными метками дальше (по аналогии с клиновидными связями), большинство европейских химиков начинают с длинных меток рядом со стереоцентром, которые постепенно становятся короче при удалении (аналогично к перспективному рисунку). В прошлом ИЮПАК предложил использовать хешированную связь с хешированными метками одинаковой длины в качестве компромисса, но теперь предпочитает хешированные облигации в американском стиле (Brecher, 2006, стр.1905). с равной длиной хэшей), чтобы изобразить относительная стереохимия и клинья и хешированная связь с неравными хешами, чтобы изобразить абсолютный стереохимия; большинство других не делают этого различия.
- ^ ИЮПАК категорически осуждает эту нотацию.
- ^ Дженсен, Уильям Б. (2013). «Исторические истоки стереохимической линии и символизма клина». Журнал химического образования. 90 (5): 676–677. Дои:10.1021 / ed200177u.
внешняя ссылка
- Рисование органических молекул из Chemguide.co.uk