Круговой дихроизм - Circular dichroism
Круговой дихроизм (компакт диск) является дихроизм с привлечением циркулярно поляризованный свет, т. е. дифференциал поглощение левшей и правшей свет.[1][2] Левосторонний круговой (LHC) и правосторонний круговой (RHC) поляризованный свет представляют собой два возможных спиновый угловой момент состояний для фотона, поэтому круговой дихроизм также называется дихроизмом для спинового углового момента.[3] Это явление было открыто Жан-Батист Биот, Огюстен Френель, и Эме Хлопок в первой половине 19 века.[4] Круговой дихроизм и круговое двулучепреломление являются проявлениями оптическая активность. Он выставлен в полосы поглощения из оптически активный хиральный молекулы. компакт диск спектроскопия имеет широкий спектр применения во многих различных областях. В частности, УФ Компакт-диск используется для исследования вторичная структура белков.[5] UV / Vis CD используется для исследования переходы с переносом заряда.[6] Ближний инфракрасный CD используется для расследования геометрический и электронная структура исследуя металл d →d переходы.[2] Вибрационный круговой дихроизм, который использует свет от инфракрасный область энергии, используется для структурных исследований малых органических молекул, а в последнее время белков и ДНК.[5]
Физические принципы
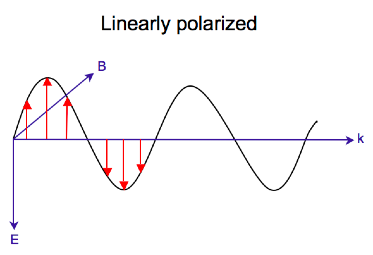
Круговая поляризация света
Электромагнитное излучение состоит из электрического (E) и магнитного (B) полей, которые колеблются перпендикулярно друг другу и направлению распространения,[7] а поперечная волна. В то время как линейно поляризованный свет возникает, когда вектор электрического поля колеблется только в одной плоскости, свет с круговой поляризацией возникает, когда направление вектора электрического поля вращается вокруг направления его распространения, в то время как вектор сохраняет постоянную величину. В единственной точке пространства вектор с круговой поляризацией будет очерчивать круг за один период частоты волны, отсюда и название. На двух диаграммах ниже показаны векторы электрического поля линейно и циркулярно поляризованного света в один момент времени для ряда положений; график циркулярно поляризованного электрического вектора образует спираль вдоль направления распространения (k). Для света с левой круговой поляризацией (LCP), распространяющегося к наблюдателю, электрический вектор вращается против часовой стрелки.[2] Для света с правой круговой поляризацией (RCP) электрический вектор вращается по часовой стрелке.
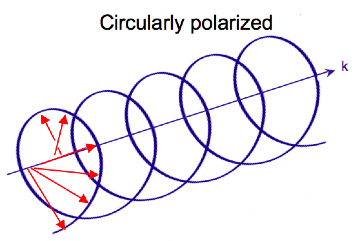
Взаимодействие циркулярно поляризованного света с веществом
Когда свет с круговой поляризацией проходит через поглощающую оптически активную среду, скорости между правой и левой поляризациями различаются (cL ≠ cр) а также их длина волны (λL ≠ λр) и степень их поглощения (εL≠ εр). Круговой дихроизм - разность Δε ≡ εL- εр.[5] Электрическое поле светового луча вызывает линейное смещение заряда при взаимодействии с молекулой (электрический диполь ), тогда как его магнитное поле вызывает циркуляцию заряда (магнитный диполь ). Эти два движения вместе вызывают возбуждение электрон в спиральном движении, которое включает перевод и вращение и связанные с ними операторы. Установленная экспериментально связь между сила вращения (R) образца, а Δε определяется выражением
Вращательная сила также была определена теоретически,
Из этих двух уравнений видно, что для того, чтобы иметь ненулевое значение операторы электрического и магнитного дипольных моментов ( и ) должен трансформироваться как то же самое неприводимое представление. и единственные точечные группы где это может происходить, делая активными только хиральные молекулы CD.
Проще говоря, поскольку циркулярно поляризованный свет сам по себе является «хиральным», он по-разному взаимодействует с хиральные молекулы. То есть два типа света с круговой поляризацией поглощаются в разной степени. В эксперименте с компакт-диском равные количества света с левой и правой круговой поляризацией выбранной длины волны поочередно излучаются в (хиральный) образец. Одна из двух поляризаций поглощается больше, чем другая, и эта зависящая от длины волны разница поглощения измеряется, давая спектр КД образца. Из-за взаимодействия с молекулой вектор электрического поля света проходит по эллиптическому пути после прохождения через образец.
Важно, что хиральность молекулы может быть скорее конформационной, чем структурной. Это, например, молекула белка со спиральной вторичная структура может иметь компакт-диск, который меняется с изменением телосложения.
Дельта-поглощение
По определению,
где ΔA (Delta Absorbance) - это разница между поглощением света с левой круговой поляризацией (LCP) и света с правой круговой поляризацией (RCP) (это то, что обычно измеряется). ΔA является функцией длина волны, поэтому для того, чтобы измерение было значимым, должна быть известна длина волны, на которой оно проводилось.
Молярный круговой дихроизм
Это также можно выразить, применив Закон пива, так как:
где
- εL и εр - молярные коэффициенты экстинкции для света LCP и RCP,
- C это молярная концентрация,
- л длина пути в сантиметрах (см).
потом
молярный круговой дихроизм. Это внутреннее свойство обычно подразумевается под круговым дихроизмом вещества. поскольку является функцией длины волны, молярного значения кругового дихроизма () должен указывать длину волны, на которой он действителен.
Внешние эффекты на круговой дихроизм
Во многих практических приложениях кругового дихроизма (КД), как обсуждается ниже, измеренная КД является не просто внутренним свойством молекулы, а скорее зависит от молекулярной конформации. В таком случае CD также может зависеть от температуры, концентрации и химической среды, включая растворители. В этом случае сообщаемое значение CD также должно указывать эти другие важные факторы, чтобы быть значимым.
В упорядоченных структурах, лишенных двукратной вращательной симметрии, оптическая активность,[8][9] включая дифференциальную передачу[10] (и отражение[11]) волн с круговой поляризацией также зависит от направления распространения через материал. В этом случае так называемые внешняя трехмерная хиральность связано с взаимной ориентацией светового луча и конструкции.
Молярная эллиптичность
Хотя ΔA обычно измеряется, по историческим причинам большинство измерений указывается в градусах эллиптичности. Молярная эллиптичность - это круговой дихроизм с поправкой на концентрацию. Молярный круговой дихроизм и молярная эллиптичность, [θ], легко преобразовываются уравнением:
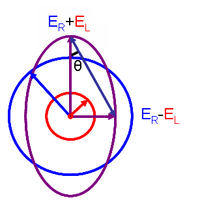
Это отношение выводится путем определения эллиптичность поляризации так как:
где
- Eр и EL величины электрическое поле векторов света с правой и левой круговой поляризацией соответственно.
Когда Eр равно EL (когда нет разницы в поглощении света с правой и левой круговыми поляризациями), θ составляет 0 °, а свет линейно поляризованный. Когда либо Eр или EL равен нулю (когда имеется полное поглощение света с круговой поляризацией в одном направлении), θ составляет 45 °, и свет циркулярно поляризованный.
Как правило, эффект кругового дихроизма невелик, поэтому tanθ мала и может быть аппроксимирована как θ в радианы. Поскольку интенсивность или сияние, I, света пропорциональна квадрату вектора электрического поля, эллиптичность становится:
Затем, заменив I, используя Закон пива в натуральный логарифм форма:
Теперь эллиптичность можно записать как:
Поскольку ΔA << 1, это выражение можно аппроксимировать, разложив экспоненты в Серия Тейлор к первому порядку, а затем отбрасывая члены ΔA по сравнению с единицей и переходя из радианы в градусы:
Линейная зависимость концентрации растворенного вещества и длины пути устраняется путем определения молярной эллиптичности как,
Затем объединив последние два выражения с Закон пива, молярная эллиптичность принимает вид:
Единицы молярной эллиптичности исторически (град · см2/ дмоль). Для расчета молярной эллиптичности необходимо знать концентрацию образца (г / л), длину пути ячейки (см) и молекулярную массу (г / моль).
Если образец представляет собой белок, средний вес остатка (средний молекулярный вес аминокислотных остатков, который он содержит) часто используется вместо молекулярного веса, по существу рассматривая белок как раствор аминокислот. Использование средней эллиптичности остатков облегчает сравнение CD белков с разной молекулярной массой; использование этого нормализованного CD важно при изучении структуры белка.
Эллиптичность среднего остатка
Способы оценки вторичной структуры полимеров, белков и, в частности, полипептидов часто требуют, чтобы измеренный спектр молярной эллиптичности был преобразован в нормированное значение, в частности, значение, не зависящее от длины полимера. Для этого используется средняя эллиптичность остатка; это просто измеренная молярная эллиптичность молекулы, деленная на количество мономерных единиц (остатков) в молекуле.
Применение к биологическим молекулам
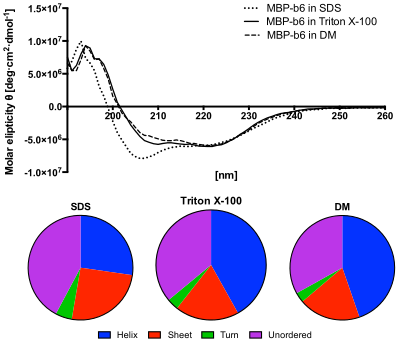
Нижняя панель: содержание вторичных структур, предсказанных из спектров КД с использованием алгоритма CDSSTR. Белок в растворе SDS показывает повышенное содержание неупорядоченных структур и пониженное содержание спиралей.[12]
В целом это явление будет проявляться в полосах поглощения любого оптически активный молекула. Как следствие, круговой дихроизм проявляется биологическими молекулами из-за их правовращающий и левовращающий компоненты. Еще важнее то, что вторичная структура будет также сообщать отдельный CD своим соответствующим молекулам. Следовательно альфа спираль белков и двойная спираль из нуклеиновых кислот имеют спектральные сигнатуры CD, представляющие их структуры. Способность CD давать репрезентативную структурную сигнатуру делает его мощным инструментом в современной биохимии с приложениями, которые можно найти практически во всех областях исследования.
CD тесно связан с оптическая вращательная дисперсия (ORD) и обычно считается более продвинутым. CD измеряется в полосах поглощения интересующей молекулы или вблизи них, в то время как ORD можно измерять вдали от этих полос. Преимущество CD проявляется в анализе данных. Структурные элементы более четко различимы, поскольку их записанные полосы не перекрываются в значительной степени на определенных длинах волн, как это происходит в ORD. В принципе, эти два спектральных измерения могут быть взаимно преобразованы с помощью интегрального преобразования (Соотношение Крамерса – Кронига ), если в измерения учесть все поглощения.
Дальний УФ (ультрафиолетовый ) КД-спектр белков может выявить важные характеристики их вторичная структура. Спектры КД можно легко использовать для оценки доли молекулы, находящейся в альфа-спираль конформация, бета-лист конформация, бета-поворот конформация или какое-либо другое (например, случайный катушки ) конформация.[13][14] Эти дробные отнесения налагают важные ограничения на возможные вторичные конформации, в которых может находиться белок. CD, как правило, не может сказать, где находятся обнаруженные альфа-спирали внутри молекулы, или даже полностью предсказать их количество. Несмотря на это, CD - ценный инструмент, особенно для демонстрации изменений в экстерьере. Его можно, например, использовать для изучения того, как вторичная структура молекулы изменяется в зависимости от температуры или концентрации денатурирующих агентов, например Гуанидиния хлорид или мочевина. Таким образом, он может выявить важную термодинамическую информацию о молекуле (например, энтальпия и Свободная энергия Гиббса денатурации), которые иначе получить нелегко. Любой, кто пытается изучить белок, найдет CD ценным инструментом для проверки того, что белок находится в своей нативной конформации, прежде чем проводить с ним обширные и / или дорогостоящие эксперименты. Также существует ряд других применений КД-спектроскопии в химии белков, не связанных с оценкой фракции альфа-спирали. Более того, спектроскопия КД использовалась в исследованиях биоорганических интерфейсов. В частности, он использовался для анализа различий во вторичной структуре сконструированного белка до и после титрования реагентом.[15]
Спектр КД белков в ближнем УФ (> 250 нм) дает информацию о третичная структура. Сигналы, полученные в области 250–300 нм, обусловлены поглощением, ориентацией диполей и природой окружающей среды фенилаланина, тирозина, цистеина (или S-S дисульфидные мостики ) и триптофан аминокислоты. В отличие от КД в дальнем УФ, спектр КД в ближнем УФ не может быть отнесен к какой-либо конкретной трехмерной структуре. Скорее, спектры КД в ближнем УФ-диапазоне предоставляют структурную информацию о природе простетических групп в белках, например гема групп в белках. гемоглобин и цитохром с.
Видимая спектроскопия КД - очень мощный метод изучения взаимодействий металл-белок, позволяющий разрешить отдельные электронные d-d переходы как отдельные полосы. Спектры КД в видимой области света получаются только тогда, когда ион металла находится в хиральном окружении, поэтому свободные ионы металла в растворе не обнаруживаются. Это имеет то преимущество, что позволяет наблюдать только металл, связанный с белком, поэтому легко получить зависимость от pH и стехиометрию. Оптическая активность в комплексах ионов переходных металлов приписывается конфигурационным, конформационным и вицинальным эффектам. Klewpatinond и Viles (2007) разработали набор эмпирических правил для предсказания появления видимых спектров КД для Cu2+ и Ni2+ плоско-квадратные комплексы с участием гистидина и координации основной цепи.
CD дает меньше конкретной структурной информации, чем Рентгеновская кристаллография и белок ЯМР спектроскопия, например, которая дает данные с атомным разрешением. Однако КД-спектроскопия - это быстрый метод, который не требует большого количества белков или обширной обработки данных. Таким образом, компакт-диск можно использовать для обзора большого количества растворитель условия, меняющиеся температура, pH, соленость, а также наличие различных кофакторов.
компакт диск спектроскопия обычно используется для изучения белков в растворах и, таким образом, дополняет методы исследования твердого состояния. Это также ограничение, поскольку многие белки встроены в мембраны в нативном состоянии, а растворы, содержащие мембранные структуры, часто сильно рассеивают. CD иногда измеряют в тонких пленках.
компакт диск спектроскопия также было сделано с использованием полупроводниковых материалов, таких как TiO2 для получения больших сигналов в УФ-диапазоне длин волн, где часто происходят электронные переходы для биомолекул.[16]
Экспериментальные ограничения
эта статья нужны дополнительные цитаты для проверка. (Март 2010 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
CD также изучался в углеводы, но с ограниченным успехом из-за экспериментальных трудностей, связанных с измерением спектров КД в вакуумной ультрафиолетовой (ВУФ) области спектра (100–200 нм), где находятся соответствующие полосы КД незамещенных углеводов. Замещенные углеводы с полосами выше ВУФ-области успешно измерены.
Измерение CD также осложняется тем фактом, что типичные водные буферные системы часто поглощают в диапазоне, в котором структурные особенности демонстрируют дифференциальное поглощение света с круговой поляризацией. Фосфат, сульфат, карбонат, и ацетат буферы, как правило, несовместимы с CD, если только они не были сильно разбавлены, например в диапазоне 10–50 мМ. Следует полностью избегать использования буферной системы TRIS при выполнении CD вдали от ультрафиолета. Борат и Ониевые соединения часто используются для установления соответствующего диапазона pH для экспериментов с CD. Некоторые экспериментаторы заменили хлорид-ион фторидом, потому что фторид меньше поглощает в далеком УФ, а некоторые работали в чистой воде. Другой, почти универсальный метод состоит в том, чтобы минимизировать поглощение растворителя за счет использования ячеек с меньшей длиной пути при работе в дальнем УФ-диапазоне, длина пути 0,1 мм не является редкостью в этой работе.
Помимо измерения в водных системах, CD, особенно в дальнем УФ-диапазоне, можно измерять в органических растворителях, например. этанол, метанол, трифторэтанол (TFE). Последний имеет то преимущество, что индуцирует формирование структуры белков, индуцируя бета-листы в одних и альфа-спирали в других, которые они не проявляют в нормальных водных условиях. Наиболее распространенные органические растворители, такие как ацетонитрил, THF, хлороформ, дихлорметан однако несовместимы с компакт-дисками в дальнем УФ-диапазоне.
Может быть интересно отметить, что спектры КД белков, используемые для оценки вторичной структуры, связаны с орбитальным поглощением от π до π * амидные связи связывание аминокислот. Эти полосы поглощения частично лежат в так называемые вакуумный ультрафиолет (длины волн менее примерно 200 нм). Интересующий диапазон длин волн фактически недоступен в воздухе из-за сильного поглощения света кислород на этих длинах волн. На практике эти спектры измеряются не в вакууме, а в бескислородном приборе (заполненном чистым азот газ).
После удаления кислорода, возможно, вторым по важности техническим фактором при работе на глубине менее 200 нм является проектирование остальной части оптической системы с низкими потерями в этой области. Критичным в этом отношении является использование алюминизированные зеркала покрытия которого оптимизированы для обеспечения низких потерь в этой области спектра.
Обычный источник света в этих приборах - короткая дуга высокого давления. ксеноновая лампа. Обычные ксеноновые дуговые лампы не подходят для использования в условиях слабого УФ-излучения. Вместо этого используются специально сконструированные лампы с оболочкой из синтетического материала высокой чистоты. плавленый кварц должны быть использованы.
Свет от синхротрон Источники имеют гораздо больший поток на коротких волнах и использовались для записи компакт-дисков с длиной волны до 160 нм. В 2010 году спектрофотометр КД на электронном накопителе ISA при Университете г. Орхус в Дании использовался для записи твердотельных спектров КД до 120 нм.[17]На квантово-механический уровень, характерная плотность кругового дихроизма и оптическое вращение идентичны. Оптическая вращательная дисперсия и круговой дихроизм разделяют одни и те же квантовая информация содержание.
Смотрите также
использованная литература
- ^ П. Аткинс; Ж. де Паула (2005). Элементы физической химии (4-е изд.). Oxford University Press. ISBN 978-0-7167-7329-0.
- ^ а б c Эдвард I. Соломон; А. Б. П. Левер (3 февраля 2006 г.). Неорганическая электронная структура и спектроскопия. Wiley-Interscience. п. 78. ISBN 978-0-471-97124-5. Получено 29 апреля 2011.
- ^ Введение в квантовую теорию 2ED Дэвид Парк, раздел 2.2, стр. 32 «... поляризация луча света - это в точности такая же вещь, как вращение пучка электронов, различия в терминологии отражают только случайности исторического порядка. открытие ».
- ^ Джеральд Д. Фасман (1996). Круговой дихроизм и конформационный анализ биомолекул. Springer. С. 3–. ISBN 978-0-306-45142-3. Получено 29 апреля 2011.
- ^ а б c Коджи Наканиши; Нина Берова; Роберт Вуди (1994). Круговой дихроизм: принципы и приложения. ВЧ. п. 473. ISBN 978-1-56081-618-8. Получено 29 апреля 2011.
- ^ Соломон, Нейдиг; А. Т. Векслер; Г. Шенк; Т. Р. Холман (2007). «Кинетические и спектроскопические исследования липоксигеназы N694C: исследование механизма активации субстрата негемового фермента железа». Варенье. Chem. Soc. 129 (24): 7531–7537. Дои:10.1021 / ja068503d. ЧВК 2896304. PMID 17523638.
- ^ Элисон Роджер; Бенгт Норден (1997). Круговой дихроизм и линейный дихроизм. Издательство Оксфордского университета. ISBN 978-0-19-855897-2. Получено 29 апреля 2011.
- ^ Р. Уильямс (1968). «Оптический вращательный эффект в нематической жидкой фазе п-азоксианизола». Письма с физическими проверками. 21 (6): 342. Дои:10.1103 / PhysRevLett.21.342.
- ^ Р. Уильямс (1969). «Оптико-вращательная сила и линейный электрооптический эффект в нематических жидких кристаллах параазоксианизола». Журнал химической физики. 50 (3): 1324. Дои:10.1063/1.1671194.
- ^ Plum, E .; Федотов, В. А .; Желудев, Н. И. (2008). «Оптическая активность в внешне хиральном метаматериале» (PDF). Письма по прикладной физике. 93 (19): 191911. Дои:10.1063/1.3021082. S2CID 117891131.
- ^ Plum, E .; Федотов, В. А .; Желудев, Н. И. (2016). «Зеркальная оптическая активность ахиральных метаповерхностей» (PDF). Письма по прикладной физике. 108 (14): 141905. Дои:10.1063/1.4944775.
- ^ Surma MA; Szczepaniak A .; Круличевский Ю. (2014). «Сравнительные исследования восстановления апоцитохрома b6 с помощью детергентов в липосомных бислоях, контролируемые Zetasizer Instruments». PLOS ONE. 9 (11): e111341. Bibcode:2014PLoSO ... 9k1341S. Дои:10.1371 / journal.pone.0111341. ISSN 1932-6203. ЧВК 4244035. PMID 25423011.
- ^ Уитмор Л., Уоллес Б.А. (2008). «Анализ вторичной структуры белков методом спектроскопии кругового дихроизма: методы и справочные базы данных». Биополимеры. 89 (5): 392–400. Дои:10.1002 / bip.20853. PMID 17896349.
- ^ Гринфилд, штат Нью-Джерси (2006). «Использование спектров кругового дихроизма для оценки вторичной структуры белка». Протоколы природы. 1 (6): 2876–90. Дои:10.1038 / nprot.2006.202. ЧВК 2728378. PMID 17406547.
- ^ Биоинорганический интерфейс: механистические исследования белкового синтеза наноматериалов. (2016, 5 мая). Получено 1 марта 2019 г., из https://pubs.acs.org/doi/pdf/10.1021/acs.jpcc.6b02569
- ^ Саркар, Сумант, Райан Бехунин и Джон Дж. Гиббс. «Зависящий от формы хирооптический отклик УФ-активных наноспиральных метаматериалов». Нано-буквы (2019). https://pubs.acs.org/doi/10.1021/acs.nanolett.9b03274
- ^ У. Мейерхенрих; J.J. Филиппи; К. Мейнерт; Я. Х. Бредехофт; Дж. Такахаши; Л. Нахон; Н. К. Джонс; С. В. Хоффманн (2010). "Круговой дихроизм аминокислот в вакуумно-ультрафиолетовой области". Энгью. Chem. Int. Эд. 49 (42): 7799–7802. Дои:10.1002 / anie.201003877. PMID 20845349.
внешние ссылки
- Спектроскопия кругового дихроизма от Alliance Protein Laboratories, поставщика коммерческих услуг
- Введение в спектроскопию кругового дихроизма компанией Applied Photophysics, поставщиком оборудования
- Анимированное пошаговое руководство по круговому дихроизму и оптическому вращению проф Валев.
- ^ Биоинорганический интерфейс: механистические исследования белкового синтеза наноматериалов. (2016, 5 мая). Получено 1 марта 2019 г., из https://pubs.acs.org/doi/pdf/10.1021/acs.jpcc.6b02569











![[ theta] = 3298.2 , Delta varepsilon. ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/c66e42a40570e3d3cb312c0eadd95d59170dc258)





![[ theta] = frac {100 theta} { text {Cl}} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/17937dcb872d465ae30a0ca841fba3e953e1e9b2)
![[ theta] = 100 , Delta varepsilon left ( frac { ln 10} {4} right) left ( frac {180} { pi} right) = 3298.2 , Delta варепсилон ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/88756c2cb3877d28ff0932ef432b0a5e4861ab58)