Вторичная структура белка - Protein secondary structure

Вторичная структура белка это трехмерный форма из местные сегменты из белки. Двумя наиболее распространенными вторичными структурными элементами являются: альфа спирали и бета-листы, хотя бета-ходы и омега петли тоже случаются. Элементы вторичной структуры обычно спонтанно образуются как промежуточные звенья перед белком. складки в его трехмерном третичная структура.
Вторичная структура формально определяется паттерном водородные связи между амино- водород и карбоксил атомы кислорода в пептиде позвоночник. В качестве альтернативы вторичная структура может быть определена на основе регулярного рисунка магистрали. двугранные углы в конкретном регионе Рамачандран сюжет независимо от того, имеет ли он правильные водородные связи.
Понятие вторичной структуры было впервые введено Кай Ульрик Линдерстрём-Ланг в Стэнфорд в 1952 г.[1][2] Другие виды биополимеры Такие как нуклеиновые кислоты также обладают характеристикой второстепенные конструкции.
Типы
| Атрибут геометрии | α-спираль | 310 спираль | π-спираль |
|---|---|---|---|
| Остатки за ход | 3.6 | 3.0 | 4.4 |
| Перевод на остаток | 1,5 Å (0,15 нм) | 2,0 Å (0,20 нм) | 1,1 Å (0,11 нм) |
| Радиус спирали | 2,3 Å (0,23 нм) | 1,9 Å (0,19 нм) | 2,8 Å (0,28 нм) |
| Подача | 5,4 Å (0,54 нм) | 6,0 Å (0,60 нм) | 4,8 Å (0,48 нм) |
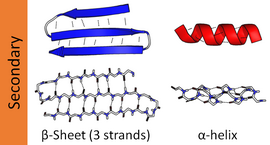
Наиболее распространенные вторичные структуры: альфа спирали и бета-листы. Другие спирали, такие как 310 спираль и π спираль, рассчитано, что они имеют энергетически благоприятные паттерны водородных связей, но редко наблюдаются в природных белках, за исключением концов α-спиралей из-за неблагоприятной упаковки основной цепи в центре спирали. Другие расширенные структуры, такие как полипролиновая спираль и альфа-лист редки в родное государство белки, но часто предполагаются как важные сворачивание белка промежуточные звенья. В обтяжку повороты а свободные, гибкие петли соединяют более «регулярные» элементы вторичной структуры. В случайный катушки не является истинной вторичной структурой, но представляет собой класс конформаций, указывающих на отсутствие регулярной вторичной структуры.
Аминокислоты различаются по своей способности образовывать различные элементы вторичной структуры. Пролин и глицин их иногда называют «разрушителями спирали», потому что они нарушают регулярность конформации α спиральной основной цепи; однако оба обладают необычными конформационными способностями и обычно встречаются в повороты. Аминокислоты, которые предпочитают принимать спиральный конформации в белках включают метионин, аланин, лейцин, глутамат и лизин ("МАЛЕК" в аминокислота Однобуквенные коды); напротив, большие ароматические остатки (триптофан, тирозин и фенилаланин ) и Cβ-разветвленные аминокислоты (изолейцин, валин, и треонин ) предпочитаю усыновлять β-цепь конформации. Однако этих предпочтений недостаточно, чтобы создать надежный метод предсказания вторичной структуры только на основе последовательности.
Считается, что низкочастотные коллективные колебания чувствительны к локальной жесткости внутри белков, показывая, что бета-структуры в целом более жесткие, чем альфа или неупорядоченные белки.[5][6] Измерения нейтронного рассеяния напрямую связали спектральные особенности на ~ 1 ТГц с коллективными движениями вторичной структуры бета-бочкообразного белка GFP.[7]
Образцы водородных связей во вторичных структурах могут быть значительно искажены, что затрудняет автоматическое определение вторичной структуры. Существует несколько методов формального определения вторичной структуры белка (например, DSSP,[8] ОПРЕДЕЛЯТЬ,[9] STRIDE,[10] ВинтФит,[11] SST[12]).
Классификация DSSP

Словарь вторичной структуры белка, сокращенно DSSP, обычно используется для описания вторичной структуры белка с однобуквенными кодами. Вторичная структура назначается на основе моделей водородных связей, как это было первоначально предложено Pauling et al. в 1951 г. (до структура белка когда-либо определялись экспериментально). DSSP определяет восемь типов вторичной структуры:
- G = 3-витковая спираль (310 спираль ). Минимальная длина 3 остатка.
- H = 4-витковая спираль (α спираль ). Минимальная длина 4 остатка.
- I = 5-витковая спираль (π спираль ). Минимальная длина 5 остатков.
- T = виток с водородной связью (3, 4 или 5 витков)
- E = удлиненная прядь параллельно и / или антипараллельно β-лист конформация. Минимальная длина 2 остатка.
- B = остаток в изолированном β-мостике (образование однопарной β-листовой водородной связи)
- S = изгиб (единственное назначение, не связанное с водородными связями).
- C = катушка (остатки, не входящие ни в одну из вышеуказанных конформаций).
«Катушка» часто обозначается как «» (пробел), C (катушка) или «-» (тире). Все спирали (G, H и I) и листовые конструкции должны иметь разумную длину. Это означает, что 2 соседних остатка в первичной структуре должны образовывать один и тот же узор водородных связей. Если спиральный или листовой рисунок водородных связей слишком короткий, они обозначаются буквами T или B соответственно. Существуют и другие категории вторичной структуры белка (крутые повороты, Омега-петли и др.), но они используются реже.
Вторичная структура определяется водородная связь, поэтому точное определение водородной связи имеет решающее значение. Стандартное определение водородной связи для вторичной структуры - это определение DSSP, которая является чисто электростатической моделью. Он назначает обвинения в размере ±q1 ≈ 0.42е к карбонильному углероду и кислороду соответственно, а заряды ±q2 ≈ 0.20е к амиду водорода и азота соответственно. Электростатическая энергия равна
Согласно DSSP, водородная связь существует тогда и только тогда, когда E меньше -0,5 ккал / моль (-2,1 кДж / моль). Хотя формула DSSP является относительно грубым приближением физический энергия водородной связи, она обычно используется в качестве инструмента для определения вторичной структуры.
SST[12] классификация
SST представляет собой байесовский метод для присвоения вторичной структуры координатным данным белка с использованием информационного критерия Шеннона минимальной длины сообщения (MML ) вывод. SST рассматривает любое присвоение вторичной структуры как потенциальную гипотезу, которая пытается объяснить (компресс ) с учетом данных о координатах белка. Основная идея заключается в том, что Лучший вторичное структурное назначение - это то, что может объяснить (компресс ) координаты данного белка координируют наиболее экономичным способом, таким образом связывая вывод вторичной структуры с сжатие данных без потерь. SST точно разделяет любую белковую цепь на области, связанные со следующими типами назначения:[13]
- E = (Расширенная) нить β-гофрированный лист
- G = правша 310 спираль
- H = Правша α-спираль
- I = Правша π-спираль
- g = левша 310 спираль
- h = левша α-спираль
- i = левша π-спираль
- 3 = 310-подобно Повернуть
- 4 = α-подобно Повернуть
- 5 = π-подобно Повернуть
- T = не указано Повернуть
- C = Катушка
- - = неназначенный остаток
SST обнаруживает π и 310 винтовые крышки по стандарту α-спирает и автоматически собирает различные удлиненные пряди в однородные β-гофрированные листы. Он обеспечивает читаемый вывод рассеченных вторичных структурных элементов и соответствующий PyMol -загружаемый скрипт для индивидуальной визуализации присвоенных вторичных структурных элементов.
Экспериментальное определение
Примерное содержание вторичной структуры биополимера (например, «этот белок составляет 40% α-спираль и 20% β-лист. ") можно оценить спектроскопически.[14] Для белков распространенным методом является дальний ультрафиолет (дальний УФ, 170–250 нм). круговой дихроизм. Выраженный двойной минимум на 208 и 222 нм указывает на α-спиральную структуру, тогда как одиночный минимум на 204 нм или 217 нм отражает структуру случайных катушек или β-листов, соответственно. Менее распространенный метод ИК-спектроскопия, который обнаруживает различия в колебаниях связей амидных групп из-за образования водородных связей. Наконец, содержание вторичной структуры можно точно оценить с помощью химические сдвиги первоначально неназначенного ЯМР спектр.[15]
Прогноз
Предсказание третичной структуры белка только по его аминокислотной последовательности является очень сложной задачей (см. предсказание структуры белка ), но использование более простых определений вторичной структуры более сговорчиво.
Ранние методы прогнозирования вторичной структуры ограничивались прогнозированием трех преобладающих состояний: спирали, листа или случайной спирали. Эти методы были основаны на склонности отдельных аминокислот к образованию спиралей или листов, иногда в сочетании с правилами оценки свободной энергии образующихся элементов вторичной структуры. Первыми широко используемыми методами предсказания вторичной структуры белка по аминокислотной последовательности были Метод Чоу – Фасмана[16][17][18] и Метод газового фактора.[19] Хотя такие методы утверждали, что они достигают ~ 60% точности в предсказании, какое из трех состояний (спираль / лист / рулон) принимает остаток, оценки слепых вычислений позже показали, что фактическая точность была намного ниже.[20]
Значительное увеличение точности (почти до ~ 80%) было достигнуто за счет использования множественное выравнивание последовательностей; Зная полное распределение аминокислот, которые встречаются в позиции (и в ее окрестностях, обычно ~ 7 остатков с каждой стороны) на всем протяжении эволюция дает гораздо лучшую картину структурных тенденций около этой позиции.[21][22] Для иллюстрации, данный белок может иметь глицин в заданном положении, что само по себе может указывать на случайную катушку там. Однако множественное выравнивание последовательностей может выявить, что благоприятные для спирали аминокислоты встречаются в этом положении (и в соседних положениях) в 95% гомологичных белков, охватывающих почти миллиард лет эволюции. Более того, исследуя средний гидрофобность в этом и близлежащих положениях такое же выравнивание может также указывать на структуру остатка доступность растворителей соответствует α-спирали. Взятые вместе, эти факторы предполагают, что глицин исходного белка имеет α-спиральную структуру, а не случайную спираль. Для объединения всех доступных данных для формирования прогноза с тремя состояниями используются несколько типов методов, в том числе: нейронные сети, скрытые марковские модели и опорные векторные машины. Современные методы прогнозирования также обеспечивают оценку достоверности своих прогнозов на каждой позиции.
Методы прогнозирования вторичной структуры были оценены Критическая оценка экспериментов по прогнозированию структуры белка (CASP) и постоянно тестируется, например к EVA (контрольный показатель). На основе этих тестов были найдены наиболее точные методы. Psipred, SAM,[23] ПОРТЬЕ,[24] ПРОФ,[25] и SABLE.[26] Основная область для улучшения, по-видимому, - это предсказание β-нитей; остатки, уверенно предсказанные как β-цепь, скорее всего, будут таковыми, но методы склонны упускать из виду некоторые сегменты β-цепи (ложноотрицательные результаты). Вероятно, существует верхний предел точности прогноза ~ 90% в целом из-за особенностей стандартного метода (DSSP ) для присвоения классов вторичной структуры (спираль / нить / спираль) структурам PDB, с которыми сравниваются прогнозы.[27]
Точное предсказание вторичной структуры - ключевой элемент в предсказании третичная структура, во всех, кроме самых простых (моделирование гомологии ) случаи. Например, уверенно предсказанный узор из шести элементов вторичной структуры βαββαβ является признаком ферредоксин складывать.[28]
Приложения
Вторичные структуры как белка, так и нуклеиновой кислоты могут использоваться для помощи в множественное выравнивание последовательностей. Эти сопоставления можно сделать более точными путем включения информации о вторичной структуре в дополнение к простой информации о последовательности. Иногда это менее полезно для РНК, потому что спаривание оснований намного более консервативно, чем последовательность. Дистанционные отношения между белками, первичные структуры которых несовместимы, иногда можно обнаружить по вторичной структуре.[21]
Было показано, что α-спирали более стабильны, устойчивы к мутациям и поддаются конструированию, чем β-цепи в природных белках,[29] таким образом, создание функциональных белков, содержащих все α, вероятно, будет проще, чем создание белков как со спиралями, так и с цепями; это недавно было подтверждено экспериментально.[30]
Смотрите также
Рекомендации
- ^ Линдерстрём-Ланг К.У. (1952). Медицинские лекции Лейна: белки и ферменты. Издательство Стэнфордского университета. п. 115. КАК В B0007J31SC.
- ^ Шеллман Дж. А., Шеллман К. Г. (1997). "Кай Ульрик Линдерстрём-Ланг (1896–1959)". Белковая наука. 6 (5): 1092–100. Дои:10.1002 / pro.5560060516. ЧВК 2143695. PMID 9144781.
Он уже представил концепции первичной, вторичной и третичной структуры белков в третьей лекции Лейна (Linderstram-Lang, 1952).
- ^ Стивен Боттомли (2004). «Интерактивное руководство по структуре белка». Архивировано из оригинал 1 марта 2011 г.. Получено 9 января, 2011.
- ^ Шульц, Г. Э. (Георг Э.), 1939- (1979). Принципы строения белков. Ширмер, Р. Хайнер, 1942-. Нью-Йорк: Springer-Verlag. ISBN 0-387-90386-0. OCLC 4498269.CS1 maint: несколько имен: список авторов (связь)
- ^ Perticaroli S, Nickels JD, Ehlers G, O'Neill H, Zhang Q, Sokolov AP (октябрь 2013 г.). «Вторичная структура и жесткость в модельных белках». Мягкая материя. 9 (40): 9548–56. Дои:10.1039 / C3SM50807B. PMID 26029761.
- ^ Perticaroli S, Nickels JD, Ehlers G, Соколов А.П. (июнь 2014 г.). «Жесткость, вторичная структура и универсальность бозонного пика в белках». Биофизический журнал. 106 (12): 2667–74. Дои:10.1016 / j.bpj.2014.05.009. ЧВК 4070067. PMID 24940784.
- ^ Никелс Дж. Д., Пертикароли С., О'Нил Х., Чжан К., Элерс Г., Соколов А.П. (2013). «Когерентное рассеяние нейтронов и коллективная динамика в белке, GFP». Биофиз. J. 105 (9): 2182–87. Дои:10.1016 / j.bpj.2013.09.029. ЧВК 3824694. PMID 24209864.
- ^ Кабш В., Сандер С. (декабрь 1983 г.). «Словарь вторичной структуры белков: распознавание образов водородных связей и геометрических элементов». Биополимеры. 22 (12): 2577–637. Дои:10.1002 / bip.360221211. PMID 6667333.
- ^ Ричардс FM, Кундрот CE (1988). «Идентификация структурных мотивов по координатным данным белка: вторичная структура и супервторичная структура первого уровня». Белки. 3 (2): 71–84. Дои:10.1002 / prot.340030202. PMID 3399495.
- ^ Фришман Д., Аргос П. (декабрь 1995 г.). «Определение вторичной структуры белка на основе знаний» (PDF). Белки. 23 (4): 566–79. CiteSeerX 10.1.1.132.9420. Дои:10.1002 / prot.340230412. PMID 8749853. Архивировано из оригинал (PDF) на 13.06.2010.
- ^ Каллигари П.А., Кнеллер Г.Р. (декабрь 2012 г.). «ВинтФит: сочетание локализации и описания вторичной структуры белка». Acta Crystallographica Раздел D. 68 (Пт 12): 1690–3. Дои:10.1107 / s0907444912039029. PMID 23151634.
- ^ а б Конагурту А.С., Леск А.М., Эллисон Л. (июнь 2012 г.). «Вывод о минимальной длине сообщения вторичной структуры из данных координат белка». Биоинформатика. 28 (12): i97 – i105. Дои:10.1093 / биоинформатика / bts223. ЧВК 3371855. PMID 22689785.
- ^ «Веб-сервер SST». Получено 17 апреля 2018.
- ^ Пелтон Дж. Т., Маклин Л. Р. (2000). «Спектроскопические методы анализа вторичной структуры белков». Анальный. Биохим. 277 (2): 167–76. Дои:10.1006 / abio.1999.4320. PMID 10625503.
- ^ Мейлер Дж, Бейкер Д. (2003). «Быстрое определение белковой складки с использованием неназначенных данных ЯМР». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 100 (26): 15404–09. Дои:10.1073 / пнас.2434121100. ЧВК 307580. PMID 14668443.
- ^ Чжоу П. Я., Фасман Г. Д. (январь 1974 г.). «Прогнозирование конформации белков». Биохимия. 13 (2): 222–45. Дои:10.1021 / bi00699a002. PMID 4358940.
- ^ Чжоу П. Я., Фасман Г. Д. (1978). «Эмпирические предсказания конформации белков». Ежегодный обзор биохимии. 47: 251–76. Дои:10.1146 / annurev.bi.47.070178.001343. PMID 354496.
- ^ Чжоу П. Я., Фасман Г. Д. (1978). «Предсказание вторичной структуры белков по их аминокислотной последовательности». Достижения в энзимологии и смежных областях молекулярной биологии. Достижения в энзимологии и смежных областях молекулярной биологии. 47. стр.45–148. Дои:10.1002 / 9780470122921.ch2. ISBN 9780470122921. PMID 364941.
- ^ Гарнье Дж., Осгуторп Диджей, Робсон Б. (март 1978). «Анализ точности и последствий простых методов для предсказания вторичной структуры глобулярных белков». Журнал молекулярной биологии. 120 (1): 97–120. Дои:10.1016/0022-2836(78)90297-8. PMID 642007.
- ^ Кабш В., Сандер С. (май 1983 г.). «Насколько хороши прогнозы вторичной структуры белка?». Письма FEBS. 155 (2): 179–82. Дои:10.1016/0014-5793(82)80597-8. PMID 6852232.
- ^ а б Симосис В.А., Херинга Дж. (Август 2004 г.). «Интеграция предсказания вторичной структуры белка и множественного выравнивания последовательностей». Современная наука о белках и пептидах. 5 (4): 249–66. Дои:10.2174/1389203043379675. PMID 15320732.
- ^ Пировано В., Херинга Дж. (2010). Прогнозирование вторичной структуры белка. Методы Мол. Биол. Методы молекулярной биологии. 609. С. 327–48. Дои:10.1007/978-1-60327-241-4_19. ISBN 978-1-60327-240-7. PMID 20221928.
- ^ Карплюс К (2009). «SAM-T08, прогнозирование структуры белка на основе HMM». Нуклеиновые кислоты Res. 37 (Выпуск веб-сервера): W492–97. Дои:10.1093 / нар / gkp403. ЧВК 2703928. PMID 19483096.
- ^ Полластри Г, МакЛисагт А (2005). «Портер: новый точный сервер для предсказания вторичной структуры белков». Биоинформатика. 21 (8): 1719–20. Дои:10.1093 / биоинформатика / bti203. PMID 15585524.
- ^ Yachdav G, Kloppmann E, Kajan L, Hecht M, Goldberg T, Hamp T, Hönigschmid P, Schafferhans A, Roos M, Bernhofer M, Richter L, Ashkenazy H, Punta M, Schlessinger A, Bromberg Y, Schneider R, Vriend G , Сандер К., Бен-Тал Н., Рост Б. (2014). «PredictProtein - открытый ресурс для онлайн-прогнозирования структурных и функциональных характеристик белков». Нуклеиновые кислоты Res. 42 (Выпуск веб-сервера): W337–43. Дои:10.1093 / нар / gku366. ЧВК 4086098. PMID 24799431.
- ^ Адамчак Р., Поролло А., Меллер Дж. (2005). «Сочетание предсказания вторичной структуры и доступности растворителей в белках». Белки. 59 (3): 467–75. Дои:10.1002 / prot.20441. PMID 15768403.
- ^ Kihara D (август 2005 г.). «Влияние дальнодействующих взаимодействий на формирование вторичной структуры белков». Белковая наука. 14 (8): 1955–963. Дои:10.1110 / л.с. 051479505. ЧВК 2279307. PMID 15987894.
- ^ Ци Ю, Гришин Н.В. (2005). «Структурная классификация тиоредоксин-подобных складчатых белков» (PDF). Белки. 58 (2): 376–88. CiteSeerX 10.1.1.644.8150. Дои:10.1002 / prot.20329. PMID 15558583.
Поскольку определение складки должно включать только основные вторичные структурные элементы, которые присутствуют в большинстве гомологов, мы определяем тиоредоксин-подобную складку как двухслойный α / β-сэндвич с паттерном вторичной структуры βαβββα.
- ^ Абрусан Г., Марш Дж. А. (2016). «Альфа-спирали более устойчивы к мутациям, чем бета-цепи». PLoS вычислительная биология. 12 (12): e1005242. Дои:10.1371 / journal.pcbi.1005242. ЧВК 5147804. PMID 27935949.
- ^ Rocklin GJ, et al. (2017). «Глобальный анализ сворачивания белков с использованием массового параллельного проектирования, синтеза и тестирования». Наука. 357 (6347): 168–175. Дои:10.1126 / science.aan0693. ЧВК 5568797. PMID 28706065.
дальнейшее чтение
- Бранден С., Автор J (1999). Введение в структуру белка (2-е изд.). Нью-Йорк: Наука Гарланд. ISBN 978-0815323051.
- Полинг Л, Кори РБ (1951). «Конфигурации полипептидных цепей с предпочтительными ориентациями вокруг одинарных связей: два новых гофрированных листа». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 37 (11): 729–40. Дои:10.1073 / pnas.37.11.729. ЧВК 1063460. PMID 16578412. (Оригинальная подтверждающая статья о бета-листе.)
- Полинг Л, Кори РБ, Брэнсон HR (1951). «Структура белков; две спиральные конфигурации полипептидной цепи с водородными связями». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 37 (4): 205–11. Дои:10.1073 / pnas.37.4.205. ЧВК 1063337. PMID 14816373. (конформации альфа- и пи-спиралей, поскольку они предсказали, что спирали были бы невозможны.)
внешняя ссылка
- NetSurfP - средство прогнозирования вторичной структуры и доступности поверхности
- ПРОФ
- ВинтФит
- PSSpred Программа обучения множественной нейронной сети для предсказания вторичной структуры белка
- Genesilico metaserver Metaserver, который позволяет запускать более 20 различных предсказателей вторичной структуры одним щелчком мыши
- SST веб-сервер: теоретико-информационное (основанное на сжатии) вторичное структурное задание.


