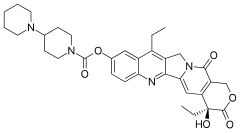
Иринотекан - Википедия - Irinotecan
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Camptosar, Campto, Onivyde, другие |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a608043 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Внутривенно |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | NA |
| Метаболизм | Печень глюкуронизация |
| Устранение период полураспада | От 6 до 12 часов |
| Экскреция | Желчный и почка |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.219.260 |
| Химические и физические данные | |
| Формула | C33ЧАС38N4О6 |
| Молярная масса | 586.689 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Иринотекан, продается под торговой маркой Camptosar среди прочего, это лекарство, используемое для лечения рак толстой кишки, и мелкоклеточный рак легких.[4] При раке толстой кишки он используется отдельно или с фторурацил.[4] При мелкоклеточном раке легкого используется с цисплатин.[4] Это дается медленное введение в вену.[4]
Общие побочные эффекты включают: понос, рвота, подавление костного мозга, выпадение волос, одышка и лихорадка.[4] Другие серьезные побочные эффекты включают: сгустки крови, воспаление толстой кишки, и аллергические реакции.[4] Те, у кого есть две копии UGT1A1 * 28 генный вариант подвержен более высокому риску побочных эффектов.[4] Использование во время беременности может нанести вред ребенку.[4] Иринотекан находится в ингибитор топоизомеразы семья лекарства.[5]Работает путем блокировки топоизомераза 1 что приводит к ДНК повреждение и смерть клетки.[4]
Иринотекан был одобрен для медицинского применения в США в 1996 году.[4] Это на Список основных лекарственных средств Всемирной организации здравоохранения.[6] Изготовлен из натурального соединения камптотецин которое встречается на китайском декоративном дереве Camptotheca acuminata.[4][7]
Медицинское использование
Его основное применение - в рак толстой кишки, в частности, в сочетании с другими химиотерапевтическими средствами.[2] Это включает режим ФОЛЬФИРИ, который состоит из инфузионных 5-фторурацил, лейковорин, и иринотекан. Режим XELIRI состоит из: капецитабин и иринотекан.[8][9]
Его также можно использовать вместе с фторурацилом и фолиевой кислотой для панкреатический рак после неудачи начального лечения.[10]
Побочные эффекты
Наиболее значительные побочные эффекты иринотекана включают диарею, тошноту и рвоту, нейтропению и лихорадку, инфекции крови или легких (сепсис, пневмония), шок, обезвоживание, почечную недостаточность и тромбоцитопению (низкий уровень тромбоцитов в крови).[3][11]
Диарея
Диарея, связанная с иринотеканом, является серьезной и клинически значимой, иногда приводящей к тяжелому обезвоживанию, требующему госпитализации или помещения в отделение интенсивной терапии. Этот побочный эффект купируется с помощью агрессивного использования противодиарейных средств, таких как лоперамид или же ко-фенотроп при первом жидком дефекации.
Иммуносупрессия
Иринотекан отрицательно влияет на иммунную систему. Это выражается в резко сниженном лейкоцит в крови, в частности нейтрофилы. У пациента может быть период нейтропения (клинически значимое снижение нейтрофилов в крови), в то время как костный мозг увеличивает выработку лейкоцитов для компенсации.
Механизм действия
Камптотецин, одна из четырех основных структурных классификаций противораковых соединений растительного происхождения, представляет собой цитотоксический алкалоид, который состоит из пентациклической кольцевой структуры, содержащей пиррол (3, 4 β) хинолиновый фрагмент, S-образную форму лактона и карбоксилатная форма.[12]Иринотекан активируется путем гидролиза до СН-38, ингибитор топоизомеразы I. Затем он инактивируется глюкуронизация уридиндифосфатглюкуронозилтрансферазой 1A1 (UGT1A1 ). Ингибирование топоизомеразы I активным метаболитом SN-38 в конечном итоге приводит к ингибированию как репликации ДНК, так и транскрипции.[11]
Молекулярное действие иринотекана происходит путем улавливания подмножества топоизомераза Комплексы расщепления -1-ДНК, содержащие гуанин +1 в последовательности ДНК.[13] Одна молекула иринотекана складывается против пар оснований, фланкирующих сайт расщепления, индуцированного топоизомеразой, и отравляет (инактивирует) топоизомераза 1 фермент.[13]
Интерактивный путь
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи. [§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: "IrinotecanPathway_WP46359".
Фармакогеномика
Иринотекан превращается ферментом в его активный метаболит SN-38, который, в свою очередь, инактивируется ферментом UGT1A1 путем глюкуронизации.
* 28 вариантных пациентов
Люди с вариантами UGT1A1 под названием TA7, также известный как «вариант * 28», экспрессируют меньше ферментов UGT1A1 в печени и часто имеют Синдром Жильбера. Во время химиотерапии они эффективно получают дозу, превышающую ожидаемую, потому что их организм не может выводить иринотекан так быстро, как другие. В исследованиях это соответствует более высокой частоте тяжелой нейтропении и диареи.[14]
В 2004 году было проведено клиническое исследование, которое проспективно подтвердило связь варианта * 28 с большей токсичностью, а также способность генетического тестирования предсказать эту токсичность до введения химиотерапии.[14]
В 2005 году FDA внесло изменения в маркировку иринотекана, добавив фармакогеномика рекомендации, чтобы получатели иринотекана с гомозиготный Полиморфизм (обе из двух копий гена) в гене UGT1A1, а именно вариант * 28, следует учитывать при снижении доз лекарства.[2] Иринотекан - один из первых широко используемых химиотерапевтических агентов, дозировка которого зависит от генотипа реципиента.[15]
Общество и культура
Одобрение
Иринотекан получил ускоренное одобрение в США. Управление по контролю за продуктами и лекарствами (FDA) в 1996 г.,[16] и полное одобрение в 1998 году.[17][18][19]
Имена
Во время разработки он был известен как CPT-11.[требуется медицинская цитата ]
Составы
Инкапсулированная в липосомы версия иринотекана, продаваемая как Onivyde компанией Merrimack Pharmaceuticals, был одобрен FDA в октябре 2015 года для лечения метастатических панкреатический рак.[20][21] Он был одобрен для медицинского применения в Европейском Союзе в октябре 2016 года.[3]
Рекомендации
- ^ «Онивид пегилированный липосомальный концентрат 4,3 мг / мл для раствора для инфузий - Сводка характеристик продукта (SmPC)». (emc). 18 февраля 2020 г.. Получено 25 мая 2020.
- ^ а б c «Камптозар-иринотекан гидрохлорид раствор для инъекций». DailyMed. 10 февраля 2020 г.. Получено 25 мая 2020.
- ^ а б c «Онивид пегилированный липосомальный EPAR». Европейское агентство по лекарствам (EMA). Получено 25 мая 2020. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- ^ а б c d е ж грамм час я j k «Иринотекан гидрохлорид». Американское общество фармацевтов систем здравоохранения. В архиве из оригинала 22 декабря 2016 г.. Получено 8 декабря 2016.
- ^ Британский национальный формуляр: BNF 69 (69 изд.). Британская медицинская ассоциация. 2015. с. 624. ISBN 9780857111562.
- ^ Всемирная организация здоровья (2019). Типовой список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г.. Женева: Всемирная организация здравоохранения. HDL:10665/325771. WHO / MVP / EMP / IAU / 2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ Генрих, Майкл; Барнс, Джоанна; Гиббонс, Саймон; Уильямсон, Элизабет М. (2012). Основы фармакогнозии и фитотерапии. Elsevier Health Sciences. п. 130. ISBN 978-0702052316.
- ^ Guo, Y; Ши, М; Шен, X; Ян, C; Ян, Л; Чжан, Дж (2014). «Капецитабин плюс иринотекан по сравнению с 5-ФУ / лейковорином плюс иринотекан в лечении колоректального рака: метаанализ». Клинический колоректальный рак. 13 (2): 110–8. Дои:10.1016 / j.clcc.2013.12.004. PMID 24461997.
- ^ Котака, М; Сюй, R; Муро, К; Парк, Ю. С .; Морита, S; Иваса, S; Uetake, H; Нишина, Т; Нодзава, H; Мацумото, H; Ямазаки, К. Han, S.W .; Ванга, Вт; Ahn, J. B .; Дэн, Y; Cho, S. H .; Залив; Lee, K. W .; Чжан, Т; Сато, Т; Buyse, M.E .; Ryoo, B. Y .; Шен, L; Сакамото, Дж; Ким, Т. В. (2016). «Протокол исследования азиатского проекта XELIRI ProjecT (AXEPT): многонациональное, рандомизированное, не меньшей эффективности, фаза III исследования химиотерапии второй линии метастатического колоректального рака, сравнивающая эффективность и безопасность XELIRI с бевацизумабом или без него и FOLFIRI с или без бевацизумаб ". Китайский журнал рака. 35 (1): 102. Дои:10.1186 / s40880-016-0166-3. ЧВК 5178089. PMID 28007025.
- ^ «Онивид-иринотекан гидрохлорид раствор для инъекций, порошок для раствора». DailyMed. 20 октября 2017 г.. Получено 25 мая 2020.
- ^ а б "Onivyde: EPAR - Информация о продукте" (PDF). Европейское агентство по лекарствам. 25 октября 2016 г. В архиве (PDF) из оригинала 16 января 2017 г.
- ^ «Нирмала, М. Джойс, А. Самундисвари и П. Дипа Санкар. 2011.« Природные ресурсы растений в противораковой терапии - обзор ». Исследования в области биологии растений 1 (3): 1-14».
- ^ а б Помье Y (2013). «Применение топоизомераз: уроки и проблемы». ACS Chem. Биол. 8 (1): 82–95. Дои:10.1021 / cb300648v. ЧВК 3549721. PMID 23259582.
- ^ а б Инноченти Ф., Ундевиа С.Д., Айер Л. и др. (Апрель 2004 г.). «Генетические варианты в гене UDP-глюкуронозилтрансферазы 1A1 предсказывают риск тяжелой нейтропении иринотекана». J. Clin. Онкол. 22 (8): 1382–8. Дои:10.1200 / JCO.2004.07.173. PMID 15007088.
- ^ О'Дуайер П.Дж., Каталано, РБ (октябрь 2006 г.). «Уридиндифосфатглюкуронозилтрансфераза (UGT) 1A1 и иринотекан: практическая фармакогеномика прибывает в терапию рака». J. Clin. Онкол. 24 (28): 4534–8. Дои:10.1200 / JCO.2006.07.3031. PMID 17008691. Архивировано из оригинал 15 апреля 2013 г.
- ^ «Камптозар: лекарства, одобренные FDA». НАС. Управление по контролю за продуктами и лекарствами (FDA). Получено 25 мая 2020.
- ^ «Пакет одобрения лекарственных средств: Camptosar (иринотекан гидрохлорид) NDA № 20-571 / S-008». НАС. Управление по контролю за продуктами и лекарствами (FDA). Получено 25 мая 2020.
- ^ «Утверждено новое лекарство от рака». Нью-Йорк Таймс. 1996-06-18. В архиве из оригинала 31.05.2016. Получено 2017-09-01.
- ^ Письмо с обзором FDA «Архивная копия» (PDF). НАС. Управление по контролю за продуктами и лекарствами (FDA). В архиве (PDF) из оригинала 30.01.2012. Получено 2011-07-26.CS1 maint: заархивированная копия как заголовок (связь)
- ^ «Онивайд». НАС. Управление по контролю за продуктами и лекарствами (FDA). 29 сентября 2016 г.. Получено 25 мая 2020.
- ^ Пресс-релиз (22 октября 2015 г.). «FDA одобряет новый метод лечения запущенного рака поджелудочной железы» (Пресс-релиз). НАС. Управление по контролю за продуктами и лекарствами (FDA). Архивировано из оригинал 24 октября 2015 г.
дальнейшее чтение
- Дин Л. (2015). «Иринотекан терапия и генотип UGT1A1». В Pratt VM, McLeod HL, Rubinstein WS, et al. (ред.). Резюме по медицинской генетике. Национальный центр биотехнологической информации (NCBI). PMID 28520360. Идентификационный номер книжной полки: NBK294473.
внешняя ссылка
- «Иринотекан». Портал информации о наркотиках. Национальная медицинская библиотека США.
- «Иринотекана гидрохлорид». Портал информации о наркотиках. Национальная медицинская библиотека США.
- Путь иринотекана на PharmGKB

