Селициклиб - Seliciclib
 | |
| Имена | |
|---|---|
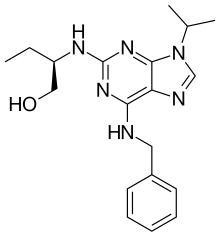
| Название ИЮПАК 2-(р) - (1-Этил-2-гидроксиэтиламино) -6-бензиламино-9-изопропилпурин | |
| Другие имена Росковитин; CYC202 | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
| MeSH | росковитин |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C19ЧАС26N6О | |
| Молярная масса | 354.458 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Селициклиб (росковитин или же CYC202) является экспериментальным препарат, средство, медикамент кандидат в семью фармакологических циклин-зависимая киназа (CDK) ингибиторы, которые предпочтительно ингибируют множественные ферментные мишени, включая CDK2, CDK7 и CDK9, которые изменяют фазу или состояние роста в пределах клеточный цикл леченных клетки. Seliciclib разрабатывается Циклацель Это многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование фазы II с диапазоном доз.
Целью данного исследования является оценка безопасности увеличения доз росковитина, вводимого перорально в течение 4 циклов по 4 последовательных дня (лечение «включено»), разделенных 3-дневным периодом отсутствия лечения (лечение «выключено») у взрослых пациентов с МВ с кистозным поражением. Фиброз, несущий 2 муковисцидоза. Мутации, вызывающие по крайней мере одну мутацию F508del-CFTR, и хронически инфицированные Pseudomonas aeruginosa.
В этом исследовании приняли участие 36 пациентов с муковисцидозом: 24 леченных и 12 контрольных.[1]
Селициклиб исследуется для лечения немелкоклеточный рак легкого (НМРЛ), Болезнь Кушинга, лейкемия, ВИЧ-инфекция, Болезнь Паркинсона, простой герпес инфекционное заболевание, кистозный фиброз[2] и механизмы хронический воспаление расстройства.
Селициклиб представляет собой 2,6,9-замещенный пурин аналог. Его структура в комплексе с CDK2 была определена в 1996 году.[3] Селициклиб подавляет CDK2 / E, CDK2 / A, CDK7 и CDK9.[4]
Использует
Этот раздел должен быть обновлено. (Январь 2014) |
Было обнаружено, что селициклиб производит апоптоз в обработанных раковых клетках немелкоклеточного рака легкого (НМРЛ) и других видов рака. Селициклиб ранее подвергался Клинические испытания фазы IIa у 240 пациентов с НМРЛ в виде комбинированной дозы с существующими препаратами первого и второго ряда.[4][5] В текущем ОЦЕНИТЬ В настоящее время исследуемый препарат проходит фазу IIb клинических испытаний в качестве монотерапии НМРЛ у пациентов третьей линии.[6] В побочные эффекты в исследованиях фазы I селициклиба при НМРЛ были:тошнота, рвота, кратковременное повышение уровня креатинина сыворотки и параметров функции печени, а также временное гипокалиемия ".[5]
Селициклиб также проходит клинические испытания для В-клетка лимфомы, в том числе множественная миелома. Было показано, что селициклиб ингибирует РНК-полимераза II -зависимый транскрипция и подавление белка MCL1.[7][8]
В нервной системе селициклиб подавляет микроглиаль активация[9] и предоставить некоторые нейрозащита в моделях животных церебральная ишемия.[10][11] Кроме того, он увеличивает противоопухолевую активность темозоломид в лечении мультиформная глиобластома и рассматривается как возможный вариант лечения глиомы.[12]
Селициклиб также возможен противовирусное средство. Это вызывает гибель клеток, инфицированных ВИЧ[13][14][15] и предотвращение репликации простой герпес вирус.[16][17]
Селициклиб был показан in vitro побудить апоптоз в нейтрофильные гранулоциты.[18] Если этот механизм окажется безопасным, надежным и эффективным in vivo, препарат может улучшить лечение хронических воспалительных заболеваний, таких как кистозный фиброз и артрит. Обычно их лечат глюкокортикоиды которые часто имеют серьезные побочные эффекты.
Было показано, что селициклиб вызывает партогенетическую активацию яиц. Однако он действительно создает аномальные вторые полярные тела и, следовательно, возможные анеуплоидные зиготы. Активация яиц обычно включает колебания кальция, однако этого не происходит с селициклибом. Seciclib вызывает активацию яиц путем ингибирования протеинкиназ, что приводит к инактивации фактора, способствующего созреванию (MPF).[19]
Рекомендации
- ^ https://clinicaltrials.gov/ct2/show/study/NCT02649751
- ^ Ноэль С., Фаво С., Норез С., Рожье С., Метти И., Бек Ф (2006). «Открытие производных пирроло [2,3-b] пиразинов в качестве субмикромолярных активаторов сродства дикого типа, G551D и F508del муковисцидоза, трансмембранного регулятора проводимости хлорных каналов». J Pharmacol Exp Ther. 319: 349–59. Дои:10.1124 / jpet.106.104521. PMID 16829626.
- ^ Де Азеведо В.Ф., Леклерк С., Мейер Л., Хавличек Л., Стрнад М., Ким С.Х. (1997). «Ингибирование циклин-зависимых киназ пуриновыми аналогами: кристаллическая структура человеческого cdk2 в комплексе с росковитином». Eur J Biochem. 243 (1–2): 518–526. Дои:10.1111 / j.1432-1033.1997.0518a.x. PMID 9030780.
- ^ а б «Cyclacel начинает рандомизированное испытание фазы IIb селициклиба для лечения немелкоклеточного рака легких, который ранее лечился». BIOWIRE. 29 июня 2006 г.
- ^ а б "Cyclacel сообщает о промежуточных данных по фазе IIa Seliciclib на ASCO 2005". Деловой провод. 15 мая 2005 г.
- ^ «Cyclacel Pharmaceuticals сообщает финансовые результаты за второй квартал 2006 года». Деловой провод. 14 августа 2006 г.
- ^ MacCallum DE, Melville J, Frame S, Watt K, Anderson S, Gianella-Borradori A, Lane DP, Green SR (2005). «Селициклиб (CYC202, R-Росковитин) индуцирует гибель клеток в клетках множественной миеломы путем ингибирования РНК-полимеразы II-зависимой транскрипции и подавления Mcl-1». Исследования рака. 65 (12): 5399–5407. Дои:10.1158 / 0008-5472.CAN-05-0233. PMID 15958589.
- ^ Ноопур Радже; Шаджи Кумар; Теру Хидешима; Альдо Роккаро; Кендзи Ишицука; Хироши Ясуи; Норихико Сираиси; Дхарминдер Чаухан; Никхил С. Мунши; Саймон Р. Грин; Кеннет С. Андерсон (1 августа 2005 г.). «Селициклиб (CYC202 или R-росковитин), низкомолекулярный ингибитор циклин-зависимой киназы, опосредует активность посредством подавления Mcl-1 при множественной миеломе». Кровь. 106 (3): 1042–1047. Дои:10.1182 / кровь-2005-01-0320. ЧВК 1895150. PMID 15827128.
- ^ Томов, Никола; Сурчев, Лачезар; Виденманн, Клеменс; Дёбрёши, Мате; Никкх, Гвидо (август 2019 г.). «Росковитин, экспериментальный ингибитор CDK5, вызывает отсроченное подавление рекрутирования микроглии, но не астроглии вокруг интрацеребральных дофаминергических трансплантатов». Экспериментальная неврология. 318: 135–144. Дои:10.1016 / j.expneurol.2019.04.013.
- ^ Менн, Бенедикт; Бах, Стефан; Blevins, Teri L .; Кэмпбелл, Марк; Мейер, Лоран; Тимсит, Серж (12.08.2010). Мандзони, Оливье Жак (ред.). «Отсроченное лечение системным (S) -росковитином обеспечивает нейропротекцию и ингибирует повышение активности CDK5 in vivo в моделях инсульта у животных». PLoS ONE. 5 (8): e12117. Дои:10.1371 / journal.pone.0012117. ISSN 1932-6203. ЧВК 2920814. PMID 20711428.
- ^ Русселе, Эстель; Летондор, Энн; Менн, Бенедикт; Курбэбэ, Янн; Квилле, Мари-Лиз; Тимсит, Серж (июнь 2018). «Устойчивая доставка (S) -росковитина способствует нейропротекции, связанной с функциональным восстановлением и уменьшением отека мозга, в рандомизированном слепом исследовании очаговой церебральной ишемии». Журнал церебрального кровотока и метаболизма. 38 (6): 1070–1084. Дои:10.1177 / 0271678X17712163. ISSN 0271-678X. ЧВК 5998998. PMID 28569655.
- ^ Панди, Вимал; Ранджан, Нихил; Нарне, Паримала; Бабу, Фанити Пракаш (21 марта 2019 г.). «Росковитин эффективно усиливает противоопухолевую активность темозоломида in vitro и in vivo за счет усиления аутофагии и апоптоза, зависимого от каспазы-3». Научные отчеты. 9 (1): 1–13. Дои:10.1038 / s41598-019-41380-1. ISSN 2045-2322. ЧВК 6428853. PMID 30899038.
- ^ Sadaie MR, Mayner R, Doniger J (январь 2004 г.). «Новый подход к разработке препаратов против ВИЧ: адаптация ненуклеозидных противораковых химиотерапевтических средств». Антивирусные исследования. 61 (1): 1–18. Дои:10.1016 / j.antiviral.2003.09.004. PMID 14670589.
- ^ Пумфери А., де ла Фуэнте С., Берро Р., Нехай С., Кашанчи Ф., Чао С.Х. (2006). «Возможное использование фармакологических ингибиторов циклинзависимой киназы в качестве терапевтических средств против ВИЧ». Curr Pharm Des. 12 (16): 1949–61. Дои:10.2174/138161206777442083. PMID 16787240.
- ^ Агботтах Э., де ла Фуэнте С., Нехай С., Барнетт А., Джанелла-Боррадори А., Пумфери А., Кашанчи Ф. (28 января 2005 г.). «Противовирусная активность CYC202 в ВИЧ-1-инфицированных клетках». J. Biol. Chem. 280 (4): 3029–42. Дои:10.1074 / jbc.M406435200. PMID 15531588.
- ^ Шанг Л. М., Розенберг А., Шаффер П. А. (2000). «Росковитин, специфический ингибитор клеточных циклин-зависимых киназ, подавляет синтез ДНК вируса простого герпеса в присутствии ранних вирусных белков». Дж. Вирол. 74 (5): 2107–20. Дои:10.1128 / JVI.74.5.2107-2120.2000. ЧВК 111691. PMID 10666240.
- ^ Диван П., Лакасс Дж. Дж., Шанг Л. М. (2004). «Росковитин ингибирует активацию промоторов в геномах вируса простого герпеса 1 типа независимо от промотор-специфических факторов». Дж. Вирол. 78 (17): 9352–9365. Дои:10.1128 / JVI.78.17.9352-9365.2004. ЧВК 506918. PMID 15308730.
- ^ Росси АГ, Савацки Д.А., Уокер А., Уорд С., Шелдрейк Т.А., Райли Н.А., Калдикотт А., Мартинес-Лоса М., Уокер Т.Р., Даффин Р., Грей М, Кресченци Е., Мартин М.С., Брэди Х.Дж., Сэвилл Дж.С., Дрансфилд I, Хаслетт C (2006). «Ингибиторы циклинзависимой киназы улучшают разрешение воспаления, способствуя апоптозу воспалительных клеток». Природа Медицина. 12 (9): 1056–1064. Дои:10,1038 / нм 1468. PMID 16951685.
- ^ Дори М, Галас С (1994). «Циклинзависимые протеинкиназы и контроль деления клеток». FASEB J. 8 (14): 1114–1121. Дои:10.1096 / fasebj.8.14.7958616.
