Викривирок - Vicriviroc
 | |
| Имена | |
|---|---|
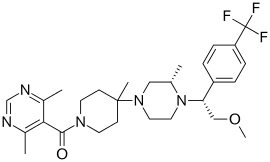
| Название ИЮПАК 5-({4-[(3S) -4- {2-метокси-1- [4- (трифторметил) фенил] этил} -3-метилпиперазин-1-ил] -4-метилпиперидин-1-ил} карбонил) -4,6-диметилпиримидин | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
| MeSH | Викривирок |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C28ЧАС38F3N5О2 | |
| Молярная масса | 533,629 г / моль |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Викривирок, ранее названные SCH 417690 и SCH-D, является пиримидин CCR5 ингибитор входа из ВИЧ-1. Он был разработан фармацевтический Компания Schering-Plough. Merck решили не добиваться разрешения регулирующих органов для использования у пациентов, прошедших лечение, поскольку препарат не соответствовал первичным конечным точкам эффективности в поздних исследованиях. Клинические испытания продолжаются на пациентах, ранее не получавших лечения от ВИЧ.
Фон ВИЧ-1
Механизмы ряда доступных лекарств против ВИЧ предотвращают либо фермент обратной транскриптазы вируса, либо фермент протеазы, позволяя вирусу проникнуть в клетку до того, как эти лекарства подействуют. Однако ингибиторы CCR5, такие как викривирок, а также другие ингибиторы проникновения ВИЧ-1 ингибируют начальные стадии жизненного цикла вируса.[1]
Запись о ВИЧ-1
ВИЧ связывается с целью и сливается с ней Т-клетки или макрофаги с помощью gp120 и gp41, единственные два белка, которые, как известно в настоящее время, экспонируются на поверхности вирусный конверт.[2] Одна молекула каждого белка нековалентно связывается с другой на вирусной мембране, и три из этих единиц объединяются с образованием gp120 / gp41 гетеротример, который захватывает gp41 в конформационно метастабильное состояние.[2]
Слияние мембран начинается со связывания gp120 с CD4, гликопротеин, который экспрессируется на поверхности клетки-мишени.[1] После связывания gp120 претерпевает конформационное изменение, которое вызывает образование сайта связывания корецептора на gp120.[2] Все штаммы ВИЧ-1 используют один из двух корецепторов: CCR5 или CXCR4; корецепторная специфичность будет описана ниже. Как только gp120 связывается с корецептором, gp41 претерпевает конформационное изменение, которое высвобождает его из его некогда метастабильного положения.[2] Это изменение заставляет гидрофобный N-конец белка gp41, также известный как домен слияния, вставляться в мембрану клетки-хозяина и закреплять вирус на месте.[1][2] Встраивание gp41 в клетку-мишень вызывает тонкую перестройку в белке gp41, которая объединяет две тримерные спиральные спирали, HR1 и HR2, с образованием пучка из шести спиралей.[2] Связка позволяет вирусной и клеточной мембранам сближаться и в конечном итоге сливаться вместе, что приводит к высвобождению вирусного генома в цитоплазму клетки-мишени.[2]
Корецепторы и тропизм
Два корецептора, участвующие в проникновении ВИЧ-1, CCR5 и CXCR4, принадлежат к большему семейству 7-трансмембранного сегмента (7ТМ Рецепторы, сопряженные с G-белком.[2] Таким образом, ВИЧ-1 можно классифицировать по специфичности к тому или иному корецептору. Вирус R5, также известный как М-тропный ВИЧ-1, нацелен на макрофаги и использует CCR5 в качестве корецептора. Вирус X4, или Т-тропный ВИЧ-1, нацелен на Т-клетки и использует CXCR4 в качестве корецептора. Также существуют двойные тропные штаммы ВИЧ-1, которые используют оба рецептора.[1] Селективность в отношении одного или другого корецептора особенно зависит от петли V3, очень вариабельной и структурно гибкой области gp120, которая состоит приблизительно из 35 аминокислот. Тропизм можно предсказать с помощью метода 11/25, который ищет основные аминокислоты в положениях 11 и 25 в петле V3 и предполагает присутствие вируса X4.[2]
Однако использование корецепторов может меняться в процессе заражения. 90% пациентов на ранних стадиях инфицирования ВИЧ-1 имеют вирус R5. Однако после пяти лет инфицирования примерно у 50% всех пациентов обнаруживается вирус X4.[2] Причины этого переключения в настоящее время неясны. Однако вирусные изменения от использования корецепторов CCR5 к CXCR4 были связаны с более высокой скоростью потери CD4 + Т-клеток, быстрым вирусным прогрессированием и повышенным уровнем развития СПИДа и смерти.[1][2]
CCR5-Δ32
Акцент на корецепторе CCR5 как потенциальной мишени для препаратов против ВИЧ начался в 1996 году с открытием CCR5-Δ32 или CCR5 delta-32, мутационного варианта гена, кодирующего CCR5.[1] Удаление 32 пар оснований в этом гене приводит к нефункциональным рецепторам CCR5.[1] Хотя частота этой мутации в популяциях европеоидов составляет 0,0808, люди африканского или азиатского происхождения, похоже, не обладают этим аллелем.[1] Гомозиготы Δ32 или люди, обладающие двумя копиями варианта Δ32, не имеют функциональных рецепторов CCR5 и, следовательно, обладают высокой устойчивостью к ВИЧ-инфекции.[1] Лица, унаследовавшие одну копию варианта Δ32 и одну копию нормального гена CCR5, являются гетерозиготами CCR5.[1] Гетерозиготы Δ32 по-прежнему восприимчивы к инфекции ВИЧ-1, но прогрессирование заболевания значительно замедляется по сравнению с таковыми с двумя нормальными копиями гена CCR5. Были разработаны антагонисты CCR5, которые вызывают деформацию корецептора CCR5, что приводит к неспособности клетки связываться с белком gp120 ВИЧ.[1]
SCH-C и викривирок
В 2001 году компания Schering-Plough разработала один из первых низкомолекулярных антагонистов CCR5, SCH-C или SCH 351125, который ингибировал репликацию ряда изолятов ВИЧ-1, которые использовали CCR5 в качестве корецептора для связывания.[3] Однако SCH-C вызывал умеренное, но дозозависимое удлинение скорректированного сердечного интервала QT (QTc ),[4] привело к изучению альтернативных соединений, чьи противовирусные и фармакокинетические свойства превосходили свойства соединений первого поколения, таких как SCH-C. Викривирок был обнаружен в результате высокопроизводительного скрининга и анализа взаимосвязи структура-активность (SAR).[5] По сравнению с SCH-C, викривирок последовательно и более активно подавляет репликацию вируса, связывается с более высоким сродством с CCR5, чем SCH-C, и обладает более низким сродством к ген, связанный с эфиром человека транскрипционный ионный канал, что может свидетельствовать о более низком риске сердечных эффектов.[4]
Способ действия
Викривирок - неконкурентный аллостерический антагонист CCR5.[6] Его вводят перорально, и, поскольку он эффективен при наномолярных концентрациях, его можно вводить один раз в день.[1][6] Викривирок связывается с небольшим гидрофобным карманом между трансмембранными спиралями вблизи внеклеточной поверхности рецептора CCR5.[1] Связывание с этим карманом вызывает конформационное изменение внеклеточного сегмента CCR5 и предотвращает связывание gp120 с клеткой-мишенью, следовательно, вообще предотвращая проникновение вируса в клетку-мишень.
Специфические связывающие взаимодействия между CCR5 и vicriviroc были впервые описаны в 2008 году.[7] В частности, трифторметилфенильная группа викривирока может сильно взаимодействовать с остатком I198 на пятой трансмембранной спирали (TM5) CCR5 посредством гидрофобных взаимодействий. Кроме того, электростатические взаимодействия могут образовываться между положительно заряженной третичной азотной группой викривирока и гидрофильной областью, обеспечиваемой остатком E238 на TM7 CCR5. Другие сильные взаимодействия, предсказанные группой, включают остаток Y108 на TM3 и Y251 на TM6.
Клинические испытания
В настоящее время викривирок проходит серьезные испытания. Викривирок продемонстрировал значительное снижение ВИЧ РНК в R5 -инфицированные субъекты. Среднее снижение РНК ВИЧ от исходного уровня составило 1,5 log.10 или больше во всех группах лечения (10, 25, 50 мг, делать ставку. ) в 14-дневном испытании монотерапии у ВИЧ-инфицированных взрослых.[8]
Испытание фазы II с участием субъектов, не получавших лечения, инфицированных ВИЧ-1, было прекращено после того, как частота вирусных рецидивов у субъектов, которым вводили викривирок, увеличилась по сравнению с контрольными субъектами; однако дальнейшие исследования показывают, что введенная доза викривирока могла быть слишком низкой.[2] В настоящее время проводится новое испытание фазы II на пациентах с ВИЧ-1, не получавших лечения.
48-недельное испытание фазы II (ACTG5211), посвященное изучению безопасности и эффективности доз викривирока 5, 10 и 15 мг, показало, что пациенты в группах лечения викривироком 10 мг и 15 мг достигли медианного снижения вирусной нагрузки на 1,92 и 1,44. (бревно10 копий / мл) и среднее увеличение количества клеток CD4 на 130 и 96 (клеток / мкл) от исходного уровня, соответственно. Больше пациентов в группе викривирока имели неопределяемый вирус через 48 недель (РНК ВИЧ-1 <400 / <50 копий / мл) по сравнению с пациентами в группе плацебо (57/37 процентов и 43/27 процентов против 14/11 процентов, соответственно).[9]
Результаты 48-недельного исследования фазы II (VICTOR-E1), посвященного изучению введения викривирока в дозах 20 или 30 мг в дополнение к режиму оптимизированной фоновой терапии (OBT)> 3 препаратов, который включал усиленный ритонавиром ингибитор протеазы, были представлены в Февраль 2008. Исследователи пришли к выводу, что «Викривирок 30 или 20 мг один раз в день плюс ритонавир-содержащая ОБТ обеспечивали устойчивое подавление вируса у субъектов, прошедших лечение, и увеличивали количество клеток CD4 независимо от количества активных препаратов в ОБТ».[10]
По состоянию на май 2008 г. были начаты два испытания фазы III (VICTOR-E3 и VICTOR E4) на пациентах, прошедших лечение.[11] Клинические испытания на поздней стадии, проведенные компанией, не соответствовали их первичным конечным точкам эффективности и Merck решила с января 2010 года не добиваться разрешения регулирующих органов на препарат.[12][13]
Проблемы, связанные с антагонистами CCR5
Имеющиеся данные клинических испытаний позволяют предположить, что новый метод борьбы с ВИЧ-1 может быть обнаружен в антагонистах CCR5. Исследования викривирока продолжаются и еще одного антагониста CCR5, маравирок, в настоящее время находится на рынке. Однако возникла озабоченность по поводу использования антагонистов CCR5 в качестве лечения против ВИЧ, поскольку такие препараты могут способствовать появлению устойчивых штаммов ВИЧ-1. Были выдвинуты две гипотезы такой устойчивости: ВИЧ-1 может эволюционировать и использовать только CXCR4 в качестве корецептора; или ВИЧ-1 может мутировать таким образом, что он все еще способен взаимодействовать с CCR5, несмотря на присутствие антагониста рецептора.[1] Фактически, уже созданы устойчивые к маравироку варианты ВИЧ-1. in vitro путем мутации остатков в петле V3 gp120.[2]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я j k л м п Идемёр V (2005). «Ингибиторы проникновения вируса иммунодефицита человека (ВИЧ) (специфические блокаторы CCR5) в разработке: станут ли они следующим новым методом лечения?». Клинические испытания ВИЧ. 6 (5): 272–7. Дои:10.1310 / 979L-39QP-NC9G-WFTF. PMID 16306033. S2CID 31384269.
- ^ а б c d е ж грамм час я j k л м Цибрис А (2007). «Обновленная информация об ингибиторах CCR5: научное обоснование, клинические данные и предполагаемое использование». Сеть исследований врачей. Получено 2008-05-11.
- ^ Палани А., Шапиро С., Кладер Дж. У., Гринли В. Дж., Кокс К., Стризки Дж., Эндрес М., Баруди Б. М. (2001). "Открытие 4 - [(Z) - (4-бромфенил) - (этоксиимино) метил] -1 '- [(2,4-диметил-3-пиридинил) карбонил] -4'-метил-1,4'- бипиперидин N-оксид (SCH 351125): пероральный биодоступный антагонист CCR5 человека для лечения ВИЧ-инфекции ». J Med Chem. 44 (21): 3339–42. Дои:10.1021 / jm015526o. PMID 11585437.
- ^ а б Strizki JM, Tremblay C, Xu S, Wojcik L, Wagner N, Gonsiorek W, Hipkin RW, Chou CC, Pugliese-Sivo C, Xiao Y, Tagat JR, Cox K, Priestley T., Sorota S, Huang W., Hirsch M, Рейес Г.Р., Баруди Б.М. (2005). «Открытие и характеристика викривирока (SCH 417690), антагониста CCR5 с высокой активностью против вируса иммунодефицита человека типа 1». Противомикробные препараты и химиотерапия. 49 (12): 4911–4919. Дои:10.1128 / AAC.49.12.4911-4919.2005. ЧВК 1315929. PMID 16304152.
- ^ Tagat JR, McCombie SW, Nazareno D, Labroli MA, Xiao Y, Steensma RW, Strizki JM, Baroudy BM, Cox K и др. (2004). «Антагонисты CCR5 на основе пиперазина в качестве ингибиторов ВИЧ-1. IV. Открытие 1 - [(4,6-диметил-5-пиримидинил) карбонил] - 4- [4- [2-метокси-1 (R) -4- (трифторметил) фенил] этил-3 (S) -метил-1-пиперазинил] - 4-метилпиперидин (Sch-417690 / Sch-D), мощный, высокоселективный и биодоступный перорально антагонист CCR5 ». J Med Chem. 47 (10): 2405–8. Дои:10.1021 / jm0304515. PMID 15115380.
- ^ а б AIDSinfo (2007). «Викривирок малеат». Национальные институты здравоохранения США. Получено 2008-05-11.
- ^ Кондру Р., Чжан Дж., Джи С., Мирзадеган Т., Ротштейн Д., Санкуратри С., Диошеги М. (2008). «Молекулярные взаимодействия CCR5 с основными классами низкомолекулярных антагонистов CCR5 против ВИЧ». Мол. Pharmacol. 73 (3): 789–800. Дои:10.1124 / моль.107.042101. PMID 18096812. S2CID 16267853.
- ^ Schürmann D, et al. (2007). «Противовирусная активность, фармакокинетика и безопасность викривирока, перорального антагониста CCR5, во время 14-дневной монотерапии у ВИЧ-инфицированных взрослых». СПИД. 21 (10): 1293–9. Дои:10.1097 / QAD.0b013e3280f00f9f. PMID 17545705. S2CID 6752651.
- ^ Бейкер Р. (2007). «Безопасность и эффективность экспериментального антагониста CCR5 Викривирока у пациентов с ВИЧ, прошедших лечение: 48-недельные результаты ACTG 5211». HIVandHepatitis.com. Архивировано из оригинал 23 августа 2007 г.. Получено 2008-05-11.
- ^ Хайлиман Л (2008). «Антагонист CCR5 Vicriviroc демонстрирует постоянные преимущества и хорошую переносимость через 48 недель: испытание VICTOR-E1». HIVandHepatitis.com. Получено 2008-05-11.
- ^ Бейкер Р. (2008). "Schering-Plough открывает набор участников 2 фазы III испытаний экспериментального антагониста CCR5 Vicriviroc". HIVandHepatitis.com. Архивировано из оригинал на 2007-11-12. Получено 2008-05-11.
- ^ Лофтус П (2010). «Merck не будет добиваться одобрения FDA для препарата против ВИЧ». Wall Street Journal. wsj.com. Получено 2010-01-21.
- ^ Пирсон Р. (2010-01-20). "Препарат Merck от слияния Schering не прошел испытания". reuters.com. Получено 2010-01-21.
