Мицеллярная электрокинетическая хроматография - Micellar electrokinetic chromatography
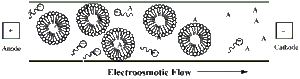
Мицеллярная электрокинетическая хроматография (MEKC) это хроматография техника, используемая в аналитическая химия. Это модификация капиллярный электрофорез (CE), расширяя свою функциональность до нейтральных аналитов,[1] где выборки разделены дифференциальным разбиением между мицеллы (псевдостационарная фаза) и окружающей водной буферный раствор (Мобильная фаза).[2]
Основные методы настройки и обнаружения, используемые для MEKC, такие же, как и в CE. Разница в том, что решение содержит поверхностно-активное вещество в концентрация это больше, чем критическая концентрация мицелл (CMC). Выше этой концентрации поверхностно-активное вещество мономеры находятся в равновесие с мицеллами.
В большинстве случаев MEKC выполняется в открытых капиллярах под щелочной условия для создания сильного электроосмотический поток. Додецилсульфат натрия (SDS) является наиболее часто используемым поверхностно-активным веществом в приложениях MEKC. Анионный характер сульфатных групп SDS приводит к тому, что поверхностно-активное вещество и мицеллы имеют электрофоретическая подвижность что противоречит направлению сильных электроосмотический поток. В результате мономеры и мицеллы поверхностно-активного вещества мигрируют довольно медленно, хотя их чистое движение все еще направлено на катод.[3] Во время разделения MEKC, аналиты распределяются между гидрофобный внутренняя часть мицеллы и гидрофильный буферный раствор, как показано на Рисунок 1.
Аналиты, которые нерастворимый внутри мицелл должны мигрировать со скоростью электроосмотического потока, , и быть обнаруженным во время удерживания буфера, . Аналиты, которые полностью растворяются в мицеллах (аналиты с высокой гидрофобностью), должны мигрировать со скоростью мицелл, , и элюировать во время последнего элюирования, .[4]
Теория
Скорость мицелл определяется:
куда - электрофоретическая скорость мицеллы.[4]
Время удерживания данного образца должно зависеть от коэффициента емкости, :
куда общее количество родинки растворенного вещества в мицелле и - общее количество молей в водной фазе.[4] В таком случае время удерживания растворенного вещества должно быть в пределах:
Заряженные аналиты имеют более сложное взаимодействие в капилляре, потому что они проявляют электрофоретическую подвижность, участвуют в электростатический взаимодействует с мицеллой и участвует в гидрофобном разделении.[5]
Доля пробы в водной фазе, , дан кем-то:
куда - скорость миграции растворенного вещества.[4] Значение также можно выразить через коэффициент мощности:
Используя соотношение между скоростью, длина трубки от конца инжекции до ячейки детектора () и время удерживания, , и , можно сформулировать зависимость между коэффициентом емкости и временем удерживания:[5]
Дополнительный член в скобках учитывает частичную подвижность гидрофобной фазы в MEKC.[5] Это уравнение напоминает выражение, полученное для в обычных упакованная кровать хроматография:
Переставив предыдущее уравнение, можно записать выражение для коэффициента удерживания:[6]
Из этого уравнения видно, что все аналиты, которые сильно распадаются на мицеллярную фазу (где по существу ∞) мигрируют одновременно, . В обычной хроматографии разделение подобных соединений может быть улучшено путем градиент элюирование. Однако в MEKC необходимо использовать методы, позволяющие расширить диапазон элюирования для отделения прочно удерживаемых аналитов.[5]
Диапазон элюирования может быть расширен несколькими способами, включая использование органический модификаторы, циклодекстрины, и смешанные мицеллярные системы. Короткоцепочечные спирты или ацетонитрил могут использоваться как органические модификаторы, уменьшающие и для улучшения разрешения аналитов, которые элюируются вместе с мицеллярной фазой. Однако эти агенты могут изменять уровень EOF. Циклодекстрины циклические полисахариды которые образуют комплексы включения, которые могут вызывать конкурентное гидрофобное разделение аналита. Поскольку комплексы аналит-циклодекстрин нейтральны, они будут перемещаться к катоду с более высокой скоростью, чем у отрицательно заряженных мицелл. Смешанные мицеллярные системы, такие как система, образованная объединением SDS с нейтральным поверхностно-активным веществом Brij-35, также могут быть использованы для изменения селективности MEKC.[5]
Приложения
Простота и эффективность MEKC сделали его привлекательным методом для множества приложений. Дальнейшие улучшения могут быть внесены в избирательность MEKC путем добавления хиральный селекторы или хиральные поверхностно-активные вещества в систему. К сожалению, этот метод не подходит для анализа белков, поскольку белки, как правило, слишком велики для разделения на мицеллы поверхностно-активного вещества и имеют тенденцию связываться с поверхностно-активным веществом. мономеры с образованием комплексов SDS-белок.[7]
Недавние применения MEKC включают анализ незаряженных пестициды,[8] основные и разветвленные аминокислоты в нутрицевтических продуктах,[9] углеводород и спиртосодержание майоран трава.[10]
MEKC также был нацелен из-за его потенциала для использования в комбинаторном химическом анализе. Появление комбинаторная химия позволил химики-медики синтезировать и идентифицировать большое количество потенциальных наркотики в относительно короткие промежутки времени. Небольшой образец и растворитель Требования и высокая разрешающая способность MEKC позволили использовать этот метод для быстрого анализа большого количества соединений с хорошим разрешением.
Традиционные методы анализа, например высокоэффективная жидкостная хроматография (ВЭЖХ), можно использовать для определения чистоты комбинаторной библиотеки, но анализы должны быть быстрыми с хорошим разрешением для всех компонентов, чтобы предоставить химикам полезную информацию.[11] Использование поверхностно-активного вещества в традиционных приборах для капиллярного электрофореза резко расширило сферу аналитов, которые можно разделить с помощью капиллярного электрофореза.
MEKC также может использоваться для повседневного контроля качества антибиотиков в фармацевтических препаратах или кормах.[12]
Рекомендации
- ^ Хынку, Габриэль; Русу, Аура; Саймон, Бригитта; Мирча, Элеонора; Гереси, Арпад (2013). «Принципы мицеллярной электрокинетической капиллярной хроматографии, применяемые в фармацевтическом анализе». Расширенный фармацевтический бюллетень. 3 (1): 1–8. Дои:10.5681 / apb.2013.001. ЧВК 3846027. PMID 24312804.
- ^ Terabe, S .; Otsuka, K .; Итикава, К .; Цучия, А .; Андо, Т. (1984). «Электрокинетические разделения мицеллярными растворами и открытыми трубчатыми капиллярами». Анальный. Chem. 56: 111–113. Дои:10.1021 / ac00265a031.
- ^ Бейкер, Д. «Капиллярный электрофорез» John Wiley & Sons, Inc.: Нью-Йорк, 1995.
- ^ а б c d Terabe, S .; Otsuka, K .; Итикава, К .; Цучия, А .; Андо, Т. (1984). «Электрокинетические разделения мицеллярными растворами и открытыми трубчатыми капиллярами». Анальный. Chem. 56: 113. Дои:10.1021 / ac00265a031.
- ^ а б c d е Cunico, R.L .; Goodin, K.M .; Вер, Т. "Базовая ВЭЖХ и КЭ биомолекул" Биоаналитическая лаборатория залива: Ричмонд, Калифорния, 1998.
- ^ Фоли, Дж. П. (1990). «Оптимизация мицеллярной электрокинетической хроматографии». Анальный. Chem. 62 (13): 1302–1308. Дои:10.1021 / ac00212a019.
- ^ Skoog, D.A .; Holler, F.J .; Ниман, Т. "Принципы инструментального анализа, 5-е изд." Издательство колледжа Сондерса: Филадельфия, 1998.
- ^ Карретеро, A.S .; Cruces-Blanco, C .; Ramirez, S.C .; Pancorbo, A.C .; Гутьеррес, А.Ф. (2004). «Применение мицеллярной электрокинетической капиллярной хроматографии для анализа незаряженных пестицидов воздействия окружающей среды». J. Agric. Food Chem. 52 (19): 5791–5795. Дои:10.1021 / jf040074k. PMID 15366822.
- ^ Cavazza, A .; Corradini, C .; Lauria, A .; Николетти, И. (2000). "Экспресс-анализ незаменимых аминокислот и аминокислот с разветвленной цепью в нутрицевтических продуктах с помощью мицеллярной электрокинетической капиллярной хроматографии". J. Agric. Food Chem. 48 (8): 3324–3329. Дои:10.1021 / jf991368m.
- ^ Родригес, M.R.A .; Caramao, E.B .; Arce, L .; Rios, A .; Валькарсель, М. (2002). «Определение монотерпеновых углеводородов и спиртов в Majorana hortensis Moench с помощью мицеллярной электрокинетической капиллярной хроматографии». J. Agric. Food Chem. 50 (15): 4215–4220. Дои:10.1021 / jf011667n.
- ^ Simms, P.J .; Джеффрис, К.Т .; Huang, Y .; Zhang, L .; Arrhenius, T .; Надзан, А. (2001). «Анализ образцов комбинаторной химии с помощью мицеллярной электрокинетической хроматографии». J. Comb. Chem. 3 (5): 427–433. Дои:10,1021 / cc000093g.
- ^ Injac, R .; Кочевар, Н .; Крефт, С. (2007). «Прецизионность мицеллярной электрокинетической капиллярной хроматографии при определении семи антибиотиков в фармацевтических препаратах и кормах». Analytica Chimica Acta. 594 (1): 119–127. Дои:10.1016 / j.aca.2007.05.003. PMID 17560393.
Источники
- Кили, Д.; Хейнс П.Дж .; мгновенные заметки, Аналитическая химия, стр. 182-188






















