Фенэтиламин - Википедия - Phenethylamine
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | /жɛпˈɛθəлəмяп/ |
| Другие имена | PEA; фенилэтиламин |
| Зависимость обязанность | Психологические: низкий – средний[нужна цитата ] Физический: никто |
| Зависимость обязанность | Нет – Низкий (без Ингибитор МАО-В )[1] Умеренная (с ингибитором МАО-В)[1] |
| Маршруты администрация | Устный (принимается через рот) |
| Класс препарата | ЦНС стимулятор |
| Код УВД |
|
| Физиологический данные | |
| Источник ткани | Черная субстанция компактная; Вентральная тегментальная область; Синий цвет; многие другие |
| Целевые ткани | Общесистемный |
| Рецепторы | Сильно варьируется в зависимости от вида; Рецепторы человека: hTAAR1[2] |
| Предшественник | L-фенилаланин[3][4] |
| Биосинтез | Ароматическая декарбоксилаза L-аминокислот (AADC)[3][4] |
| Метаболизм | В первую очередь: МАО-Б[3][4][5] Другие ферменты: МАО-А,[5][6] SSAO (AOC2 & AOC3 ),[5][7] PNMT,[3][4][5] ААНАТ,[5] FMO3,[8][9] и другие |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Метаболизм | В первую очередь: МАО-Б[3][4][5] Другие ферменты: МАО-А,[5][6] SSAO (AOC2 & AOC3 ),[5][7] PNMT,[3][4][5] ААНАТ,[5] FMO3,[8][9] и другие |
| Устранение период полураспада | |
| Экскреция | Почечный (почки) |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| NIAID ChemDB | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.000.523 |
| Химические и физические данные | |
| Формула | C8ЧАС11N |
| Молярная масса | 121.183 г · моль−1 |
| 3D модель (JSmol ) | |
| Плотность | 0,9640 г / см3 |
| Температура плавления | −60 ° С (−76 ° F) [11] |
| Точка кипения | 195 ° С (383 ° F) [11] |
| |
| |
| (проверять) | |
Фенэтиламин[примечание 1] (PEA) является органическое соединение, естественный моноамин алкалоид, и след амина, который действует как Центральная нервная система стимулятор в людях. В головном мозге фенэтиламин регулирует моноаминовая нейротрансмиссия путем привязки к следовой амин-ассоциированный рецептор 1 (TAAR1) и ингибирующий везикулярный переносчик моноаминов 2 (VMAT2) в моноамине нейроны.[1][12][13] В меньшей степени он также действует как нейротрансмиттер в человеке Центральная нервная система.[14] У млекопитающих фенэтиламин производится от аминокислота L-фенилаланин ферментом декарбоксилаза ароматических L-аминокислот через ферментативный декарбоксилирование.[15] Помимо присутствия у млекопитающих, фенэтиламин содержится во многих других организмах и продуктах питания, таких как шоколад особенно после микробный ферментация.
Фенэтиламин продается как пищевая добавка для предполагаемого настроение и потеря веса -связанные с терапевтические преимущества; однако в устно проглоченный фенэтиламин, значительное количество метаболизируется в тонкий кишечник к моноаминоксидаза B (МАО-Б), а затем альдегиддегидрогеназа (ALDH), которые конвертируют его в фенилуксусная кислота.[5] Это означает, что для значительных концентрации достичь мозг доза должна быть выше, чем для других способов введения.[5][6][16]
Фенэтиламины, точнее, замещенные фенэтиламины, являются группой фенэтиламина производные содержащие фенэтиламин в качестве «основы»; другими словами, это химический класс включает производная соединения, которые образуются путем замены одного или нескольких атомов водорода в структуре ядра фенэтиламина на заместители. Класс замещенные фенэтиламины включает все замещенные амфетамины, и замещенные метилендиоксифенэтиламины (MDxx) и содержит множество препаратов, которые действуют как эмпатогены, стимуляторы, психоделики, аноректики, бронходилататоры, противоотечные средства, и / или антидепрессанты, среди прочего.
Естественное явление
Фенэтиламин вырабатывается широким спектром видов растений и животных, включая человека;[15][17] это также производится некоторыми грибы и бактерии (роды: Лактобациллы, Clostridium, Псевдомонады и семья Энтеробактерии ) и действует как мощный противомикробный против некоторых патогенных штаммов кишечная палочка (например, O157: штамм H7 ) при достаточных концентрациях.[18]
Химия


Фенэтиламин представляет собой первичный амин, аминогруппа которого присоединена к бензольное кольцо через двухуглеродистый, или этильная группа.[19] Это бесцветная жидкость при комнатной температуре, имеющая рыбный запах и растворимая в воде. этиловый спирт и эфир.[19] Его плотность составляет 0,964 г / мл, а температура кипения составляет 195 ° C.[11] При контакте с воздухом соединяется с углекислый газ сформировать прочный карбонат соль.[20] Фенэтиламин сильно базовый, pKб = 4,17 (или pKа = 9,83), как измерено с использованием соли HCl, и образует стабильный кристаллический гидрохлорид соль с температурой плавления 217 ° C.[19][21]
Замещенные производные
Замещенные фенэтиламины представляют собой химический класс из органические соединения на основе структуры фенэтиламина;[заметка 2] класс состоит из всех производная соединения фенэтиламина, которые могут быть образованы заменой, или замена, один или больше атомы водорода в структуре ядра фенэтиламина с заместители.
Многие замещенные фенэтиламины являются психоактивными препаратами, которые принадлежат к множеству различных классов наркотиков, включая стимуляторы центральной нервной системы (например., амфетамин ), галлюциногены (например., 2,5-диметокси-4-метиламфетамин ), энтактогены (например., 3,4-метилендиоксиамфетамин ), подавители аппетита (например. фентермин ), назальные деконгестанты и бронходилататоры (например., псевдоэфедрин ), антидепрессанты (например. бупропион ), противопаркинсонические средства (например., селегилин ), и вазопрессоры (например., эфедрин ) и другие. Многие из этих психоактивных соединений проявляют свои фармакологические эффекты в первую очередь за счет модуляции моноаминный нейромедиатор системы; однако не существует механизма действия или биологической мишени, общих для всех членов этого подкласса.
Многочисленные эндогенный соединения - в том числе гормоны, моноаминовые нейротрансмиттеры и многие следы аминов (например., дофамин, норэпинефрин, адреналин, тирамин, и др.) - замещенные фенэтиламины. Несколько известных рекреационных наркотиков, таких как МДМА (экстаз), метамфетамин, и катиноны, также являются членами класса. Все замещенные амфетамины также являются фенэтиламины.
Фармацевтические препараты, заменяющие фенэтиламины, включают: фенелзин, фенформин, и фанетизол, среди многих других.
Синтез
Один способ получения β-фенэтиламина, изложенный в J. C. Robinson и H.R.Snyder's Органический синтез (опубликовано в 1955 г.), предполагает сокращение бензилцианид с водород в жидкости аммиак, при наличии Рене-Никель катализатор, при температуре 130 ° C и давлении 13,8 МПа. Альтернативные синтезы изложены в сносках к этому препарату.[22]
Гораздо более удобный метод синтеза β-фенэтиламина - восстановление ω-нитростирол к литийалюминийгидрид в эфире, об успешном исполнении которого впервые сообщили Р. Ф. Нистром и У. Г. Браун в 1948 году.[23]
Фенэтиламин также может быть получен путем катодного восстановления бензилцианид в разделенной камере.[24]

Сборка структур фенэтиламина для синтеза таких соединений, как адреналин, амфетамины, тирозин и дофамин путем добавления бета-аминоэтильной боковой цепи к фенил кольцо возможно. Это можно сделать через Ацилирование Фриделя-Крафтса с N-защитой ацилхлориды когда арена активирована, или Чертовски реакция фенила с N-виниломоксазолон, с последующим гидрирование, или путем перекрестного связывания с бета-амино цинкорганический реагенты, или взаимодействие бромированного арена с бета-аминоэтил литийорганический реагенты, или Кросс-муфта Suzuki.[25]
Обнаружение в биологических жидкостях
Обзоры, которые покрывают Синдром дефицита внимания и гиперактивности (СДВГ) и фенэтиламин показывают, что несколько исследований обнаружили аномально низкие концентрации фенэтиламина в моче у людей с СДВГ по сравнению с контрольной группой.[26] У людей, реагирующих на лечение, амфетамин и метилфенидат значительно увеличить концентрацию фенэтиламина в моче.[26] СДВГ биомаркер Обзор также показал, что уровни фенэтиламина в моче могут быть диагностическим биомаркером СДВГ.[26]
Было показано, что 30 минут физических упражнений средней и высокой интенсивности вызывают увеличение мочеиспускания. фенилуксусная кислота, основной метаболит фенэтиламина.[3][27][28] В двух обзорах отмечалось исследование, в котором средняя концентрация фенилуксусной кислоты в моче за 24 часа после всего лишь 30 минут интенсивных упражнений выросла на 77% по сравнению с исходным уровнем;[3][27][28] обзоры показывают, что синтез фенэтиламина резко увеличивается во время физических упражнений, во время которых он быстро метаболизируется из-за его короткого периода полураспада, составляющего примерно 30 секунд.[3][27][28][4] В состоянии покоя фенэтиламин синтезируется в катехоламин нейроны из L-фенилаланин к декарбоксилаза ароматических аминокислот примерно с той же скоростью, что и дофамин.[4] Он дезаминирует первичные и вторичные амины, которые свободны в цитоплазме нейронов, но не связаны в везикулах хранения симпатического нейрона. Точно так же β-PEA не будет дезаминироваться в кишечнике, поскольку он является селективным субстратом для MAO-B, которого нет в кишечнике. Уровни эндогенных следов аминов в мозге в несколько сотен раз ниже, чем у классических нейромедиаторов норадреналина, дофамина и серотонин, но их скорость синтеза эквивалентна скорости синтеза норадреналина и дофамина, и у них очень быстрая скорость обмена.[29] Уровни следов аминов в эндогенной внеклеточной ткани, измеренные в головном мозге, находятся в низком наномолярном диапазоне. Эти низкие концентрации возникают из-за их очень короткого периода полураспада. Из-за фармакологической связи между фенэтиламином и амфетамином исходная статья и оба обзора предполагают, что фенэтиламин играет важную роль в опосредовании улучшения настроения. эйфорический эффекты высокий бегун, поскольку и фенэтиламин, и амфетамин обладают сильным действием эйфорианты.[3][27][28]
Прыжки с парашютом Также было показано, что он вызывает заметное увеличение концентрации фенэтиламина в моче.[19][30]
Фармакология
Фармакодинамика
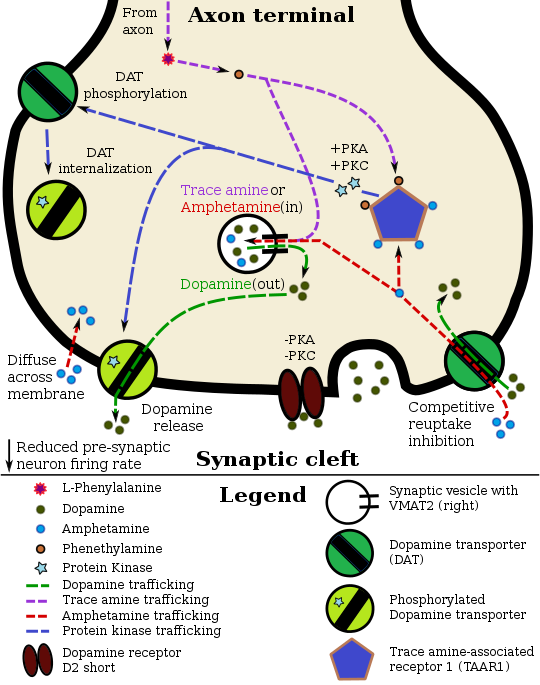
Фармакодинамика фенэтиламина в TAAR1-дофаминовом нейроне |
Фенэтиламин, будучи похож на амфетамин в своем действии на их общих биомолекулярные мишени, релизы норэпинефрин и дофамин.[12][13][34] Фенэтиламин также, по-видимому, индуцирует высвобождение ацетилхолина через механизм, опосредованный глутаматом.[35]
Было показано, что фенэтиламин связывается с человеческий следовой амин-ассоциированный рецептор 1 (hTAAR1) как агонист.[2]
Фармакокинетика
К устный маршрут, фенэтиламин период полураспада является 5–10 минут;[10] эндогенно продуцируемый в нейронах катехоламинов ПЭА имеет период полураспада примерно 30 секунд.[3] У людей PEA метаболизируется фенилэтаноламин N-метилтрансфераза (ПНМТ),[3][4][5][39] моноаминоксидаза A (МАО-А),[5][6] моноаминоксидаза B (МАО-Б),[3][4][5][16] то Семикарбазид-чувствительные аминоксидазы (SSAO) AOC2 и AOC3,[5][7] флавинсодержащая монооксигеназа 3 (FMO3),[8][9] и аралкиламин N-ацетилтрансфераза (ААНАТ).[5][40] N-Метилфенэтиламин, изомер из амфетамин, вырабатывается в организме человека в результате метаболизма фенэтиламина под действием PNMT.[3][4][39] β-фенилуксусная кислота является основным метаболитом фенэтиламина с мочой и производится через моноаминоксидаза метаболизм и последующие альдегиддегидрогеназа метаболизм.[5] Фенилацетальдегид представляет собой промежуточный продукт, который продуцируется моноаминоксидазой и затем метаболизируется в β-фенилуксусную кислоту альдегиддегидрогеназой.[5][41]
Когда исходная концентрация фенилэтиламина в головном мозге низкая, уровни в мозге могут повышаться. В 1000 раз при принятии ингибитор моноаминоксидазы (MAOI), особенно Ингибитор МАО-В, и по 3–4 раз, когда начальная концентрация высока.[42]
Смотрите также
Примечания
- ^ Синонимы и варианты написания включают: фенилэтиламин, β-фенилэтиламин (β-ПЭА), 2-фенилэтиламин, 1-амино-2-фенилэтан, и 2-фенилэтан-1-амин.
- ^ Другими словами, все соединения, относящиеся к этому классу, являются структурные аналоги фенэтиламина.
Рекомендации
- ^ а б c Пей Ю., Асиф-Малик А., Каналес Дж. Дж. (Апрель 2016 г.). «Следовые амины и рецептор, связанный с следами аминов 1: фармакология, нейрохимия и клинические последствия». Передний. Неврологи. 10: 148. Дои:10.3389 / fnins.2016.00148. ЧВК 4820462. PMID 27092049.
Кроме того, были получены доказательства способности ТА модулировать вознаграждение мозга (т. Е. Субъективное переживание удовольствия) и подкрепление (т. Е. Усиление условной реакции на данный стимул; Greenshaw, 1984), предполагая участие ТА. в неврологической адаптации, лежащей в основе наркозависимости, хроническом рецидивирующем синдроме, характеризующемся компульсивным приемом наркотиков, неспособностью контролировать прием наркотиков и дисфорией, когда доступ к препарату запрещен (Koob, 2009). В соответствии с его предполагаемой ролью как «эндогенного амфетамина», β-PEA, как было показано, обладает усиливающими свойствами, определяющим признаком, лежащим в основе склонности к злоупотреблению амфетамином и другими психомоторными стимуляторами. β-ПЭА был так же эффективен, как и амфетамин, в своей способности вызывать обусловленное предпочтение места (т. е. процесс, с помощью которого организм узнает связь между действием препарата и определенным местом или контекстом) у крыс (Gilbert and Cooper, 1983) и был легко принимались самостоятельно собаками, у которых была стабильная история (т.е. состоявшая из раннего приобретения и последующего поддержания) самостоятельного введения амфетамина или кокаина (Risner and Jones, 1977; Shannon and Thompson, 1984). В другом исследовании высокие концентрации β-ПЭА дозозависимо поддерживали ответ у обезьян, которые ранее были обучены самостоятельно вводить кокаин, а предварительная обработка ингибитором МАО-В, который задерживал дезактивацию β-ПЭА, еще больше увеличивал частоту ответа (Bergman et al. др., 2001).
- ^ а б Хан MZ, Nawaz W (октябрь 2016 г.). «Новые роли человеческих следовых аминов и человеческих следовых амино-ассоциированных рецепторов (hTAAR) в центральной нервной системе». Биомед. Фармаколог. 83: 439–449. Дои:10.1016 / j.biopha.2016.07.002. PMID 27424325.
- ^ а б c d е ж грамм час я j k л м Линдеманн Л., Хенер М.С. (2005). «Возрождение следовых аминов, вдохновленное новым семейством GPCR». Trends Pharmacol. Наука. 26 (5): 274–281. Дои:10.1016 / j.tips.2005.03.007. PMID 15860375.
Фармакология ТА также может способствовать молекулярному пониманию хорошо известного антидепрессивного эффекта физических упражнений [51]. В дополнение к различным положительным эффектам на функцию мозга, которые в основном объясняются активацией пептидных факторов роста [52,53], упражнения вызывают быстрое усиление выведения основного метаболита β-PEA β-фенилуксусной кислоты (β-PAA) в среднем на 77%, по сравнению с контрольными субъектами в состоянии покоя [54], что отражает повышенный синтез β-PEA ввиду его ограниченного периода полувыведения из эндогенного пула ~ 30 с [18,55].
- ^ а б c d е ж грамм час я Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Pharmacol. Ther. 125 (3): 363–375. Дои:10.1016 / j.pharmthera.2009.11.005. PMID 19948186.
Следовые амины метаболизируются в организме млекопитающих с помощью моноаминоксидазы.
- ^ а б c d е ж грамм час я j k л м п о «Фенилэтиламин». HMDB версии 3.6. База данных человеческого метаболома. 11 февраля 2016 г.. Получено 20 сентября 2016.
- ^ а б c Судзуки О, Кацумата Й, Оя М (1981). «Окисление бета-фенилэтиламина обоими типами моноаминоксидазы: исследование ферментов в митохондриях мозга и печени восьми видов». J. Neurochem. 36 (3): 1298–301. Дои:10.1111 / j.1471-4159.1981.tb01734.x. PMID 7205271.
- ^ а б Kaitaniemi, S; Elovaara, H; Grön, K; Кедрон, Н; Liukkonen, J; Салминен, Т; Салми, М; Ялканен, S; Элима, К. (2009). «Уникальная субстратная специфичность AOC2 человека, семикарбазид-чувствительной аминоксидазы». Клетка. Мол. Life Sci. 66 (16): 2743–57. Дои:10.1007 / s00018-009-0076-5. PMID 19588076. S2CID 30090890.
Было обнаружено, что предпочтительными субстратами AOC2 in vitro являются 2-фенилэтиламин, триптамин и п-тирамин вместо метиламина и бензиламина, предпочтительных субстратов AOC3.
- ^ а б Krueger SK, Williams DE; Уильямс (июнь 2005 г.). «Флавинсодержащие монооксигеназы млекопитающих: структура / функция, генетический полиморфизм и роль в метаболизме лекарств». Pharmacol. Ther. 106 (3): 357–387. Дои:10.1016 / j.pharmthera.2005.01.001. ЧВК 1828602. PMID 15922018.
Биогенные амины, фенэтиламин и тирамин, подвергаются N-оксигенации под действием FMO с образованием N-гидрокси-метаболита с последующей быстрой второй оксигенацией для получения трансоксимов (Lin & Cashman, 1997a, 1997b). Эта стереоселективная N-оксигенация трансоксима также наблюдается в FMO-зависимой N-оксигенации амфетамина (Cashman et al., 1999) ... Интересно, что FMO2, который очень эффективно N-оксигенатирует N-додециламин, является плохой катализатор N-оксигенации фенэтиламина. Наиболее эффективным FMO человека в отношении N-оксигенации фенэтиламина является FMO3, основной FMO, присутствующий в печени взрослого человека; Km составляет от 90 до 200 мкМ (Lin & Cashman, 1997b).
- ^ а б Робинсон-Коэн С., Ньюитт Р., Шен Д.Д., Ретти А.Э., Кестенбаум Б.Р., Химмельфарб Дж., Йунг С.К. (август 2016 г.). «Ассоциация вариантов FMO3 и концентрации N-оксида триметиламина, прогрессирования заболевания и смертности у пациентов с ХЗП». PLOS ONE. 11 (8): e0161074. Дои:10.1371 / journal.pone.0161074. ЧВК 4981377. PMID 27513517.
ТМАО образуется из триметиламина (ТМА) через метаболизм печеночной изоформой 3 флавинсодержащей монооксигеназы (FMO3). ... FMO3 катализирует окисление катехоламинов или вазопрессоров, высвобождающих катехоламин, включая тирамин, фенилэтиламин, адреналин и норадреналин [32, 33].
- ^ а б «Фармакология и биохимия». Фенэтиламин. PubChem Compound. Национальная медицинская библиотека США - Национальный центр биотехнологической информации.
Фармакокинетика PEA в плазме может быть описана кинетикой 1-го порядка с расчетным T / 2 примерно 5-10 мин.
- ^ а б c «Химические и физические свойства». Фенэтиламин. PubChem Compound. Национальная медицинская библиотека США - Национальный центр биотехнологической информации.
- ^ а б c Wimalasena K (июль 2011 г.). «Везикулярные переносчики моноаминов: структура-функция, фармакология и медицинская химия». Med Res Rev. 31 (4): 483–519. Дои:10.1002 / med.20187. ЧВК 3019297. PMID 20135628.
Фенилэтиламин (10), амфетамин [AMPH (11 и 12)], метилендиоксиметамфетамин [METH (13)] и N-метил-4-фенилпиридин (15) - все это более сильные ингибиторы VMAT2 ...
- ^ а б c d е Миллер GM (январь 2011 г.). «Возникающая роль следового аминосвязанного рецептора 1 в функциональной регуляции переносчиков моноаминов и дофаминергической активности». J. Neurochem. 116 (2): 164–176. Дои:10.1111 / j.1471-4159.2010.07109.x. ЧВК 3005101. PMID 21073468.
- ^ Сабелли, ХК; Моснаим, AD; Васкес, Эй Джей; Giardina, WJ; Борисон, Р.Л .; Педемонте, Вашингтон (1976). «Биохимическая пластичность синаптической передачи: критический обзор принципа Дейла». Биологическая психиатрия. 11 (4): 481–524. PMID 9160.
- ^ а б Берри, доктор медицины (июль 2004 г.). "Следы аминов центральной нервной системы млекопитающих. Фармакологические амфетамины, физиологические нейромодуляторы". Журнал нейрохимии. 90 (2): 257–71. Дои:10.1111 / j.1471-4159.2004.02501.x. PMID 15228583.
- ^ а б Ян, HY; Нефф, Н.Х. (1973). «Бета-фенилэтиламин: специфический субстрат для моноаминоксидазы типа B головного мозга». Журнал фармакологии и экспериментальной терапии. 187 (2): 365–71. PMID 4748552.
- ^ Смит, Теренс А. (1977). «Фенэтиламин и родственные соединения в растениях». Фитохимия. 16 (1): 9–18. Дои:10.1016/0031-9422(77)83004-5.
- ^ Линнес Т., Хорн С.М., Прюсс Б.М. (2014). «ß-Фенилэтиламин в качестве нового средства для обработки питательных веществ для снижения бактериального заражения, вызываемого Escherichia coli O157: H7 на говяжьем мясе». Мясные науки. 96 (1): 165–71. Дои:10.1016 / j.meatsci.2013.06.030. PMID 23896151.
Лучше всего в этом эксперименте показали себя уксусная кислота (AAA) и ß-фенилэтиламин (PEA). На кусках говяжьего мяса ПЭА снизил количество бактериальных клеток на 90% после инкубации обработанных ПЭА и Кишечная палочка-загрязненные куски мяса при температуре 10 ° C в течение одной недели.
- ^ а б c d е «Фенэтиламин». PubChem Compound. Национальная медицинская библиотека США - Национальный центр биотехнологической информации. Получено 28 декабря 2016.
- ^ О'Нил, М.Дж. (ред.). Индекс Мерк - Энциклопедия химикатов, лекарств и биологических препаратов. 13-е издание, Whitehouse Station, Нью-Джерси: Merck and Co., Inc., 2001., стр. 1296
- ^ Леффлер, Эстер Б .; Спенсер, Хью М .; Бургер, Альфред (1951). «Константы диссоциации адренергических аминов». Журнал Американского химического общества. 73 (6): 2611–3. Дои:10.1021 / ja01150a055.
- ^ Робинсон, Дж. С .; Снайдер, Х. Р. (1955). «β-Фенилэтиламин» (PDF). Органический синтез, собранный объем. 3: 720.
- ^ Нистром, Роберт Ф .; Браун, Велдон Г. (1948). «Восстановление органических соединений алюмогидридом лития. III. Галогениды, хиноны, разные соединения азота1». Журнал Американского химического общества. 70 (11): 3738–40. Дои:10.1021 / ja01191a057. PMID 18102934.
- ^ а б Кришнан, В .; Мутукумаран, А .; Удупа, Х. В. К. (1979). «Электровосстановление цианида бензила на катодах из железа и кобальта». Журнал прикладной электрохимии. 9 (5): 657–659. Дои:10.1007 / BF00610957. S2CID 96102382.
- ^ Гэри А. Моландер; Фабрицио Варгас (18 января 2007 г.). «β-Аминоэтилтрифторбораты: эффективное аминоэтилирование посредством кросс-связывания Сузуки-Мияура». Орг. Латыш. 9 (2): 203–206. Дои:10.1021 / ol062610v. ЧВК 2593899. PMID 17217265.
- ^ а б c Scassellati C, Bonvicini C, Faraone SV, Gennarelli M (октябрь 2012 г.). «Биомаркеры и синдром дефицита внимания / гиперактивности: систематический обзор и метаанализы». Варенье. Акад. Ребенок-подростокc. Психиатрия. 51 (10): 1003–1019.e20. Дои:10.1016 / j.jaac.2012.08.015. PMID 23021477.
Хотя мы не нашли достаточного количества исследований, подходящих для метаанализа ПЭА и СДВГ, три исследования20,57,58 подтвердили, что уровни ПЭА в моче были значительно ниже у пациентов с СДВГ по сравнению с контрольной группой. ... Введение D-амфетамина и метилфенидата привело к заметному увеличению экскреции PEA с мочой,20,60 предполагая, что лечение СДВГ нормализует уровень ПЭА. ... Точно так же уровни биогенных следов аминов ПЭА в моче могут быть биомаркером для диагностики СДВГ,20,57,58 для эффективности лечения,20,60 и связанные с симптомами невнимательности.59 ... Что касается добавок цинка, то в плацебо-контролируемом исследовании сообщалось, что дозы цинка до 30 мг / день были безопасными в течение как минимум 8 недель, но клинический эффект был неоднозначным, за исключением обнаружения оптимального снижения амфетамина на 37%. доза с 30 мг цинка в день.110
- ^ а б c d Сабо А, Биллетт Э, Тернер Дж (2001). «Фенилэтиламин, возможная связь с антидепрессивным действием упражнений?». Br J Sports Med. 35 (5): 342–343. Дои:10.1136 / bjsm.35.5.342. ЧВК 1724404. PMID 11579070.
Средняя 24-часовая концентрация фенилуксусной кислоты в моче увеличилась на 77% после тренировки. ... Эти результаты показывают значительное повышение уровня фенилуксусной кислоты в моче через 24 часа после аэробных упражнений средней и высокой интенсивности. Поскольку фенилуксусная кислота отражает уровни фенилэтиламина3, а последний обладает антидепрессивным действием, антидепрессивный эффект физических упражнений, по-видимому, связан с повышением концентрации фенилэтиламина. Более того, учитывая структурную и фармакологическую аналогию между амфетаминами и фенилэтиламином, можно предположить, что фенилэтиламин играет роль в обычно сообщаемом «бегуном кайфе», который, как считается, связан с активностью церебрального β-эндорфина. Значительное увеличение экскреции фенилуксусной кислоты в этом исследовании означает, что на уровень фенилэтиламина влияют упражнения. ... 30-минутный сеанс аэробных упражнений средней или высокой интенсивности увеличивает уровень фенилуксусной кислоты у здоровых мужчин, регулярно занимающихся физическими упражнениями. Результаты могут быть связаны с антидепрессивным действием физических упражнений.
- ^ а б c d Берри MD (2007). «Возможности следовых аминов и их рецепторов для лечения неврологических и психических заболеваний». Rev Последние клинические испытания. 2 (1): 3–19. CiteSeerX 10.1.1.329.563. Дои:10.2174/157488707779318107. PMID 18473983.
Также было высказано предположение, что антидепрессивный эффект физических упражнений обусловлен повышением ПЭ [151].
- ^ (Берри, 2004)
- ^ Паулос М.А., Тессель Р.Э. (февраль 1982 г.). «Экскреция бета-фенэтиламина повышается у людей после сильного стресса». Наука. 215 (4536): 1127–1129. Дои:10.1126 / science.7063846. PMID 7063846.
Скорость выведения с мочой эндогенного амфетаминоподобного вещества бета-фенэтиламина была заметно повышена у людей в связи с первоначальным опытом прыжков с парашютом. Увеличение было отложено у большинства субъектов и не коррелировало с изменениями pH мочи или экскреции креатинина.
- ^ «2-ФЕНИЛЕТИЛАМИН». Национальная медицинская библиотека США - сеть токсикологических данных. Банк данных по опасным веществам. Получено 20 сентября 2016.
- ^ Эриксон Дж. Д., Шафер М.К., Боннер Т.И., Эйден Л.Э., Вейхе Э. (май 1996 г.). «Отличительные фармакологические свойства и распределение в нейронах и эндокринных клетках двух изоформ везикулярного переносчика моноаминов человека». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 93 (10): 5166–5171. Дои:10.1073 / пнас.93.10.5166. ЧВК 39426. PMID 8643547.
- ^ Offermanns, S; Розенталь, W, ред. (2008). Энциклопедия молекулярной фармакологии (2-е изд.). Берлин: Springer. С. 1219–1222. ISBN 978-3540389163.
- ^ а б c d Гозал Е.А., О'Нил Б.Е., Савчук М.А., Чжу Х., Хальдер М., Чжоу С.К., Хохман С. (2014). «Анатомические и функциональные доказательства следовых аминов как уникальных модуляторов локомоторной функции в спинном мозге млекопитающих». Передние нейронные цепи. 8: 134. Дои:10.3389 / fncir.2014.00134. ЧВК 4224135. PMID 25426030.
Активность TAAR1, по-видимому, подавляет транспорт моноаминов и ограничивает скорость возбуждения дофаминергических и серотонинергических нейронов за счет взаимодействия с пресинаптическими ауторецепторами D2 и 5-HT1A, соответственно (Wolinsky et al., 2007; Lindemann et al., 2008; Xie and Miller, 2008; Xie et al. al., 2008; Bradaia et al., 2009; Revel et al., 2011; Leo et al., 2014). ... Мечение TAAR1 и TAAR4 во всех нейронах оказалось внутриклеточным, что согласуется с ранее опубликованными результатами для TAAR1 (Miller, 2011). Цитоплазматическое расположение лиганда и рецептора (например, тирамина и TAAR1) поддерживает внутриклеточную активацию путей передачи сигнала, как предполагалось ранее (Miller, 2011). ... Кроме того, будучи однажды транспортированными внутриклеточно, они могут действовать на пресинаптические TAARs, изменяя базальную активность (Miller, 2011). ... Как сообщается для TAAR1 в клетках HEK (Bunzow et al., 2001; Miller, 2011), мы наблюдали цитоплазматическое мечение TAAR1 и TAAR4, оба из которых активируются с помощью TAs (Borowsky et al., 2001). Цитоплазматическое расположение лиганда и рецептора (например, тирамина и TAAR1) должно поддерживать внутриклеточную активацию путей передачи сигнала (Miller, 2011). Такая совместная локализация не требует высвобождения из пузырьков и может объяснить, почему TAs, по-видимому, не обнаруживаются там (Berry, 2004; Burchett and Hicks, 2006).
- ^ Дипак Н., Сара Т, Эндрю Х, Даррелл Д.М., Глен Б.Б. (2011). «Следы аминов и их значение в психиатрии и неврологии: краткий обзор». Бюллетень клинической психофармакологии. 21 (1): 73–79. Дои:10.5350 / KPB-BCP201121113.
Интересно, что PEA может также стимулировать высвобождение ацетилхолина за счет активации глутаматергических сигнальных путей (21), а PEA и p-TA, как сообщалось, подавляют опосредованные рецептором GABAB ответы в дофаминергических нейронах (22,23). Хотя сообщалось, что PEA, T и p-TA присутствуют в синаптосомах (препараты нервных окончаний, выделенные во время гомогенизации и центрифугирования ткани мозга) (24), исследования резерпина и нейротоксинов предполагают, что m- и p-TA могут храниться в везикулы, в то время как PEA и T - нет (25–27). ... антидепрессивный эффект физических упражнений, как предполагается, связан с повышением уровня ПЭА (57). l-Депренил (селегилин), селективный ингибитор МАО-В, используется при лечении болезни Паркинсона и вызывает заметное повышение уровней ПЭА в мозге по сравнению с другими аминами (20,58). ... Интересно, что ген декарбоксилазы ароматических аминокислот (AADC), основного фермента, участвующего в синтезе следовых аминов, расположен в той же области хромосомы 7, которая была предложена как локус восприимчивости к СДВГ (50)
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия. 125 (3): 363–375. Дои:10.1016 / j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (май 2005 г.). «Возрождение следовых аминов, вдохновленное новым семейством GPCR». Тенденции в фармакологических науках. 26 (5): 274–281. Дои:10.1016 / j.tips.2005.03.007. PMID 15860375.
- ^ Ван Х, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии. 724: 211–218. Дои:10.1016 / j.ejphar.2013.12.025. PMID 24374199.
- ^ а б Пендлтон, Роберт Дж .; Гесснер, Джордж; Сойер, Джон (1980). «Исследования N-метилтрансфераз легких, фармакологический подход». Архив фармакологии Наунин-Шмидеберг. 313 (3): 263–8. Дои:10.1007 / BF00505743. PMID 7432557. S2CID 1015819.
- ^ «EC 2.3.1.87 - аралкиламин N-ацетилтрансфераза». БРЕНДА. Technische Universität Braunschweig. Июль 2014 г.. Получено 10 ноября 2014.
- ^ «альдегиддегидрогеназа - Homo sapiens». БРЕНДА. Technische Universität Braunschweig. Январь 2015. Получено 13 апреля 2015.
- ^ Сабелли, Гектор К .; Борисон, Ричард Л .; Даймонд, Брюс I .; Havdala, Henri S .; Нарасимхачари, Недатур (1978). «Фенилэтиламин и функция мозга». Биохимическая фармакология. 27 (13): 1707–11. Дои:10.1016/0006-2952(78)90543-9. PMID 361043.