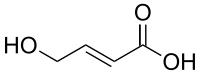
транс -4-гидроксикротоновая кислотаT-HCA ), также известный как γ-гидроксикротоновая кислота (GHC ), является агент используется в научное исследование изучить Рецептор GHB .[1] аналог из γ-гидроксимасляная кислота (GHB), а также активный метаболит GHB.[2] [3] [4] эндогенный крысе Центральная нервная система , и как метаболит GHB, почти наверняка будет эндогенным и для человека.[3] [5] [6] агонист ,[1] [7] ГАМКB рецептор .[3] [8] седация , а вместо этого вызывает судороги , которые считаются вызванными активацией рецептора GHB повышением внеклеточный глутамат концентрации, с одной заметной областью, где это происходит, является гиппокамп .[8]
Смотрите также Рекомендации ^ а б Годфри Танниклифф; Кристофер Д. Кэш (2 сентября 2003 г.). Гамма-гидроксибутират: фармакологические и функциональные аспекты ISBN 978-0-203-30099-2 ^ Куанг Л.С., Десаи М.С., Кранер Дж.С., Шеннон М.В., Вульф А.Д., Махер Т.Дж. (2002). «Антагонисты ферментов и рецепторов для предотвращения токсичности 1,4-бутандиола, предшественника гамма-гидроксимасляной кислоты, у мышей CD-1». Анна. Акад. Наука . 965 (1): 461–72. Bibcode :2002NYASA.965..461Q . Дои :10.1111 / j.1749-6632.2002.tb04187.x . PMID 12105121 . ^ а б c Бургиньон Дж. Дж., Шёнфельдер А., Шмитт М., Вермут К. Г., Гехлер В., Шарлье Б., Мэтр М. (1988). «Аналоги гамма-гидроксимасляной кислоты. Исследования синтеза и связывания». J. Med. Chem . 31 (5): 893–7. Дои :10.1021 / jm00400a001 . PMID 3361576 . ^ Томас Л. Лемке; Дэвид А. Уильямс (24 января 2012 г.). Принципы медицинской химии Фуа ISBN 978-1-60913-345-0 ^ Вайер П., Дессорт Д., Бургиньон Дж. Дж., Вермут К. Г., Мандель П., Мэтр М. (1985). «Естественное появление транс-гамма-гидроксикротоновой кислоты в головном мозге крысы». Biochem. Pharmacol . 34 (13): 2401–4. Дои :10.1016/0006-2952(85)90804-4 . PMID 4015683 . ^ Wellendorph P, Høg S, Greenwood JR, de Lichtenberg A, Nielsen B, Frølund B, Brehm L, Clausen RP, Bräuner-Osborne H (2005). «Новые аналоги циклического гамма-гидроксибутирата (GHB) с высокой аффинностью и стереоселективностью связывания с сайтами GHB в головном мозге крысы» . J. Pharmacol. Exp. Ther . 315 (1): 346–51. Дои :10.1124 / jpet.105.090472 . PMID 16014570 . S2CID 10332754 . ^ Энциклопедия фундаментальных исследований эпилепсии ISBN 978-0-12-373961-2 ^ а б Castelli MP, Ferraro L, Mocci I, Carta F, Carai MA, Antonelli T, Tanganelli S, Cignarella G, Gessa GL (2003). «Селективные лиганды рецепторов гамма-гидроксимасляной кислоты увеличивают внеклеточный глутамат в гиппокампе, но не могут активировать G-белок и произвести седативный / снотворный эффект гамма-гидроксимасляной кислоты». J. Neurochem . 87 (3): 722–32. Дои :10.1046 / j.1471-4159.2003.02037.x . PMID 14535954 .