Глюкуроновая кислота - Википедия - Glucuronic acid
 | |
 | |
| Имена | |
|---|---|
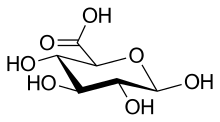
| Название ИЮПАК (2S,3S,4S,5р,6р) -3,4,5,6-Тетрагидроксиоксан-2-карбоновая кислота | |
| Другие имена β-D-Глюкопирануроновая кислота, GlcA | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.026.807 |
| КЕГГ | |
| MeSH | Глюкуроновая кислота + кислота |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C6ЧАС10О7 | |
| Молярная масса | 194.139 г · моль−1 |
| Температура плавления | От 159 до 161 ° C (от 318 до 322 ° F, от 432 до 434 K)[1] |
| Родственные соединения | |
Связанный уроновые кислоты | Аллуроновая кислота, Альтруроновая кислота, Арабинуроновая кислота, Фруктуроновая кислота, Галактуроновая кислота, Гулуроновая кислота, Идуроновая кислота, Ликсуроновая кислота, Маннуроновая кислота, Псикуроновая кислота, Рибуроновая кислота, Рибулуроновая кислота, Сорбуроновая кислота, Тагатуроновая кислота, Талуроновая кислота, Ксилулуроновая кислота, Ксилуроновая кислота |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Глюкуроновая кислота (из Греческий γλυκύς «сладкий» и οὖρον «моча») является уроновая кислота который был впервые изолирован от моча (отсюда и название). Он встречается во многих десны Такие как гуммиарабик (около 18%), ксантан, и Чайный гриб чай и важен для метаболизм микроорганизмов, растений и животных.
Характеристики

Глюкуроновая кислота - это сахарная кислота происходит от глюкоза, с шестым атомом углерода, окисленным до карбоновой кислоты. У живых существ это первичное окисление происходит с UDP-α-D-глюкоза (UDPG), а не со свободным сахаром.
Глюкуроновая кислота, как и ее предшественник глюкоза, может существовать как линейная (карбоксо-)альдогексоза (<1%), или как циклический полуацеталь (фураноза или же пираноза ). Альдогексозы, такие как D-глюкоза способна образовывать две формы фуранозы (α и β) и две формы пиранозы (α и β). Посредством Конвенция Фишера, глюкуроновая кислота имеет два стереоизомера (энантиомеры ), D- и L-глюкуроновая кислота, в зависимости от ее конфигурации на С-5. Большинство физиологических сахаров относятся к D-конфигурация. Из-за замыкания цикла циклические сахара имеют еще один асимметричный атом углерода (C-1), в результате чего образуются еще два стереоизомера, названные аномеры. В зависимости от конфигурации в C-1, существует два аномера глюкуроновой кислоты, α- и β-формы. В β-D-глюкуроновая кислота: гидроксильная группа C-1 находится на той же стороне пиранозного кольца, что и карбоксильная группа. В свободной сахарной кислоте преобладает β-форма (~ 64%), тогда как в организме α-форма UDP-α-D-глюкуроновая кислота (UDPGA) преобладает.
Стереоизомеры углеводов, которые различаются конфигурацией только у одного (другого) асимметричного атома углерода, называются эпимеры. Например, D-маннуроновая (С-2), D-аллуронический (С-3), D-галактуронический (C-4) и L-идуроновая кислота (C-5) - эпимеры глюкуроновой кислоты.
Непланарные пиранозные кольца могут принимать форму кресла (в 2 вариантах) или лодочки. Предпочтительная конформация зависит от пространственной интерференции или других взаимодействий заместителей. Пиранозная форма D-глюкоза и ее производные D-глюкуроновая кислота предпочитает стул 4C1.
Дополнительное окисление по C-1 до уровня карбоксила дает дикарбоксильную группу глюкаровая кислота. Глюкуронолактон самоэфир (лактон ) глюкуроновой кислоты.
Прямое окисление альдозы сначала влияет на альдегидную группу. Лабораторный синтез уроновой кислоты из альдозы требует защиты альдегидных и гидроксильных групп от окисления, например, путем преобразования в циклические ацетали (например, ацетониды ).
Глюкуронат натрия можно получить прямым окислением крахмала концентрированной азотной кислотой. В этом препарате низкая доступность воды удерживает полимеры крахмала от гидролиза и окисляет только свободные гидроксилы, почти так же, как диоксид азота окисляет крахмал. Когда эта реакция завершится и смесь крахмал / азотная кислота станет прозрачной (после выделения газообразного диоксида азота), раствор можно разбавить и гидролизовать другой минеральной кислотой. Затем окисление медленно гасят гидроксидом натрия (или бикарбонатом натрия), образуя глюкуронат натрия, который можно кристаллизовать из раствора. С переходными металлами он образует комплексы, такие как Глюкуронат железа (III), Глюкуронат железа (II),и Глюкуронат меди (II).
Функции
Протеогликаны
Глюкуроновая кислота - это обычный строительный блок протеогликаны и гликоглицеролипиды:
- Гепарин является ингибитором свертывания крови и встречается в тучных клетках легких и печени.
- Сульфат хондроитина В больших количествах содержится в хрящах, аорте, соединительной ткани, костях и коже.
- Дерматансульфат является протеогликаном кожи, сердца и кровеносных сосудов.
- Кератансульфат находится в роговице, хрящах и костях.
- Гиалуроновая кислота В больших количествах встречается в соединительных тканях, коже, хрящах и синовиальной жидкости.
- Гликоглицеролипиды глюкуроновой кислоты или галактуроновые кислоты образуют клеточные стенки бактерий.
Глюкуронизация

UDP-α-D-глюкуроновая кислота (UDPGA) часто участвует в метаболизм II фазы (спряжение ) из липофильный ксено - и эндобиотики. Эти связи включают гликозидные связи с тиоловой, аминогруппой и гидроксигруппами или этерификация с карбоксильной и гидроксильной группами. Этот процесс связывания известен как глюкуронизация (или конъюгация глюкуронида). Глюкуронизация происходит в основном в печени, хотя ферменты, ответственные за ее катализ, UDP-глюкуронилтрансферазы (UDP-GT), были обнаружены во всех основных органах тела, например, в кишечнике, почках, головном мозге, надпочечниках, селезенке и тимусе.[2][3] Аналогичные реакции происходят с другими UDP -уроновые кислоты (например, D-галактуроновая кислота ).
Гликозиды образующиеся в результате глюкуронизации, называются β-D-глюкурониды, его соли и сложные эфиры называются глюкуронатами. Человеческое тело использует глюкуронирование для спирты, фенолы, карбоновые кислоты, меркаптаны, первичные и вторичные алифатические амины, и карбаматы более водорастворимы и, таким образом, позволяет их последующее выведение из организма с мочой или фекалиями (с желчью из печени) со значительно большей скоростью. Карбоксильная группа ионизируется при физиологическом pH, что делает конъюгированное соединение водорастворимым. Соединения с молекулярной массой> 60000 слишком велики для почечной экскреции и выводятся с желчью в кишечник. У новорожденных отсутствует эта система конъюгации, что делает их особенно уязвимыми для таких препаратов, как хлорамфеникол, который инактивируется добавлением глюкуроновой кислоты, что приводит к синдром серого ребенка. Билирубин выводится с желчью в виде билирубин диглюкуронид (80%), билирубин глюкуронид (20%) и неконъюгированный билирубин (<1%). в Синдром Криглера – Наджара и Синдром Жильбера, Активность UDPGT снижена или почти отсутствует из-за мутаций, что приводит к желтуха.
Можно исчерпать запасы глюкуроновой кислоты в организме, комбинируя несколько лекарств / веществ, метаболизм и выведение которых в основном или полностью зависят от глюкуронизации. Хотя у большинства таких веществ есть вторичные метаболические пути, которые становятся заметными после истощения ГКА, скорость метаболизма снижается достаточно, чтобы вызвать заметное накопление всех субстратов ГКА в системе; это часто увеличивает концентрацию лекарства в крови на медицинские значения. Известно, что в наиболее тяжелых случаях происходит необратимое и изнурительное повреждение органов (особенно печени, почек, сердца и мозга) и даже смерть. Этиловый спирт, морфий, парацетамол (ацетаминофен), ингибиторы циклооксигеназы (НПВП ), эндогенный стероиды, и некоторые бензодиазепины все они способны способствовать истощению ГКА, причем этанол и ацетаминофен являются наиболее частыми веществами, участвующими в случаях случайных передозировок, которые положительно связывают с истощением запасов глюкуроновой кислоты.
Чрезмерное количество GCA также может быть опасным для здоровья.[нужна цитата ], табачный дым, большая часть барбитураты, и известно, что некоторые карбаматы фактически стимулируют выработку ГКА. Повышенная активность GCA приводит к снижению концентрации и метаболическому периоду полужизни субстратов глюкуроновой кислоты, в результате чего уровни глюкуронидированных препаратов в плазме крови опускаются ниже их терапевтического порога. Чрезмерная глюкуронизация субстратов может привести к неадекватной реакции на традиционные дозы пораженных лекарств, и, если лекарство не имеет очень широкого терапевтического индекса, обычно приводит к острой неэффективности фармакотерапии и вызывает необходимость перехода одного или нескольких соответствующих лекарств на эквивалентный режим неглюкуронидированных альтернатив. Выбранное количество антидепрессантов и широкий спектр антипсихотических средств являются лигандами глюкуронизации, но из-за их отложенного механизма действия и фармакокинетических свойств снижение их концентрации в плазме может не сразу проявляться и имеет тенденцию проявляться как внезапный и интенсивный рецидив болезни. симптомы вместо постепенной регрессии к поведению и образцам мышления, проявленным пациентом до начала его фармакологического лечения.
Глюкурониды могут быть гидролизованный к β-глюкуронидаза В микрофлоре кишечника присутствует соответствующий агликон, который может реабсорбироваться из кишечника и перемещаться обратно в печень с кровью. Полученный цикл называется энтерогепатическое кровообращение. Соединения, которые подвергаются энтерогепатической циркуляции, выводятся из организма только медленно и обычно имеют более длительный период полураспада в организме.
Некоторые глюкурониды электрофильны и могут действовать в отравление процессы. Известно, что ковалентное связывание агликоновых частей нескольких глюкуронидов (сложных эфиров) карбоновых кислот происходит с нуклеофильными сайтами на сывороточный альбумин через трансацилирование реакции, например.[4]
Фенолы, количественно важный P450 -производные метаболиты ароматических углеводородов, являются субстратами как для UDP-GT, так и для сульфотрансферазы. Глюкурониды преобладают с фенолом или предшественником фенола (бензол ) у млекопитающих, потому что образование сульфатов - это система с высоким сродством и низкой емкостью (из-за истощения сульфатов), тогда как глюкуронизация - это система с низким сродством и высокой емкостью (хотя все еще исчерпываемая).[4]
Роль в болезни
Глюкуроновая кислота, а также глюкуронидированный метаболит этиловый спирт, этилглюкуронид (ETG), действовать толл-подобный рецептор 4 для обострения как острых, так и хронических воспалительных состояний, а также увеличения воспринимаемой тяжести боли у пациентов с хроническими болевыми состояниями за счет повышения регуляции выработки и высвобождения эндогенный воспалительные сигнальные молекулы внутри тела. Долгосрочный агонизм рецептора TLR4 (например, тот, который происходит от GCA, ETG и опиаты ) приводит к тому, что хронически болезненные состояния воспринимаются как значительно более тяжелые, чем они были раньше, в то время как ранее существовавшие терпимые, но иногда болезненные действия могут стать более болезненными, чем раньше, и начнут усугубляться более короткими и менее физически сложными действиями. Он также может вызывать одинаково болезненные реакции на все менее вредные (раздражающие) стимулы, что в конечном итоге приводит к значительной агонии от стимулов, которые не причинят боль большинству людей.[5]
Использовать
Определение стероидов в моче и стероидных конъюгатов в крови. Этилглюкуронид и этилсульфат выводятся с мочой в виде метаболитов этиловый спирт и используются для отслеживания употребления алкоголя или зависимости.
Глюкуроновая кислота и глюконовая кислота являются ферментация продукты в Чайный гриб чай.[6]
Глюкуроновая кислота является предшественником аскорбиновая кислота (Витамин С, ранее называемая L-гексуроновой кислотой). Аскорбат может быть биосинтезирован высшими растениями, водорослями, дрожжами и большинством животных. Взрослая коза вырабатывает ~ 13 г витамина С в день. Эта способность отсутствует у некоторых млекопитающих (включая людей и морских свинок), а также у насекомых, беспозвоночных и большинства рыб. Этим видам требуется внешнее поступление аскорбата, потому что им не хватает биосинтетического фермента. L-гулонолактоноксидаза.[7]
Глюкуронид 4-метилумбеллиферил-β-D-глюкуронид (MUG) используется для проверки наличия кишечная палочка. Кишечная палочка производит фермент β-глюкуронидазу, который гидролизует молекулу MUG до флуоресцентного продукта, который обнаруживается при ультрафиолетовый свет.
Смотрите также
Рекомендации
- ^ D-глюкуроновая кислота в Сигма-Олдрич
- ^ Оно, Шуджи; Накадзин, Шизуо (2008-10-06). «Определение экспрессии мРНК UDP-глюкуронозилтрансфераз человека и применение для локализации в различных тканях человека с помощью цепной реакции обратной транскриптазы-полимеразы в реальном времени». Метаболизм и утилизация лекарств. Американское общество фармакологии и экспериментальной терапии. 37 (1): 32–40. Дои:10.1124 / dmd.108.023598. PMID 18838504. S2CID 5150289. Получено 2010-11-07.
- ^ Бок К., Кёле С. (2005). «UDP-глюкуронозилтрансфераза 1A6: структурные, функциональные и регуляторные аспекты». Методы Энзимол. Методы в энзимологии. 400: 57–75. Дои:10.1016 / S0076-6879 (05) 00004-2. ISBN 9780121828059. PMID 16399343.
- ^ а б Таня К. Маккарти; Кристофер Дж. Синаль (2005), «Биотрансформация», Энциклопедия токсикологии, 1 (2-е изд.), Elsevier, стр. 299–312, ISBN 0-12-745354-7
- ^ Льюис СС, Хатчинсон М.Р., Чжан Ю., Хунд Д.К., Майер С.Ф., Райс К.С., Уоткинс Л.Р. (2013). «Глюкуроновая кислота и метаболит этанола этил-глюкуронид вызывают активацию толл-подобного рецептора 4 и усиление боли». Мозг, поведение и иммунитет. 30: 24–32. Дои:10.1016 / j.bbi.2013.01.005. ЧВК 3641160. PMID 23348028.
- ^ Блан, П.Дж. (февраль 1996 г.). «Характеристика метаболитов чайного гриба». Письма о биотехнологии. 18 (2): 139–142. Дои:10.1007 / BF00128667. S2CID 34822312.
- ^ Герхард Михал; Дитмар Шомбург (2012), Биохимические пути: атлас биохимии и молекулярной биологии (2-е изд.), Wiley, p. 145а, ISBN 978-0-470-14684-2
