Бета-глюкуронидаза - Beta-glucuronidase
| бета-глюкуронидаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.2.1.31 | ||||||||
| Количество CAS | 9001-45-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| глюкуронидаза, бета | |||||||
|---|---|---|---|---|---|---|---|
 Асимметричная единица бета-глюкуронидазы, показывающая остатки активного сайта Glu451, Tyr504 и Glu540 вместе с потенциально поддерживающим остатком Asn450[1] | |||||||
| Идентификаторы | |||||||
| Символ | GUSB | ||||||
| Ген NCBI | 2990 | ||||||
| HGNC | 4696 | ||||||
| OMIM | 611499 | ||||||
| RefSeq | NM_000181 | ||||||
| UniProt | P08236 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 3.2.1.31 | ||||||
| Locus | Chr. 7 q11.21 | ||||||
| |||||||
Бета-глюкуронидазы являются членами гликозидаза семья ферменты который катализировать разрушение комплекса углеводы.[2] Человеческая β-глюкуронидаза представляет собой тип глюкуронидазы (член семейства гликозидаз 2), который катализирует гидролиз β-D-глюкуроновая кислота остатки невосстанавливающего конца мукополисахариды (также называемый гликозаминогликаны ) Такие как гепарансульфат.[2][3][4] Β-глюкуронидаза человека находится в лизосома.[5] В кишечнике β-глюкуронидаза преобразует конъюгированные билирубин в неконъюгированную форму для реабсорбции. Бета-глюкуронидаза также присутствует в грудном молоке, что способствует неонатальная желтуха. Белок кодируется GUSB ген у людей[6][7] и по uidA ген у бактерий.[8]
Структура
Человеческая β-глюкуронидаза синтезируется в виде 80 кДа мономер (653 аминокислоты ) перед протеолиз удаляет 18 аминокислот из C-терминал конец с образованием мономера 78 кДа.[9][10]Бета-глюкуронидаза существует в виде 332 кДа. гомотетрамер.[11] Бета-глюкуронидаза содержит несколько заметных структурных образований, включая тип бета-баррель известный как бочка с желе и ТИМ ствол.[1]
Механизм катализа
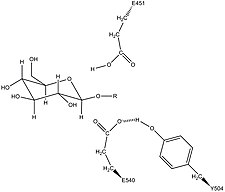
Β-глюкуронидаза человека - это гомологичный к кишечная палочка фермент β-галактозидаза.[12][13] Это гомологичное отношение, наряду со знанием того, что гликозидазы часто проводят гидролиз, катализируемый двумя кислотными остатки, позволил разработать механистическую гипотезу. Эта гипотеза предполагает, что два глютаминовая кислота остатки Glu540 и Glu451 являются нуклеофильный и кислый остатки соответственно, и что тирозин Остаток Tyr504 также участвует в катализе. В поддержку этой гипотезы экспериментальные мутации в любом из этих трех остатков приводит к значительному снижению ферментативной активности. Повышенная активность мутантного фермента E451A (где Glu451 заменен на аланин остаток) после добавления азид соответствует Glu451 как кислотно-щелочной остаток.[14] Использование анализа меченой β-глюкуронидазы пептиды после гидролиза субстрата, который переходит в очень стабильную промежуточную стадию, исследователи определили, что Glu540 является нуклеофильным остатком.[15]
Хотя конкретный тип нуклеофильное замещение используется β-глюкуронидазой, неясно, данные о механизмах их гомологов в семействе гликозидаз предполагают, что эти реакции качественно SN2 реакции. Реакции проходят через переходное состояние с оксокарбений ионные характеристики. Первоначально эти механизмы из-за наличия оксокарбения, характерного для переходного состояния, были предложены как SN1 реакции проходя через дискретный ион оксокарбения средний. Однако более свежие данные показывают, что эти состояния ионов оксокарбения имеют время жизни 10 фемтосекунд - 0,1 наносекунды (аналогично состоянию вибрация связи период). Эти времена жизни слишком короткие, чтобы относить их к промежуточному продукту реакции. Из этих данных следует, что эти реакции при наличии SN1 появление из-за оксокарбение-ионных характеристик их переходных состояний, должно качественно быть SN2 реакции.[2]
Специфическая активность Tyr504 в каталитическом механизме неясна.[14] Путем сравнения со структурными данными гомологичного фермента ксиланаза было высказано предположение, что Tyr504 β-глюкуронидазы может стабилизировать уходящий нуклеофил (Glu540) или модулировать его активность.[16]
В дополнение к этим остаткам консервативный аспарагин остаток (Asn450) был предложен для стабилизации субстрата за счет действия водородной связи на 2-гидроксильной группе сахарного субстрата.[11][17]
Повторяющийся блок гепарансульфата субстрат β-глюкуронидазы

Поверхностное изображение кармана активного центра β-глюкуронидазы с каталитическими остатками.[1]
Механизм гидролиза β-глюкуронидазой сахарного субстрата с высокой энергией переходные состояния с изображением оксокарбениевого иона[15]
Возможная стабилизация нуклеофильного остатка Glu540 с помощью Tyr504 в β-глюкуронидазе[16]
Хитрый синдром
Недостаток β-глюкуронидазы приводит к аутосомно-рецессивный унаследованный нарушение обмена веществ известный как Хитрый синдром или же Мукополисахаридоз VII. Дефицит этого фермента приводит к накоплению негидролизованных мукополисахаридов у пациента. Это заболевание может быть крайне изнурительным для пациента или привести к водянка плода до рождения. Кроме того, у выживших пациентов наблюдаются умственная отсталость, низкий рост, грубые черты лица, аномалии позвоночника, увеличение печени и селезенки.[5] Это заболевание было смоделировано на группе мышей, а также на семье собак.[19][20] Совсем недавно исследователи обнаружили семейство кошачьих, у которых наблюдается дефицит активности β-глюкуронидазы. Источник этого снижения активности был идентифицирован как мутация E351K (Glu351 мутирован до остатка лизина). Glu351 является консервативным у видов млекопитающих, что предполагает важную функцию этого остатка. Обследование человека Рентгеновский кристалл структура предполагает, что этот остаток (Glu352 в человеческом ферменте), который похоронен глубоко внутри ТИМ ствол домен, может быть важным для стабилизации третичная структура фермента.[18] Судя по кристаллической структуре, Arg216, член группы желейный рулет домен белка, образует соляной мост с Glu352; следовательно, Glu352, вероятно, участвует в стабилизации взаимодействия между двумя различными трехмерными доменами фермента.[1]
Молекулярные приложения: использование в качестве репортерного гена
В молекулярная биология, β-глюкуронидаза используется как репортерный ген контролировать экспрессия гена в клетках млекопитающих и растений. Мониторинг активности β-глюкуронидазы с помощью GUS анализ позволяет определить пространственную и временную экспрессию рассматриваемого гена.[21]
- Молекулярные графические изображения были получены с использованием пакета UCSF Chimera из Ресурса для биокомпьютеров, визуализации и информатики Калифорнийского университета в Сан-Франциско (при поддержке NIH P41 RR-01081).[22]
Смотрите также
Рекомендации
- ^ а б c d е ж PDB: 1BHG; Джайн С., Дрендель В.Б., Чен З.В., Мэтьюз Ф.С., Слай В.С., Грабб Дж. Х. (апрель 1996 г.). «Структура человеческой бета-глюкуронидазы выявляет потенциальных лизосомных нацеленных и мотивы активного сайта». Структурная биология природы. 3 (4): 375–81. Дои:10.1038 / nsb0496-375. PMID 8599764. S2CID 28862883.
- ^ а б c Синнотт М., изд. (1998). Комплексный биологический катализ. 1. Манчестер, Великобритания: Academic Press. стр.119–138. ISBN 978-0-12-646864-9.
- ^ Маккартер Дж. Д., Уизерс С. Г. (декабрь 1994 г.). «Механизмы ферментативного гидролиза гликозидов». Текущее мнение в структурной биологии. 4 (6): 885–92. Дои:10.1016 / 0959-440X (94) 90271-2. PMID 7712292.
- ^ Синнотт ML (1990). «Каталитические механизмы ферментативного переноса гликозила». Chem Rev. 90 (7): 1171–1202. Дои:10.1021 / cr00105a006.
- ^ а б Нихан В.Л., Баршоп Б., Озанд П. (2005). Атлас метаболических заболеваний (2-е изд.). Лондон, Великобритания: Ходдер Арнольд. С. 501–503, 546–550. ISBN 978-0-340-80970-9.
- ^ Осима А., Кайл Дж. В., Миллер Р. Д., Хоффманн Дж. В., Пауэлл П. П., Грабб Дж. Х., Слай В. С., Тропак М., Гиз К. С., Гравий Р. А. (февраль 1987 г.). «Клонирование, секвенирование и экспрессия кДНК бета-глюкуронидазы человека». Труды Национальной академии наук Соединенных Штатов Америки. 84 (3): 685–9. Bibcode:1987ПНАС ... 84..685О. Дои:10.1073 / пнас.84.3.685. ЧВК 304280. PMID 3468507.
- ^ «Энтрез Ген: глюкуронидаза GUSB, бета».
- ^ Мартинс М.Т., Ривера И.Г., Кларк Д.Л., Стюарт М.Х., Вулф Р.Л., Олсон Б.Н. (июль 1993 г.). «Распределение последовательностей гена uidA в изолятах Escherichia coli в водных источниках и сравнение с выражением активности бета-глюкуронидазы в среде 4-метилумбеллиферил-бета-D-глюкуронида». Прикладная и экологическая микробиология. 59 (7): 2271–6. Дои:10.1128 / AEM.59.7.2271-2276.1993. ЧВК 182268. PMID 8357258.
- ^ Ислам М.Р., Грабб Дж. Х., Слай В. С. (октябрь 1993 г.). «С-концевой процессинг бета-глюкуронидазы человека. Пропептид необходим для полного выражения каталитической активности, внутриклеточного удерживания и надлежащего фосфорилирования». Журнал биологической химии. 268 (30): 22627–33. PMID 8226771.
- ^ Шипли Дж. М., Грабб Дж. Х., Слай В. С. (июнь 1993 г.). «Роль гликозилирования и фосфорилирования в экспрессии активной бета-глюкуронидазы человека». Журнал биологической химии. 268 (16): 12193–8. PMID 8505339.
- ^ а б c Ким Х.В., Мино К., Исикава К. (декабрь 2008 г.). «Кристаллизация и предварительный рентгеноструктурный анализ эндоглюканазы Pyrococcus horikoshii». Acta Crystallographica. Раздел F, Структурная биология и сообщения о кристаллизации. 64 (Pt 12): 1169–71. Дои:10.1107 / S1744309108036919. ЧВК 2593689. PMID 19052378.
- ^ Henrissat B, Bairoch A (август 1993 г.). «Новые семейства в классификации гликозилгидролаз на основе сходства аминокислотных последовательностей». Биохимический журнал. 293 (Pt 3) (3): 781–8. Дои:10.1042 / bj2930781. ЧВК 1134435. PMID 8352747.
- ^ Henrissat B (декабрь 1991 г.). «Классификация гликозилгидролаз на основе сходства аминокислотных последовательностей». Биохимический журнал. 280 (Pt 2) (2): 309–16. Дои:10.1042 / bj2800309. ЧВК 1130547. PMID 1747104.
- ^ а б Ислам М.Р., Томацу С., Шах Г.Н., Грабб Дж. Х., Джайн С., Слай В.С. (август 1999 г.). «Остатки активного сайта бета-глюкуронидазы человека. Доказательства для Glu (540) в качестве нуклеофила и Glu (451) в качестве кислотно-основного остатка». Журнал биологической химии. 274 (33): 23451–5. Дои:10.1074 / jbc.274.33.23451. PMID 10438523.
- ^ а б Wong AW, He S, Grubb JH, Sly WS, Withers SG (декабрь 1998 г.). «Идентификация Glu-540 как каталитического нуклеофила бета-глюкуронидазы человека с помощью масс-спектрометрии с электрораспылением». Журнал биологической химии. 273 (51): 34057–62. Дои:10.1074 / jbc.273.51.34057. PMID 9852062.
- ^ а б "EzCatDB: T00066". EzCatDB: база данных каталитических механизмов. Архивировано из оригинал на 2009-06-17. Получено 2008-12-12.
- ^ а б Henrissat B, Callebaut I, Fabrega S, Lehn P, Mornon JP, Davies G (июль 1995 г.). «Консервированный каталитический аппарат и прогнозирование общей складки для нескольких семейств гликозилгидролаз». Труды Национальной академии наук Соединенных Штатов Америки. 92 (15): 7090–4. Bibcode:1995PNAS ... 92.7090H. Дои:10.1073 / пнас.92.15.7090. ЧВК 41477. PMID 7624375.
- ^ а б Файф Дж. К., Курцхалс Р. Л., Лассалин М. Е., Хенторн П. С., Алур П. Р., Ван П., Вулф Дж. Х., Гигер Ю., Хаскинс М. Е., Паттерсон Д. Ф., Сан Х., Джейн С., Юки Н. (июнь 1999 г.). «Молекулярная основа недостаточности бета-глюкуронидазы кошек: модель мукополисахаридоза VII на животных». Геномика. 58 (2): 121–8. Дои:10.1006 / geno.1999.5825. PMID 10366443.
- ^ Биркенмайер EH, Дэвиссон МТ, Beamer WG, Ganschow RE, Vogler CA, Gwynn B., Lyford KA, Maltais LM, Wawrzyniak CJ (апрель 1989 г.). «Мукополисахаридоз мышей типа VII. Характеристика мышей с дефицитом бета-глюкуронидазы». Журнал клинических исследований. 83 (4): 1258–66. Дои:10.1172 / JCI114010. ЧВК 303816. PMID 2495302.
- ^ Хаскинс М.Э., Десник Р.Дж., ДиФерранте Н., Джезык П.Ф., Паттерсон Д.Ф. (октябрь 1984 г.). «Дефицит бета-глюкуронидазы у собак: модель мукополисахаридоза человека VII». Педиатрические исследования. 18 (10): 980–4. Дои:10.1203/00006450-198410000-00014. PMID 6436780.
- ^ Марат С.В., МакИвен Дж. Э. (февраль 1995 г.). «Векторы с репортерным геном gus для идентификации и количественного определения промоторных областей в Saccharomyces cerevisiae». Ген. 154 (1): 105–7. Дои:10.1016 / 0378-1119 (94) 00845-J. PMID 7867935.
- ^ Петтерсен Э.Ф., Годдард Т.Д., Хуанг С.К., Коуч Г.С., Гринблатт Д.М., Мэн Э.С., Феррин Т.Э. (октябрь 2004 г.). «UCSF Chimera - система визуализации для поисковых исследований и анализа» (PDF). Журнал вычислительной химии. 25 (13): 1605–12. Дои:10.1002 / jcc.20084. PMID 15264254. S2CID 8747218.
дальнейшее чтение
- Джордж Дж (июнь 2008 г.). «Повышенный уровень бета-глюкуронидазы в сыворотке крови отражает ломкость лизосом печени после токсического поражения печени у крыс». Биохимия и клеточная биология. 86 (3): 235–43. Дои:10.1139 / O08-038. PMID 18523484.
- Bell CE, Sly WS, Brot FE (январь 1977 г.). «Мукополисахаридоз с дефицитом бета-глюкуронидазы человека: определение перекрестно-реактивного антигена в культивируемых фибробластах пациентов с дефицитом иммуноферментного анализа». Журнал клинических исследований. 59 (1): 97–105. Дои:10.1172 / JCI108627. ЧВК 333336. PMID 401508.
- Танака Дж., Гаса С., Сакурада К., Миядзаки Т., Касаи М., Макита А. (январь 1992 г.). «Характеристика субъединиц и сахарного фрагмента человеческой плацентарной и лейкемической бета-глюкуронидазы». Биологическая химия Хоппе-Зейлер. 373 (1): 57–62. Дои:10.1515 / bchm3.1992.373.1.57. PMID 1311180.
- Wolfe JH, Sands MS, Barker JE, Gwynn B, Rowe LB, Vogler CA, Birkenmeier EH (1993). «Обращение патологии при мукополисахаридозе VII типа мышей путем переноса генов соматических клеток». Природа. 360 (6406): 749–53. Дои:10.1038 / 360749a0. PMID 1465145. S2CID 4337590.
- Tomatsu S, Fukuda S, Sukegawa K, Ikedo Y, Yamada S, Yamada Y, Sasaki T, Okamoto H, Kuwahara T, Yamaguchi S (январь 1991 г.). «Мукополисахаридоз VII типа: характеристика мутаций и молекулярной гетерогенности». Американский журнал генетики человека. 48 (1): 89–96. ЧВК 1682743. PMID 1702266.
- Шипли Дж. М., Миллер Р. Д., Ву Б. М., Грабб Дж. Х., Кристенсен С. Г., Кайл Дж. В., Слай В.С. (август 1991 г.). «Анализ 5'-фланкирующей области гена бета-глюкуронидазы человека». Геномика. 10 (4): 1009–18. Дои:10.1016 / 0888-7543 (91) 90192-Н. PMID 1916806.
- Оно М., Танигучи Н., Макита А., Фудзита М., Секия К., Намики М. (апрель 1988 г.). «Фосфорилирование бета-глюкуронидаз из нормальной печени и гепатомы человека с помощью цАМФ-зависимой протеинкиназы». Журнал биологической химии. 263 (12): 5884–9. PMID 2833520.
- Гиз К.С., Корнелюк Р.Г., Уэй Дж., Ламхонва А.М., Куан Ф., Палмер Р., Ганшов Р.Э., Слай В.С., Гравий Р.А. (1985). «Выделение и экспрессия в Escherichia coli клона кДНК, кодирующего бета-глюкуронидазу человека». Ген. 34 (1): 105–10. Дои:10.1016/0378-1119(85)90300-2. PMID 3924735.
- Хо YC, Хо LH, Хо KJ (1985). «Человеческая печеночная бета-глюкуронидаза: исследование кинетики ферментов». Фермент. 33 (1): 9–17. Дои:10.1159/000469398. PMID 3987656.
- Шипли Дж. М., Клинкенберг М., Ву Б. М., Бачинский Д. Р., Грабб Дж. Х., Слай В. С. (март 1993 г.). «Мутационный анализ пациента с мукополисахаридозом VII типа и выявление псевдогенов». Американский журнал генетики человека. 52 (3): 517–26. ЧВК 1682147. PMID 7680524.
- Верворт Р., Лиссенс В., Либаерс I (1994). «Молекулярный анализ пациента с водянкой плода, вызванной дефицитом бета-глюкуронидазы, и доказательства наличия дополнительных псевдогенов». Человеческая мутация. 2 (6): 443–5. Дои:10.1002 / humu.1380020604. PMID 8111412. S2CID 46432543.
- Ву Б.М., Хитрый В.С. (1994). «Мутационные исследования у пациента с формой водянки плода мукополисахаридоза VII типа». Человеческая мутация. 2 (6): 446–57. Дои:10.1002 / humu.1380020605. PMID 8111413. S2CID 21484555.
- Маруяма К., Сугано С. (январь 1994 г.). «Олиго-кэппинг: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Ген. 138 (1–2): 171–4. Дои:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Moullier P, Bohl D, Heard JM, Danos O (июнь 1993 г.). «Коррекция лизосомального накопления в печени и селезенке мышей MPS VII путем имплантации генетически модифицированных фибробластов кожи». Природа Генетика. 4 (2): 154–9. Дои:10.1038 / ng0693-154. PMID 8348154. S2CID 26122567.
- Шипли Дж. М., Грабб Дж. Х., Слай В. С. (июнь 1993 г.). «Роль гликозилирования и фосфорилирования в экспрессии активной бета-глюкуронидазы человека». Журнал биологической химии. 268 (16): 12193–8. PMID 8505339.
- Нисимура Ю., Като К., Химено М. (июль 1995 г.). «Биохимическая характеристика микросомальной печени, Гольджи, лизосомальной бета-глюкуронидазы и сыворотки крови у крыс, получавших дибутилфосфат». Журнал биохимии. 118 (1): 56–66. Дои:10.1093 / oxfordjournals.jbchem.a124892. PMID 8537326.
- Джайн С., Дрендель В. Б., Чен З. В., Мэтьюз Ф. С., Слай В. С., Грабб Дж. Х. (апрель 1996 г.). «Структура человеческой бета-глюкуронидазы выявляет потенциальных лизосомных нацеленных и мотивы активного сайта». Структурная биология природы. 3 (4): 375–81. Дои:10.1038 / nsb0496-375. PMID 8599764. S2CID 28862883.
- Vervoort R, Islam MR, Sly WS, Zabot MT, Kleijer WJ, Chabas A, Fensom A, Young EP, Liebaers I, Lissens W (март 1996). «Молекулярный анализ пациентов с недостаточностью бета-глюкуронидазы, проявляющейся как водянка плода или ранний мукополисахаридоз VII». Американский журнал генетики человека. 58 (3): 457–71. ЧВК 1914559. PMID 8644704.
- Боналдо М.Ф., Леннон Г., Соарес МБ (сентябрь 1996 г.). «Нормализация и вычитание: два подхода для облегчения открытия генов». Геномные исследования. 6 (9): 791–806. Дои:10.1101 / гр.6.9.791. PMID 8889548.
- Дентино А.Р., Радж П.А., Де Нардин Э. (январь 1997 г.). «Тонкие различия между рецепторами нейтрофилов человека и кролика, проявляющиеся в секреторной активности ограниченных формилпептидов». Архивы биохимии и биофизики. 337 (2): 267–74. Дои:10.1006 / abbi.1996.9791. PMID 9016822.
внешняя ссылка
- Глюкуронидаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обновленные исследования репортерной глюкуронидазы и другие репортеры Reportergene
- База данных исследований каталитического механизма и другая информация о бета-глюкуронидазе