Лактаза - Lactase
| Лактаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Тетрамер лактазы, Кишечная палочка | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.2.1.108 | ||||||||
| Количество CAS | 9031-11-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Гликозилцерамидаза (Флоризин гидролаза) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 3.2.1.62 | ||||||||
| Количество CAS | 9033-10-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Лактаза | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | LCT | ||||||
| Альт. символы | LAC; LPH; LPH1 | ||||||
| Ген NCBI | 3938 | ||||||
| HGNC | 6530 | ||||||
| OMIM | 603202 | ||||||
| RefSeq | NM_002299 | ||||||
| UniProt | P09848 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 3.2.1.108 | ||||||
| Locus | Chr. 2 q21 | ||||||
| |||||||
Лактаза является фермент производится многими организмами. Он расположен в кисть границы из тонкий кишечник человека и других млекопитающих. Лактаза необходима для полного переваривания всего молоко; это ломается лактоза, а сахар который придает молоку сладость. При недостатке лактазы человек, потребляющий молочные продукты, может испытывать симптомы непереносимость лактозы.[1] Лактазу можно приобрести в качестве пищевой добавки, и ее добавляют в молоко для производства «безлактозных» молочных продуктов.
Лактаза (также известная как лактаза-флоризингидролаза, или же LPH), часть β-галактозидаза семья ферменты, это гликозид гидролаза участвует в гидролиз из дисахарид лактоза в состав галактоза и глюкоза мономеры. Лактаза присутствует преимущественно в кисть границы мембрана дифференцированных энтероциты подкладка ворсинки из тонкий кишечник.[2] У человека лактаза кодируется LCT. ген.[3][4]
Использует
Использование пищи
Лактаза - это фермент, который некоторые люди не могут вырабатывать в тонком кишечнике.[5] Без него они не могут расщепить естественную лактозу в молоке, что приведет к диарее, газам и вздутию живота при употреблении обычного молока. Технология производства безлактозного молока, мороженого и йогурта была разработана Служба сельскохозяйственных исследований Министерства сельского хозяйства США в 1985 г.[6] Эта технология используется для добавления лактазы в молоко, тем самым гидролизуя лактозу, естественным образом содержащуюся в молоке, делая его слегка сладким, но легко усваиваемым.[7] Без лактазы люди с непереносимостью лактозы передают непереваренную лактозу в толстую кишку.[8] где бактерии расщепляют его, образуя углекислый газ, что приводит к вздутию живота и метеоризму.
Медицинское использование
Добавки с лактазой иногда используются для лечения непереносимости лактозы.[9]
Промышленное использование
Промышленно производимая лактаза может быть извлечена как из дрожжи Такие как Kluyveromyces fragilis и Kluyveromyces lactis и из форм, таких как Aspergillus niger и Aspergillus oryzae.[10] Его основное коммерческое использование в таких добавках, как Lacteeze и Lactaid, состоит в расщеплении лактозы в молоке, чтобы сделать его подходящим для людей с непереносимостью лактозы.[11][12] Тем не менее Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США официально не оценивал эффективность этих продуктов.[13]
Лактаза также используется для скрининга синий белый колонии в несколько сайтов клонирования различных плазмидные векторы в кишечная палочка или другие бактерии.[14]
Механизм
Оптимальная температура для лактазы человека составляет около 37 ° C.[15] и оптимальный pH 6.[2]
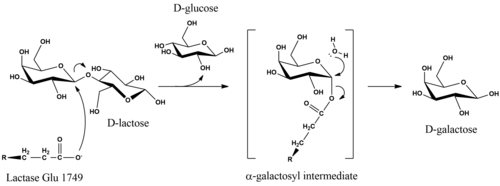
В метаболизм, β-гликозидная связь в D-лактоза гидролизуется с образованием D-галактоза и D-глюкоза, которая может всасываться через стенки кишечника и попадать в кровоток. Общая реакция, которую катализирует лактаза, - это C12ЧАС22О11 + H2О → С6ЧАС12О6 + C6ЧАС12О6 + тепло.
Каталитический механизм D-гидролиз лактозы сохраняет аномерную конфигурацию субстрата в продуктах.[16] Хотя детали механизма неизвестны, стереохимическое сохранение достигается за счет реакции двойного вытеснения. Исследования Кишечная палочка lactase предположили, что гидролиз инициируется, когда глутаматный нуклеофил на фермент атакует с аксиальной стороны галактозильного углерода в β-гликозидной связи.[17] Удаление DУходящей группе -глюкозы может способствовать Mg-зависимый кислотный катализ.[17] Фермент высвобождается из α-галактозильной части при экваториальной нуклеофильной атаке водой, которая производит D-галактоза.[16]
Исследования модификации субстрата показали, что 3'-OH и 2'-OH фрагменты в кольце галактопиранозы важны для ферментативного распознавания и гидролиза.[18] 3'-гидроксигруппа участвует в начальном связывании с субстратом, тогда как 2'-группа не является необходимой для распознавания, но необходима на последующих этапах. Об этом свидетельствует тот факт, что 2-дезокси-аналог является эффективным конкурентным ингибитором (Kя = 10 мМ).[18] Удаление определенных гидроксильных групп на фрагменте глюкопиранозы не устраняет полностью катализ.[18]
Лактаза также катализирует превращение флоризин к флоретин и глюкоза.
Строение и биосинтез
Препролактаза, первичный продукт трансляции, имеет единственную первичную структуру полипептида, состоящую из 1927 аминокислот.[3] Его можно разделить на пять доменов: (i) 19-аминокислотный отщепленный сигнальная последовательность; (ii) большой домен пропоследовательности, которого нет в зрелой лактазе; (iii) зрелый лактазный сегмент; (iv) гидрофобный якорь, охватывающий мембраны; и (v) короткий гидрофильный карбоксильный конец.[3] Сигнальная последовательность расщепляется в эндоплазматический ретикулум, и полученный про-LPH массой 215 кДа отправляется в аппарат Гольджи, где он сильно гликозилирован и протеолитически переработан до зрелой формы.[19] Продомен, как было показано, действует как внутримолекулярный шаперон в ER, предотвращая расщепление трипсином и позволяя LPH принимать необходимую трехмерную структуру для транспортировки в аппарат Гольджи.[20]

Зрелая человеческая лактаза состоит из одной полипептидной цепи массой 160 кДа, которая локализуется на мембране щеточной каймы эпителиальных клеток кишечника. Он ориентирован с N-концом вне клетки и C-концом в цитозоле.[3] LPH содержит два каталитических центра глутаминовой кислоты. В человеческом ферменте активность лактазы связана с Glu-1749, в то время как Glu-1273 является участком функции флоризингидролазы.[21]
Генетическая экспрессия и регуляция
Лактаза кодируется одним генетическим локусом на хромосоме 2.[22] Он экспрессируется исключительно энтероцитами тонкой кишки млекопитающих и в очень низких концентрациях в толстой кишке во время внутриутробного развития.[22] Люди рождаются с высоким уровнем экспрессии лактазы. У большей части населения мира транскрипция лактазы снижается после отлучения от груди, что приводит к снижению экспрессии лактазы в тонком кишечнике,[22] который вызывает общие симптомы гиполактазии взрослого типа или непереносимости лактозы.[23]
Некоторые сегменты населения демонстрируют персистентность лактазы в результате мутации, которая, как предполагается, произошла 5000–10 000 лет назад, что совпало с ростом приручения крупного рогатого скота.[24] Эта мутация позволила почти половине населения мира бессимптомно метаболизировать лактозу. Исследования связали возникновение персистенции лактазы с двумя разными однонуклеотидными полиморфизмами на расстоянии 14 и 22 килобаз перед 5’-концом гена LPH.[25] Обе мутации, C → T в положении -13910 и G → A в положении -22018, были независимо связаны с персистенцией лактазы.[26]
Промотор лактазы имеет длину 150 пар оснований и расположен прямо перед сайтом инициации транскрипции.[26] Последовательность высококонсервативна у млекопитающих, что позволяет предположить, что критические регуляторы цис-транскрипции расположены поблизости.[26] Cdx-2, HNF-1α, и GATA были идентифицированы как факторы транскрипции.[26] Исследования начала гиполактазии показали, что, несмотря на полиморфизм, существует небольшая разница в экспрессии лактазы у младенцев, показывая, что мутации становятся все более актуальными в процессе развития.[27] ДНК-связывающие белки, регулируемые развитием, могут подавлять транскрипцию или дестабилизировать транскрипты мРНК, вызывая снижение экспрессии LPH после отлучения от груди.[27]
Смотрите также
Рекомендации
- ^ Ярвеля I, Торниайнен С., Kolho KL (2009). «Молекулярная генетика лактазной недостаточности человека». Анналы медицины. 41 (8): 568–75. Дои:10.1080/07853890903121033. PMID 19639477. S2CID 205586720.
- ^ а б Сковбьерг Х., Сьёстрём Х., Норен О. (март 1981 г.). «Очистка и характеристика амфифильной лактазы / флоризингидролазы из тонкого кишечника человека». Европейский журнал биохимии / FEBS. 114 (3): 653–61. Дои:10.1111 / j.1432-1033.1981.tb05193.x. PMID 6786877.
- ^ а б c d Mantei N, Villa M, Enzler T., Wacker H, Boll W., James P, Hunziker W., Semenza G (сентябрь 1988 г.). «Полная первичная структура лактазы-флоризингидролазы человека и кролика: значение для биосинтеза, закрепления мембраны и эволюции фермента». Журнал EMBO. 7 (9): 2705–13. Дои:10.1002 / j.1460-2075.1988.tb03124.x. ЧВК 457059. PMID 2460343.
- ^ Харви CB, Fox MF, Jeggo PA, Mantei N, Povey S, Swallow DM (июль 1993 г.). «Региональная локализация гена лактазы-флоризингидролазы, LCT, на хромосоме 2q21». Анналы генетики человека. 57 (Pt 3): 179–85. Дои:10.1111 / j.1469-1809.1993.tb01593.x. PMID 8257087. S2CID 38604778.
- ^ "Непереносимость лактозы". Клиника Майо. Клиника Майо. Получено 13 марта 2018.
- ^ Порч, Кейтлин (2018-04-12). «Молоко без лактозы, сыр с низким содержанием жира и другие достижения в молочной промышленности». www.federallabs.org. Получено 2018-10-26.
- ^ «На вопрос: Как молочные заводы производят молоко без лактозы?». USA Today. 3 сентября 2014 г.. Получено 13 марта 2018.
- ^ «Непереносимость лактозы - симптомы и причины». Клиника Майо. Получено 2020-11-08.
- ^ "Непереносимость лактозы". NIDDK. Июнь 2014 г.. Получено 25 октября 2016.
- ^ Сейис И., Аксоз Н. (2004). «Производство лактазы Trichoderma sp.» (PDF). Food Technol Biotechnol. 42: 121–124.
- ^ «Re: Уведомление GRAS о кислой лактазе из Aspergillus oryzae, экспрессируемой в Aspergillus niger». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
- ^ Холсингер В.Х. (1992). "История Лактаида". Инновационные продукты для пищевой промышленности. Сборник публикаций по развитию сельских районов. С. 256–8.
- ^ Тарантино, LM (2003-12-03). "Ответное письмо агентства, уведомление GRAS № GRN 000132". Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Архивировано из оригинал на 2011-03-26. Получено 2009-09-21.
- ^ "Вступление". Лактаза. Получено 2018-11-16.
- ^ Гермида С., Корралес Г., Каньяда Ф. Дж., Арагон Дж. Дж., Фернандес-Майоралас А. (июль 2007 г.). «Оптимизация ферментативного синтеза бета-D-галактопиранозил-D-ксилоз для их использования в оценке активности лактазы in vivo». Биоорганическая и медицинская химия. 15 (14): 4836–40. Дои:10.1016 / j.bmc.2007.04.067. HDL:10261/81580. PMID 17512743.
- ^ а б Синнотт М (ноябрь 1990 г.). «Каталитические механизмы ферментативного переноса гликозила». Chem. Rev. 90 (7): 1171–1202. Дои:10.1021 / cr00105a006.
- ^ а б Джуэрс Д.Х., Хайтмэн Т.Д., Васелла А., Маккартер Д.Д., Маккензи Л., Уизерс С.Г., Мэтьюз Б.В. (декабрь 2001 г.). «Структурный вид действия бета-галактозидазы Escherichia coli (lacZ)». Биохимия. 40 (49): 14781–94. Дои:10.1021 / bi011727i. PMID 11732897.
- ^ а б c Фернандес П., Каньяда Ф. Дж., Хименес-Барберо Дж., Мартин-Ломас М. (июль 1995 г.). «Субстратная специфичность лактазы тонкого кишечника: исследование стерических эффектов и водородных связей, участвующих во взаимодействии фермент-субстрат». Исследование углеводов. 271 (1): 31–42. Дои:10.1016 / 0008-6215 (95) 00034-Q. PMID 7648581.
- ^ Naim HY, Sterchi EE, Lentze MJ (январь 1987 г.). «Биосинтез и созревание лактазы-флоризингидролазы в эпителиальных клетках тонкой кишки человека». Биохимический журнал. 241 (2): 427–34. Дои:10.1042 / bj2410427. ЧВК 1147578. PMID 3109375.
- ^ Наим Х.Й., Джейкоб Р., Наим Х., Сэмбрук Д.Ф., Гетинг М.Дж. (октябрь 1994 г.). «Про регион кишечной лактазы-флоризингидролазы человека». Журнал биологической химии. 269 (43): 26933–43. PMID 7523415.
- ^ Zecca L, Mesonero JE, Stutz A, Poirée JC, Giudicelli J, Cursio R, Gloor SM, Semenza G (сентябрь 1998 г.). «Кишечная лактаза-флоризингидролаза (LPH): два каталитических сайта; роль поджелудочной железы в созревании про-LPH». Письма FEBS. 435 (2–3): 225–8. Дои:10.1016 / S0014-5793 (98) 01076-X. PMID 9762914. S2CID 33421778.
- ^ а б c Трельсен Дж. Т., Митчелмор С., Сподсберг Н., Йенсен А. М., Норен О., Сьёстрём Н. (март 1997 г.). «Регулирование экспрессии гена лактазы-флоризингидролазы с помощью каудального гомеодоменного белка Cdx-2». Биохимический журнал. 322 (Pt 3) (Pt. 3): 833–8. Дои:10.1042 / bj3220833. ЧВК 1218263. PMID 9148757.
- ^ Справка, Дом генетики. «Ген LCT». Домашний справочник по генетике. Получено 3 апреля 2018.
- ^ Bersaglieri T, Sabeti PC, Patterson N, Vanderploeg T., Schaffner SF, Drake JA, Rhodes M, Reich DE, Hirschhorn JN (июнь 2004 г.). «Генетические признаки сильного недавнего положительного отбора по гену лактазы». Американский журнал генетики человека. 74 (6): 1111–20. Дои:10.1086/421051. ЧВК 1182075. PMID 15114531.
- ^ Куокканен М., Энаттах Н.С., Оксанен А., Савилахти Э., Орпана А., Ярвеля I (май 2003 г.). «Регуляция транскрипции гена лактазы-флоризингидролазы с помощью полиморфизма, связанного с гиполактазией взрослого типа». Кишечник. 52 (5): 647–52. Дои:10.1136 / гут.52.5.647. ЧВК 1773659. PMID 12692047.
- ^ а б c d Troelsen JT (май 2005 г.). «Гиполактазия взрослого типа и регуляция экспрессии лактазы». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1723 (1–3): 19–32. Дои:10.1016 / j.bbagen.2005.02.003. PMID 15777735.
- ^ а б Ван И, Харви С.Б., Холлокс Э.Дж., Филипс А.Д., Поултер М., Клей П., Уолкер-Смит Д.А., Ласточка Д.М. (июнь 1998 г.). «Генетически запрограммированное подавление лактазы у детей». Гастроэнтерология. 114 (6): 1230–6. Дои:10.1016 / S0016-5085 (98) 70429-9. PMID 9609760.
внешняя ссылка
- Белок лактазы
- Кишечная палочка β-галактозидаза: PDB: 1JYY
- Генная онтология лактазы
- Изготовление сильнейшего: есть лактаза? Коэволюция генов и культуры
- Устойчивость лактазы указывает на связь с ожирением
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для бета-галактозидазы человека
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для бета-галактозидазы Escherichia coli
