Глюкоцереброзидаза - Glucocerebrosidase
β-глюкоцереброзидаза (также называемый кислая β-глюкозидаза, D-глюкозил-N-ацилсфингозинглюкогидролаза, или же GCase) является фермент с глюкозилцерамидаза Мероприятия (ЕС 3.2.1.45 ), который необходим для раскола, гидролиз, то бета-глюкозидная связь химического глюкоцереброзид, промежуточное звено в гликолипид обмен веществ в клеточных мембранах (особенно в клетках кожи).[5] Он локализован в лизосома, где он остается связанным с лизосомальной мембраной.[6] β-Глюкоцереброзидаза состоит из 497 аминокислот в длину и имеет молекулярную массу 59,700. Дальтон.
Структура
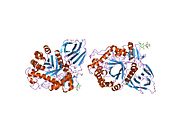
β-Глюкоцереброзидаза входит в состав семейство гликозид гидролаз 30 и состоит из трех отдельных доменов (I-III).[7]

Трехмерная визуализация глюкоцереброзидазы PyMol с выделением трех доменов.

Трехмерная визуализация глюкоцереброзидазы с помощью PyMol с выделенными каталитическими остатками.
Домен I (остатки 1–27 и 383–414) образует трехцепочечный антипараллельный β-лист. Этот домен содержит два дисульфидных мостика, которые необходимы для правильной укладки, а также гликозилированный остаток (Asn19), необходимый для каталитической активности. in vivo. Домен II (остатки 30–75 и 431–497) состоит из двух β-листов, которые напоминают иммуноглобулиновая складка. Домен III (остатки 76–381 и 416–430) гомологичен ТИМ ствол и является высококонсервативным доменом среди гликозидгидролазы.[8] Домен III содержит активный сайт, который связывает субстрат. глюкоцереброзид в непосредственной близости от каталитических остатков E340 и E235. Домены I и III тесно связаны, а домены II и III соединены неупорядоченным линкером.[7]
Механизм
Кристаллические структуры указывают на то, что β-глюкоцереброзидаза связывает глюкоза часть и смежные О-гликозидная связь из глюкоцереброзид. Две алифатические цепи глюкоцереброзида могут оставаться связанными с лизосомным бислоем или взаимодействовать с активирующим белком. Сапозин С.[7]
Как и другие гликозидгидролазы, механизм действия глюкоцереброзида гидролиз β-глюкоцереброзидазой участвует кислотно-щелочной катализ двумя глютаминовая кислота остатков (E340 и E235) и предшествует через двухступенчатый механизм. На первом этапе E340 выполняет нуклеофильная атака на углероде O-гликозидной связи, чтобы вытеснить сфингозин фрагмент, который одновременно протонируется E235, когда он высвобождается из активного сайта. На втором этапе глюкоза гидролизуется из остатка E340 для регенерации активного фермента.[7][9]
Характеристики
β-Глюкоцереброзидаза максимально активна при pH 5,5, pH лизосомного компартмента.[10] Внутри лизосомы GCase остается связанной с мембраной, где она связывает и разрушает свой субстрат. глюкоцереброзид (GluCer). GCase требует активирующий белок Сапозин C, а также отрицательно заряженные липиды для максимальной каталитической активности.[11][12] Роль сапозина С не известна; однако показано, что он связывает как лизосомную мембрану, так и липидные части GluCer, и, следовательно, может рекрутировать GluCer в активный центр фермента.[13][14]
β-Глюкоцереброзидаза является специфическим и необратимо подавленный аналог глюкозы эпоксид Кондуритола B. Эпоксид кондуритола B связывается с активным центром GCase, где фермент расщепляет его эпоксид кольцо, образующее постоянный Ковалентная связь между ферментом и ингибитором.[15]
Первоначально считалось, что GCase - один из немногих лизосомальных ферментов, который не соответствует маннозо-6-фосфатный путь за торговлю лизосома.[16] Исследование в I-клеточная болезнь фибробласты (в которой фосфотрансфераза это ставит Манноза 6-фосфат на белках, чтобы нацелить их на лизосому, является дефектным) показал нацеливание GCase на лизосому независимо от пути M6P.[17] Лизосомный транспортер и интегральный мембранный белок ЛИМП-2 (Lysosomal Integral Membrane Protein 2), как было показано, связывает GCase и облегчает транспорт в лизосомы, демонстрируя механизм M6P-независимого транспорта в лизосомах. Этот вывод был поставлен под сомнение, когда кристаллическая структура GCase в комплексе с ЛИМП-2 показал Манноза 6-фосфат фрагмента на LIMP-2, предполагая, что комплекс также может следовать традиционному маннозо-6-фосфатный путь.[18]
Клиническое значение
Мутации в глюкоцереброзидазе ген причина Болезнь Гоше, а лизосомная болезнь накопления характеризуется накоплением глюкоцереброзидов в макрофагах, которые проникают во многие жизненно важные органы.[19][20]
Мутации в гене глюкоцереброзидазы также связаны с болезнь Паркинсона.[21]
Связанный псевдоген примерно на 12 т.п.н. ниже этого гена на хромосома 1. Альтернативная сварка приводит к множеству вариантов транскрипта, кодирующих один и тот же белок.[22]
Наркотики
Альглюцераза (Цередаза) была версией глюкоцереброзидазы, полученной от человека. плацентарный ткань а затем модифицированы ферментами.[23] Он был одобрен FDA в 1991 г.[24] и был снят с рынка[25][26] из-за одобрения аналогичных препаратов, изготовленных с рекомбинантная ДНК технологии, а не заимствовать их из тканей. Лекарства, полученные рекомбинантно, не представляют риска передачи заболеваний через ткани, используемые при сборе урожая, и менее дороги в производстве.[23]
Рекомбинантные глюкоцереброзидазы, используемые в качестве лекарственных препаратов, включают:[27]
- Имиглюцераза (Церезим)[23]
- Велаглюцераза (Вприв)[23]
- Талиглюцераза альфа (Элелизо)[28]
Смотрите также
- Близкородственные ферменты
Рекомендации
- ^ а б c ENSG00000177628 GRCh38: Ensembl release 89: ENSG00000262446, ENSG00000177628 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000028048 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Vielhaber G, Pfeiffer S, Brade L, Lindner B, Goldmann T, Vollmer E, et al. (Ноябрь 2001 г.). «Локализация церамида и глюкозилцерамида в эпидермисе человека с помощью иммуно-золотой электронной микроскопии». Журнал следственной дерматологии. 117 (5): 1126–36. Дои:10.1046 / j.0022-202x.2001.01527.x. PMID 11710923.
- ^ Rijnboutt S, Aerts HM, Geuze HJ, Tager JM, Strous GJ (март 1991 г.). «Манноза-6-фосфат-независимая мембранная ассоциация катепсина D, глюкоцереброзидазы и белка, активирующего сфинголипид в клетках HepG2». Журнал биологической химии. 266 (8): 4862–8. PMID 1848227.
- ^ а б c d Либерман Р.Л. (2011). «Экскурсия по структурной биологии болезни Гоше: кислота-β-глюкозидаза и сапозин C». Ферментные исследования. 2011: 973231. Дои:10.4061/2011/973231. ЧВК 3226326. PMID 22145077.
- ^ Rigden DJ, Jedrzejas MJ, de Mello LV (июнь 2003 г.). «Идентификация и анализ каталитических бочкообразных доменов TIM в семи дополнительных семействах гликозилгидролаз». Письма FEBS. 544 (1–3): 103–11. Дои:10.1016 / S0014-5793 (03) 00481-2. PMID 12782298.
- ^ Vocadlo DJ, Davies GJ, Laine R, Withers SG (август 2001 г.). «Катализ лизоцимом белка куриного яйца протекает через ковалентный промежуточный продукт» (PDF). Природа. 412 (6849): 835–8. Bibcode:2001Натура.412..835В. Дои:10.1038/35090602. PMID 11518970.
- ^ Синклер Г., Пфайфер Т.А., Грильятти Т.А., Чой Ф.Й. (апрель 2006 г.). «Секреция глюкоцереброзидазы человека из стабильных трансформированных клеток насекомых с использованием нативных сигнальных последовательностей». Биохимия и клеточная биология. 84 (2): 148–56. Дои:10.1139 / o05-165. PMID 16609695.
- ^ Aerts JM, Sa Miranda MC, Brouwer-Kelder EM, Van Weely S, Barranger JA, Tager JM (октябрь 1990 г.). «Условия, влияющие на активность глюкоцереброзидазы, очищенной из селезенок контрольных субъектов и пациентов с болезнью Гоше 1 типа». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1041 (1): 55–63. Дои:10.1016 / 0167-4838 (90) 90122-В. PMID 2223847.
- ^ Вейлер С., Кисимото Ю., О'Брайен Дж. С., Барранджер Дж. А., Томич Дж. М. (апрель 1995 г.). «Идентификация сайтов связывания и активации белка-активатора сфинголипидов, сапозина С, с глюкоцереброзидазой». Белковая наука. 4 (4): 756–64. Дои:10.1002 / pro.5560040415. ЧВК 2143096. PMID 7613473.
- ^ Алаттиа Дж. Р., Шоу Дж. Э., Ип К. М., Привэ Г. Г. (октябрь 2006 г.). «Прямая визуализация сапозинового ремоделирования липидных бислоев». Журнал молекулярной биологии. 362 (5): 943–53. Дои:10.1016 / j.jmb.2006.08.009. PMID 16949605.
- ^ Тамарго Р.Дж., Велаяти А., Голдин Е., Сидранский Е. (июль 2012 г.). «Роль сапозина С в болезни Гоше». Молекулярная генетика и метаболизм. 106 (3): 257–63. Дои:10.1016 / j.ymgme.2012.04.024. ЧВК 3534739. PMID 22652185.
- ^ Огава С., Уэцуки С., Тэдзука Ю., Морикава Т., Такахаши А., Сато К. (июнь 1999 г.). «Синтез и оценка глюкоцереброзидазной ингибирующей активности ангидродезоксиинозитолов из (+) - эпи- и (-) - вибокверцитолов». Письма по биоорганической и медицинской химии. 9 (11): 1493–8. Дои:10.1016 / S0960-894X (99) 00223-1. PMID 10386923.
- ^ Reczek D, Schwake M, Schröder J, Hughes H, Blanz J, Jin X и др. (Ноябрь 2007 г.). «LIMP-2 представляет собой рецептор лизосомального маннозо-6-фосфат-независимого нацеливания бета-глюкоцереброзидазы». Клетка. 131 (4): 770–83. Дои:10.1016 / j.cell.2007.10.018. PMID 18022370.
- ^ Гликман Дж. Н., Корнфельд С. (октябрь 1993 г.). «Маннозо-6-фосфат-независимое нацеливание на лизосомальные ферменты в B-лимфобластах I-клеточной болезни». Журнал клеточной биологии. 123 (1): 99–108. Дои:10.1083 / jcb.123.1.99. ЧВК 2119824. PMID 8408210.
- ^ Чжао Ю., Рен Дж, Падилья-Парра С., Фрай Э., Стюарт Д.И. (июль 2014 г.). «Сортировка лизосом β-глюкоцереброзидазы с помощью LIMP-2 нацелена на рецептор манноза 6-фосфата». Nature Communications. 5: 4321. Bibcode:2014 НатКо ... 5.4321Z. Дои:10.1038 / ncomms5321. ЧВК 4104448. PMID 25027712.
- ^ Муччи Дж. М., Розенфельд П. (2015). «Патогенез костных изменений при болезни Гоше: роль иммунной системы». Журнал иммунологических исследований. 2015: 192761. Дои:10.1155/2015/192761. ЧВК 4433682. PMID 26064996.
- ^ Штирнеманн Дж., Белматуг Н., Каму Ф., Серратрис С., Фруассар Р., Кайо С. и др. (Февраль 2017). "Обзор патофизиологии болезни Гоше, клинических проявлений и методов лечения". Международный журнал молекулярных наук. 18 (2): 441. Дои:10.3390 / ijms18020441. ЧВК 5343975. PMID 28218669.
- ^ Калия Л.В., Ланг А.Е. (август 2015 г.). "Болезнь Паркинсона". Ланцет. 386 (9996): 896–912. Дои:10.1016 / S0140-6736 (14) 61393-3. PMID 25904081.
- ^ «Ген Entrez: GBA глюкозидаза, бета; кислота (включая глюкозилцерамидазу)».
- ^ а б c d Диган ПБ, Кокс TM (2012). «Имиглюцераза в лечении болезни Гоше: история и перспективы». Дизайн, разработка и терапия лекарств. 6: 81–106. Дои:10.2147 / DDDT.S14395. ЧВК 3340106. PMID 22563238.
- ^ «Нормативные вопросы» (PDF). Информация ВОЗ о лекарствах. 5 (3): 123–4. 1991.
- ^ «Ферментозаместительная терапия при лизосомальных нарушениях накопления». Номер бюллетеня по клинической политике: 0442. Aetna. 8 августа 2014 г.
- ^ «Список лекарств, отпускаемых по рецепту и без рецепта FDA» (PDF). Добавления / исключения в списке лекарств, отпускаемых по рецепту. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Март 2012 г.
- ^ Грабовский Г.А. (2012). «Болезнь Гоше и другие нарушения памяти». Гематология. Американское общество гематологии. Образовательная программа. 2012: 13–8. Дои:10.1182 / asheducation.v2012.1.13.3797921. PMID 23233555.
- ^ Юхананов А (1 мая 2012 г.). «FDA США одобряет препарат Pfizer / Protalix для Гоше». Чикаго Трибьюн. Рейтер. Получено 2 мая 2012.[постоянная мертвая ссылка ]
дальнейшее чтение
- Горовиц М., Зимран А. (1994). «Мутации, вызывающие болезнь Гоше». Человеческая мутация. 3 (1): 1–11. Дои:10.1002 / humu.1380030102. PMID 8118460.
- Тайеби Н., Стоун Д.Л., Сидранский Э. (октябрь 1999 г.). «Болезнь Гоше 2 типа: расширяющийся фенотип». Молекулярная генетика и метаболизм (Представлена рукопись). 68 (2): 209–19. Дои:10.1006 / мг.1999.2918. PMID 10527671.
- Stone DL, Tayebi N, Orvisky E, Stubblefield B, Madike V, Sidransky E (2000). «Мутации гена глюкоцереброзидазы у пациентов с болезнью Гоше 2 типа». Человеческая мутация (Представлена рукопись). 15 (2): 181–8. Дои:10.1002 / (SICI) 1098-1004 (200002) 15: 2 <181 :: AID-HUMU7> 3.0.CO; 2-S. PMID 10649495.
- Кайо С., Поэнару Л. (2002). «[Болезни Гоше и Фабри: биохимические и генетические аспекты]». Journal de la Société de Biologie. 196 (2): 135–40. Дои:10.1051 / jbio / 2002196020135. PMID 12360742.
- Фабрега С., Дюран П., Морнон Дж. П., Лен П. (2002). «[Активный центр глюкоцереброзидазы человека: структурные предсказания и экспериментальные подтверждения]». Journal de la Société de Biologie. 196 (2): 151–60. Дои:10.1051 / jbio / 2002196020151. PMID 12360744.
- Альфонсо П., Азнарес С., Гиральт М., Покови М., Хиральдо П. (2007). «Анализ мутаций и взаимосвязь генотипа / фенотипа у пациентов с болезнью Гоше в Испании». Журнал генетики человека. 52 (5): 391–6. Дои:10.1007 / s10038-007-0135-4. PMID 17427031.
внешняя ссылка
- GeneReviews / NCBI / UW / NIH запись о болезни Гоше
- Глюкоцереброзидаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Протеопедия Кислота-бета-глюкозидаза