Гексозаминидаза - Википедия - Hexosaminidase
| β-N-ацетилгексозаминидаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Гексозаминидаза А (Hex A) | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.2.1.52 | ||||||||
| Количество CAS | 9012-33-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Гексозаминидаза (EC 3.2.1.52, бета-ацетиламинодезоксигексозидаза, N-ацетил-бета-D-гексозаминидаза, N-ацетил-бета-гексозаминидаза, N-ацетил гексозаминидаза, бета-гексозаминидаза, бета-ацетилгексозаминидиназа, бета-D-N-ацетилгексозаминидаза, бета-N-ацетил-D-гексозаминидаза, бета-N-ацетилглюкозаминидаза, гексозаминидаза А, N-ацетилгексозаминидаза, бета-D-гексозаминидаза) является фермент участвует в гидролиз концевого N-ацетил-D-гексозамин остатки в N-ацетил-β-D-гексозаминидах.[1][2][3][4]
Изоферменты и гены
Лизосомные изоферменты A, B и S
Функциональный лизосомный Ферменты β-гексозаминидазы имеют димерную структуру. Три изофермента продуцируются комбинацией субъединиц α и β с образованием любого из трех активных димеров:[5]
| гексозаминидаза изофермент | субъединичный состав | функция |
|---|---|---|
| А | α / β гетеродимер | только изофермент, который может гидролизовать GM2 ганглиозид in vivo |
| B | β / β гомодимер | существует в тканях, но физиологическая функция неизвестна |
| S | α / α гомодимер | существует в тканях, но физиологическая функция неизвестна |
Субъединицы α и β кодируются отдельными генами, HEXA и HEXB соответственно. Бета-гексозаминидаза и кофактор граммM2 белок-активатор катализировать деградацию GM2 ганглиозиды и другие молекулы, содержащие концевые N-ацетилгексозамины.[6] Генные мутации в HEXB часто приводит к Болезнь Сандхоффа; в то время как, мутации в HEXA уменьшить гидролиз из GM2 gangliosides, что является основной причиной Болезнь Тея – Сакса.[7]
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Функция
Несмотря на то, что альфа- и бета-субъединицы лизосомальной гексозаминидазы могут расщеплять остатки GalNAc, только альфа-субъединица способна гидролизовать GM2 ганглиозиды из-за ключевого остатка, Arg -424, и петлевой структуры, которая образуется из аминокислотной последовательности в альфа-субъединице. Петля в альфа-субъединице, состоящая из Gly -280, Сер -281, Glu -282, и Pro -283, который отсутствует в бета-субъединице, служит идеальной структурой для связывания GM2 белок-активатор (GM2AP), а аргинин необходим для связывания остатка N-ацетилнейраминовой кислоты GM2 ганглиозиды. GM2 белок-активатор транспорта GM2 gangliosides и представляет липиды в гексозаминидазу, поэтому функциональный фермент гексозаминидаза может гидролизовать GM2 ганглиозиды в GM3 ганглиозидов путем удаления остатка N-ацетилгалактозамина (GalNAc) из GM2 ганглиозиды.[8]
Механизм действия
Комплекс Михаэлиса, состоящий из глутамат остаток, остаток GalNAc на GM2 ганглиозид и аспартат остаток приводит к образованию промежуточного иона оксазолиния. Остаток глутамата (альфа Glu-323 / бета Glu-355) работает как кислота, отдавая свой водород гликозидному атому кислорода на остатке GalNAc. Остаток аспартата (альфа-Asp-322 / бета-Asp-354) позиционирует C2-ацетаминдогруппу так, что она может быть атакована нуклеофилом (атом кислорода N-ацетамидо на углероде 1 субстрата). Остаток аспартата стабилизирует положительный заряд на атоме азота в промежуточном ионе оксазолиния. После образования промежуточного соединения иона оксазолиния вода атакует электрофильный ацетальный углерод. Глутамат действует как основание, депротонируя воду, что приводит к образованию комплекса продукта и GM3ганглиозид.[8]
Генные мутации, приводящие к болезни Тея – Сакса
Существует множество мутаций, которые приводят к дефициту гексозаминидазы, включая делеции генов, бессмысленные мутации и миссенс-мутации. Болезнь Тея – Сакса возникает, когда гексозаминидаза А теряет способность функционировать. Люди с болезнью Тея – Сакса не могут удалить остаток GalNAc из GM2 ганглиозид, и в результате они в конечном итоге накапливают в 100-1000 раз больше GM2 ганглиозидов в головном мозге, чем у нормального человека. Только в детских случаях болезни Тея – Сакса было обнаружено более 100 различных мутаций.[9]
Наиболее частая мутация, которая встречается у более чем 80 процентов пациентов Tay-Sachs, является результатом добавления четырех пар оснований (TATC) в экзоне 11 гена Hex A. Эта вставка приводит к ранней остановке кодон, что вызывает дефицит Hex A.[10]
Дети, рожденные с Тэем-Саксом, обычно умирают в возрасте от двух до четырех лет от устремления и пневмония. Тай-Сакс вызывает церебральную дегенерацию и слепоту. Пациенты также испытывают вялость конечностей и судороги. На данный момент не существует излечения или эффективного лечения болезни Тея – Сакса.[9]
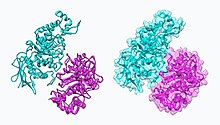
NAG-тиазолин, NGT, действует как основанный на механизме ингибитор гексозаминидазы A. У пациентов с болезнью Тея-Сакса (неправильно свернутая гексозаминидаза A), NGT действует как молекулярный шаперон, связываясь в активном центре гексозаминидазы A, который помогает создать правильно свернутую гексозаминидазу. A. Стабильная димерная конформация гексозаминидазы A имеет способность покидать эндоплазматический ретикулум и направлен на лизосома где он может выполнять деградацию GM2 ганглиозиды.[8] Две субъединицы гексозаминидазы А показаны ниже:


Цитозольные изоферменты C и D
Бифункциональный белок NCOAT (пнеясный cитоплазматический О-GlcNAcase и ацетилтransferase), который кодируется MGEA5 ген обладает как гексозаминидазой, так и гистонацетилтрансфераза виды деятельности.[11] NCOAT также известен как гексозаминидаза C[12] и имеет отличную субстратную специфичность по сравнению с лизосомальной гексозаминидазой А.[13] А однонуклеотидный полиморфизм в человеческом гене O-GlcNAcase связан с сахарный диабет 2 типа.[14]
Четвертый полипептид гексозаминидазы млекопитающих, который был обозначен как гексозаминидаза D (HEXDC) был обнаружен недавно.[15]
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рекомендации
- ^ Кабесас Дж. А. (август 1989 г.). "Некоторые комментарии по ссылкам на типы официальной номенклатуры (IUB) для β-N-ацетилглюкозаминидаза, β-N-ацетилгексозаминидаза и β-N-ацетилгалактозаминидаза ". Biochem. J. 261 (3): 1059–60. Дои:10.1042 / bj2611059b. ЧВК 1138940. PMID 2529847.
- ^ Кальво П., Реглеро А., Кабесас Дж. А. (ноябрь 1978 г.). «Очистка и свойства β-N-ацетилгексозаминидаза из моллюска Helicella ericetorum Мюллер ". Biochem. J. 175 (2): 743–50. Дои:10.1042 / bj1750743. ЧВК 1186125. PMID 33660.
- ^ Frohwein YZ, Gatt S (сентябрь 1967). «Изоляция β-N-ацетилгексозаминидаза, β-N-ацетилглюкозаминидаза и β-N-ацетилгалактозаминидаза из мозга теленка ». Биохимия. 6 (9): 2775–82. Дои:10.1021 / bi00861a018. PMID 6055190.
- ^ Ли С.К., Ли Ю.Т. (октябрь 1970 г.). «Исследования гликозидаз муки из бобов. 3. Кристаллизация и свойства β-N-ацетилгексозаминидаза ». J. Biol. Chem. 245 (19): 5153–60. PMID 5506280.
- ^ Hou Y, Tse R, Mahuran DJ (апрель 1996 г.). «Прямое определение субстратной специфичности альфа-активного сайта в гетеродимерной бета-гексозаминидазе». Биохимия. 35 (13): 3963–9. Дои:10.1021 / bi9524575. PMID 8672428.
- ^ Кнапп С., Вокадло Д., Гао З., Кирк Б., Лу Дж., Уизерс С. Г. (1996). «NAG-тиазолин, ингибитор N-ацетилбета-гексозаминидазы, который предполагает участие ацетамидо». Варенье. Chem. Soc. 118 (28): 6804–6805. Дои:10.1021 / ja960826u.
- ^ Марк Б.Л., Махуран диджей, Черней М.М., Чжао Д., Кнапп С., Джеймс М.Н. (апрель 2003 г.). «Кристаллическая структура человеческой β-гексозаминидазы B: понимание молекулярной основы болезни Сандхоффа и Тея – Сакса». J. Mol. Биол. 327 (5): 1093–109. Дои:10.1016 / S0022-2836 (03) 00216-X. ЧВК 2910754. PMID 12662933.
- ^ а б c d е ж грамм Lemieux MJ, Mark BL, Cherney MM, Withers SG, Mahuran DJ, James MN (июнь 2006 г.). "Кристаллографическая структура человеческой β-гексозаминидазы A: Интерпретация мутаций Тай-Сакса и потери гидролиза ганглиозида GM2". J. Mol. Биол. 359 (4): 913–29. Дои:10.1016 / j.jmb.2006.04.004. ЧВК 2910082. PMID 16698036.
- ^ а б Озанд П.Т., Нихан В.Л., Баршоп Б.А. (2005). «Часть тринадцатая нарушения накопления липидов: болезнь Тея-Сакса / дефицит гексозаминидазы A». Атлас болезней обмена веществ. Лондон: Ходдер Арнольд. С. 539–546. ISBN 0-340-80970-1.
- ^ Boles DJ, Proia RL (март 1995 г.). «Молекулярная основа дефицита мРНК HEXA, вызванного наиболее распространенной мутацией болезни Тея – Сакса». Являюсь. J. Hum. Genet. 56 (3): 716–24. ЧВК 1801160. PMID 7887427.
- ^ Toleman CA, Патерсон AJ, Kudlow JE (февраль 2006 г.). «Гистонацетилтрансфераза NCOAT содержит мотив, похожий на цинковый палец, участвующий в распознавании субстрата». J. Biol. Chem. 281 (7): 3918–25. Дои:10.1074 / jbc.M510485200. PMID 16356930.
- ^ Besley GT, Broadhead DM (апрель 1976 г.). «Исследования человеческой N-ацетил-бета-d-гексозаминидазы C, выделенной из неонатального мозга». Biochem. J. 155 (1): 205–8. Дои:10.1042 / bj1550205. ЧВК 1172820. PMID 945735.
- ^ Гао Й, Уэллс Л., Комер Ф.И., Паркер Г.Дж., Харт Г.В. (март 2001 г.). «Динамическое О-гликозилирование ядерных и цитозольных белков: клонирование и характеристика нейтральной цитозольной бета-N-ацетилглюкозаминидазы из человеческого мозга». J. Biol. Chem. 276 (13): 9838–45. Дои:10.1074 / jbc.M010420200. PMID 11148210.
- ^ Форсайт ME, Любовь DC, Lazarus BD, Kim EJ, Prinz WA, Ashwell G, Krause MW, Hanover JA (август 2006 г.). «Ортолог Caenorhabditis elegans локуса восприимчивости к диабету: нокаут oga-1 (O-GlcNAcase) влияет на цикл, метаболизм и длительность цикла O-GlcNAc». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 103 (32): 11952–7. Дои:10.1073 / pnas.0601931103. ЧВК 1567679. PMID 16882729.
- ^ Гуттерниг М., Рендич Д., Фоглауэр Р., Искратч Т., Уилсон И.Б. (апрель 2009 г.). «Клетки млекопитающих содержат вторую нуклеоцитоплазматическую гексозаминидазу». Biochem. J. 419 (1): 83–90. Дои:10.1042 / BJ20081630. ЧВК 2850170. PMID 19040401.
внешняя ссылка
- GeneReviews / NCBI / NIH / UW запись о дефиците гексозаминидазы A, болезни Тея – Сакса
- гексозаминидаза А в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- EC 3.2.1.52


