CYP17A1 - CYP17A1
| Стероид 17-альфа-гидроксилаза / 17,20 лиаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.14.14.19 | ||||||||
| Количество CAS | 9029-67-8 | ||||||||
| Альт. имена | P450c17, CYP17A1, стероид 17-альфа-гидроксилаза / 17,20 лиаза, CYPXVII, цитохром P450 17A1, цитохром p450 XVIIA1, цитохром P450-C17, цитохром P450, семейство 17, подсемейство A, полипептид 1, стероид 17-альфа цитохром P450c17, 4.1.2.30, 17-альфа-гидроксипрогестерона альдолаза, цитохром P450, подсемейство XVII (стероид 17-альфа-гидроксилаза), стероид 17-альфа-гидроксилаза / 17,20 лиаза, IPR033282 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Цитохром P450 17A1, также называется стероид 17α-монооксигеназа, 17α-гидроксилаза, 17,20-лиаза, или 17,20-десмолаза, является фермент из гидроксилаза тип, который у людей кодируется CYP17A1 ген на хромосома 10.[5] Он повсеместно экспрессируется во многих тканях и типах клеток, включая zona reticularis и зона фасцикулата из кора надпочечников а также гонадный ткани.[6][7] Он обладает как 17α-гидроксилазной, так и 17,20-лиазной активностями и является ключевым ферментом стероидогенного пути, который производит прогестины, минералокортикоиды, глюкокортикоиды, андрогены, и эстрогены. Более конкретно, фермент действует на прегненолон и прогестерон добавить гидроксил (-OH) группа в углеродном положении 17 (C17) стероидного D кольца (активность 17α-гидроксилазы, EC 1.14.14.19 ) или действует на 17α-гидроксипрогестерон и 17α-гидроксипрегненолон чтобы отделить боковую цепь от стероидного ядра (17,20-лиазе Мероприятия, EC 1.14.14.32 ).[7]
Структура
Ген
В CYP17A1 ген находится на хромосоме 10 в полосе 10q24.3 и содержит 8 экзоны.[5] В кДНК этого гена имеет длину 1527 бп.[8] Этот ген кодирует член цитохром P450 надсемейство ферментов. Белки цитохрома P450 обычно считаются монооксигеназы которые катализируют многие реакции, участвующие в метаболизме лекарств и синтезе холестерин, стероиды, и другие липиды, в том числе замечательный разрыв углерод-углеродной связи, катализируемый этим ферментом.
В CYP17A1 ген также может содержать варианты, связанные с повышенным риском ишемическая болезнь сердца.[9][неосновной источник необходим ]
Протеин
CYP17A1 - 57,4 кДа белок, принадлежащий к семейству цитохрома P450.[10][11] Белок, кодируемый его кДНК, состоит из 508 аминокислотные остатки. Как фермент CYP17A1 обладает активный сайт что ассоциируется с гем простетическая группа для катализирования биосинтетических реакций.[8] На основе его известных структур при привязке к двум стероидный ингибиторы, абиратерон и галетерон, CYP17A1 обладает каноническим цитохромом P450, который присутствует в других сложных ферментах P450, которые участвуют в стероидогенез или холестерин метаболизм, хотя он ориентирует стероидные лиганды в направлении спиралей F и G, перпендикулярных гемовой группе, а не листу β1.[12][13]
Выражение
Выражение CYP17A1 был обнаружен во всех традиционных стероидогенный ткани кроме плацента, в том числе zona reticularis и зона фасцикулата из кора надпочечников, то Клетки Лейдига из яички, то текальные клетки из яичники, а совсем недавно в лютеинизированный клетки гранулезы в фолликулы яичников.[14] Помимо классической стероидогенной ткани, CYP17A1 также был обнаружен в сердце, почка, и жировая ткань.[14] в плод, CYP17A1 был зарегистрирован в почках, вилочковая железа, и селезенка.[14]
Функция
CYP17A1 является членом цитохром P450 суперсемейство ферментов, локализованных в эндоплазматический ретикулум. Белки этого семейства представляют собой монооксигеназы, катализирующие синтез холестерин, стероиды и другие липиды и участвуют в метаболизме лекарств.[5] CYP17A1 обладает активностью как 17α-гидроксилазы (EC 1.14.14.19 ) и 17,20-лиазной активности (EC 1.14.14.32 ). 17α-гидроксилазная активность CYP17A1 необходима для образования глюкокортикоиды таких как кортизол, но и гидроксилазная, и 17,20-лиазная активности CYP17A1 необходимы для производства андрогенный и эстрогенный секс-стероиды путем преобразования 17α-гидроксипрегненолон к дегидроэпиандростерон (DHEA).[15] Мутации в этом гене связаны с дефицитом изолированной стероид-17α-гидроксилазы, дефицитом 17α-гидроксилазы / 17,20-лиазы, псевдогермафродитизм, и гиперплазия надпочечников.[5]
Кроме того, активность 17,20-лиазы зависит от цитохрома. P450 оксидоредуктаза (POR) цитохром b5 (CYB5) и фосфорилирование.[16][17][18] Цитохром b5 действует как посредник для 17,20 -лиазной активности CYP17A1 и может отдавать второй электрон некоторым P450. У людей производство тестостерон через прегненолон к 17-OHPreg и DHEA через CYP17A1 требует POR.[19] Белок CYP17A1 человека фосфорилированный на остатки серина и треонина с помощью цАМФ-зависимая протеинкиназа. Фосфорилирование белка увеличивает активность 17,20-лиазы, а дефосфорилирование практически устраняет эту активность.[18]
Клиническое значение
Мутации в этом гене связаны с редкими формами врожденная гиперплазия надпочечников в частности Дефицит 17α-гидроксилазы / дефицит 17,20-лиазы и изолированный дефицит 17,20-лиазы.[20]
У людей ген CYP17A1 в значительной степени связан с эндокринными эффектами и метаболизмом стероидных гормонов.[21][22][23] Кроме того, мутации в гене CYP17A1 связаны с редкими формами врожденная гиперплазия надпочечников, в частности, дефицит 17α-гидроксилазы / дефицит 17,20-лиазы и изолированный дефицит 17,20-лиазы. В целом, CYP17A1 является важной мишенью для ингибирования при лечении рака простаты, поскольку он производит андроген, необходимый для роста опухолевых клеток.[24][25] Снижение активности фермента CYP17A1 связано с бесплодием из-за гипогонадотропного гипогонадизма. У женщин задерживается фолликулогенез, а у мужчин - атрофия яичек с пролиферацией интерстициальных клеток и остановкой сперматогенеза. Хотя в основном ановуляторный, есть несколько сообщений о случаях, когда женщины с дефицитом 17α-гидроксилазы перенесли спонтанную менархе с циклическими менструациями.[26]
Клинический маркер
Мультилокусное исследование генетического риска, основанное на комбинации 27 локусов, включая ген CYP17A1, выявило лиц с повышенным риском как эпизодов, так и рецидивов ИБС, а также усиление клинической пользы от терапии статинами. Исследование было основано на когортном исследовании сообщества (исследование Malmo Diet and Cancer) и четырех дополнительных рандомизированных контролируемых исследованиях когорт первичной профилактики (JUPITER и ASCOT) и когорт вторичной профилактики (CARE и PROVE IT-TIMI 22).[9]
Как мишень для наркотиков
Ингибиторы CYP17A1
В настоящее время,[когда? ] FDA одобрило только один ингибитор CYP17A1, абиратерон, который содержит стероидный каркас, аналогичный эндогенным субстратам CYP17A1. Абиратерон структурно подобен субстратам других ферментов цитохрома P450, участвующих в стероидогенезе, и вмешательство может представлять опасность с точки зрения побочных эффектов. С помощью нестероидный Ожидается, что каркасы позволят создавать соединения, которые более избирательно взаимодействуют с CYP17A1.[25] Мощные ингибиторы фермента CYP17A1 обеспечивают последнюю линию защиты от эктопического андрогенеза при распространенном раке простаты.[27]
Наркотик абиратерона ацетат, который используется для лечения кастрационно-резистентный рак простаты, блокирует биосинтез андрогенов, ингибируя фермент CYP17A1. Абиратерона ацетат связывается в активном центре фермента[28] и координирует гем железо через свой пиридиновый азот, имитируя субстрат.[29]
С 2014 г. галетерон был в фаза III клинические испытания для кастрационно-резистентный рак простаты.[30]
Кетоконазол старше Ингибитор CYP17A1 что сейчас мало используется. Однако кетоконазол конкурентно ингибирует CYP17A1, поэтому его эффективность будет зависеть от концентрации кетоконазола. Это в отличие от абиратерона ацетат, который навсегда (а не конкурентно) отключает CYP17A1, как только он с ним связывается.
Севитеронел (VT-464) - роман Ингибитор CYP17A1 что направлено на избежание одновременного применения глюкокортоидной терапии.[31] В 2010-х годах он прошел различные фазы клинических исследований и доклинических моделей в качестве препарата против рака простаты или рака груди.[32][33][34]
Стероидогенез
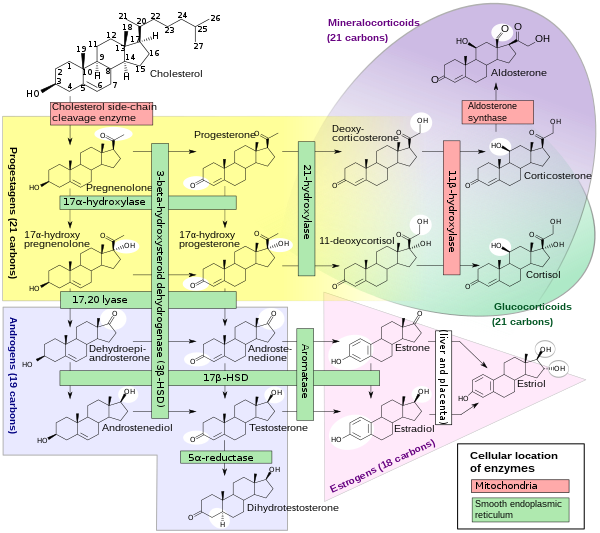 Стероидогенез, где слева показаны обе реакции 17α-гидроксилазы и оба действия 17, 20 лиазы. |
Дополнительные изображения

Нумерация стероидов
Смотрите также
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000148795 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000003555 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б c d "CYP17A1 цитохром P450 семейства 17, член 1 подсемейства A [Homo sapiens (человек)] - Ген - NCBI". www.ncbi.nlm.nih.gov. Получено 2016-09-27.
- ^ «BioGPS - ваша система генного портала». biogps.org. Получено 2016-10-11.
- ^ а б Boulpaep EL; Бор, WF (2005). Медицинская физиология: клеточный и молекулярный подход. Сент-Луис, Миссури: Elsevier Saunders. п. 1180. ISBN 1-4160-2328-3.
- ^ а б Васайтис Т.С., Бруно Р.Д., Ньяр В.К. (май 2011 г.). «Ингибиторы CYP17 для лечения рака простаты». Журнал стероидной биохимии и молекулярной биологии. 125 (1–2): 23–31. Дои:10.1016 / j.jsbmb.2010.11.005. ЧВК 3047603. PMID 21092758.
- ^ а б Mega JL, Stitziel NO, Smith JG, Chasman DI, Caulfield MJ, Devlin JJ, Nordio F, Hyde CL, Cannon CP, Sacks FM, Poulter NR, Sever PS, Ridker PM, Braunwald E, Melander O, Kathiresan S, Sabatine MS (Июнь 2015 г.). «Генетический риск, события ишемической болезни сердца и клиническая польза от терапии статинами: анализ испытаний первичной и вторичной профилактики». Ланцет. 385 (9984): 2264–71. Дои:10.1016 / S0140-6736 (14) 61730-X. ЧВК 4608367. PMID 25748612.
- ^ «CYP17A1 - стероид 17-альфа-гидроксилаза / 17,20 лиаза - Homo sapiens (человек) - ген и белок CYP17A1». www.uniprot.org. Получено 2016-10-11.
- ^ Эстрада Д. Ф., Лоуренс Дж. С., Скотт Э. Э. (февраль 2016 г.). «Взаимодействие цитохрома P450 17A1 с FMN-доменом его редуктазы, как определено с помощью ЯМР». Журнал биологической химии. 291 (8): 3990–4003. Дои:10.1074 / jbc.M115.677294. ЧВК 4759177. PMID 26719338.
- ^ Девор Н. М., Скотт Э. Э. (февраль 2012 г.). «Структуры цитохрома P450 17A1 с препаратами против рака простаты абиратероном и ТОК-001». Природа. 482 (7383): 116–9. Bibcode:2012Натура.482..116D. Дои:10.1038 / природа10743. ЧВК 3271139. PMID 22266943.
- ^ Петрунак Е.М., Деворе Н.М., Порубский П.Р., Скотт Е.Е. (ноябрь 2014 г.). «Структуры человеческого стероидогенного цитохрома P450 17A1 с субстратами». Журнал биологической химии. 289 (47): 32952–64. Дои:10.1074 / jbc.M114.610998. ЧВК 4239641. PMID 25301938.
- ^ а б c Сторбек К.Х., Сварт П., Африкандер Д., Конради Р., Лоу Р., Сварт А.С. (2011). «16α-гидроксипрогестерон: происхождение, биосинтез и рецепторное взаимодействие». Мол. Cell. Эндокринол. 336 (1–2): 92–101. Дои:10.1016 / j.mce.2010.11.016. PMID 21095220. S2CID 5503049.
- ^ Девор Н.М., Скотт Э.Е. (февраль 2012 г.). «Структуры цитохрома P450 17A1 с препаратами против рака простаты абиратероном и ТОК-001». Природа. 482 (7383): 116–9. Bibcode:2012Натура.482..116D. Дои:10.1038 / природа10743. ЧВК 3271139. PMID 22266943.
- ^ Удхане С.С., Дик Б., Ху К., Хартманн Р.В., Панди А.В. (сентябрь 2016 г.). «Специфичность ингибиторов CYP17A1 против рака простаты на биосинтез андрогенов». Сообщения о биохимических и биофизических исследованиях. 477 (4): 1005–10. Дои:10.1016 / j.bbrc.2016.07.019. PMID 27395338.
- ^ Панди А.В., Миллер В.Л. (апрель 2005 г.). «Регулирование активности лиазы 17,20 цитохромом b5 и фосфорилированием серина P450c17». Журнал биологической химии. 280 (14): 13265–71. Дои:10.1074 / jbc.M414673200. PMID 15687493.
- ^ а б Чжан Л.Х., Родригес Х., Оно С., Миллер В.Л. (ноябрь 1995 г.). «Фосфорилирование серина человеческого P450c17 увеличивает активность 17,20-лиазы: последствия для адренархе и синдрома поликистозных яичников». Труды Национальной академии наук Соединенных Штатов Америки. 92 (23): 10619–23. Bibcode:1995PNAS ... 9210619Z. Дои:10.1073 / пнас.92.23.10619. ЧВК 40663. PMID 7479852.
- ^ Фуками М., Хомма К., Хасэгава Т., Огата Т. (апрель 2013 г.). «Бэкдор путь биосинтеза дигидротестостерона: значение для нормального и ненормального полового развития человека». Динамика развития. 242 (4): 320–9. Дои:10.1002 / dvdy.23892. PMID 23073980. S2CID 44702659.
- ^ «Ген Entrez: цитохром P450 CYP17A1, семейство 17, подсемейство A, полипептид 1».
- ^ Ма YN, Цао CY, Ван QW, Гуй WJ, Чжу GN (октябрь 2016 г.). «Влияние азоциклотина на транскрипцию генов и стероидный метаболом оси гипоталамус-гипофиз-гонады, и их последствия для воспроизводства у рыбок данио (Danio rerio)». Водная токсикология. 179: 55–64. Дои:10.1016 / j.aquatox.2016.08.006. PMID 27571716.
- ^ Лежандр А., Эли С., Рамамбасон С., Маненс Л., Суиди М., Фромент П., Тэк К. (август 2016 г.). «Эндокринные эффекты пожизненного воздействия низких доз обедненного урана на функции яичек у взрослых крыс». Токсикология. 368-369: 58–68. Дои:10.1016 / j.tox.2016.08.014. PMID 27544493.
- ^ Ядав Р., Петрунак Е.М., Эстрада Д.Ф., Скотт Е.Е. (август 2016 г.). «Структурные представления о функции стероидогенного цитохрома P450 17A1». Молекулярная и клеточная эндокринология. 441: 68–75. Дои:10.1016 / j.mce.2016.08.035. ЧВК 5235955. PMID 27566228.
- ^ Костин В.А., Золотцев В.А., Кузиков А.В., Масамрех Р.А., Шумянцева В.В., Веселовский А.В., Стулов С.В., Новиков Р.А., Тимофеев В.П., Мишарин А.Ю. (ноябрь 2016 г.). «Оксазолинильные производные [17 (20) E] -21-норпрегнена, различающиеся структурой колец A и B. Легкий синтез и ингибирование каталитической активности CYP17A1». Стероиды. 115: 114–122. Дои:10.1016 / j.steroids.2016.06.002. PMID 27505042. S2CID 205256638.
- ^ а б Бономо С., Хансен С.Х., Петрунак Е.М., Скотт Е.Е., Стирисхейв Б., Йоргенсен Ф.С., Олсен Л. (01.01.2016). "Перспективные инструменты исследования рака простаты: селективные нестероидные ингибиторы цитохрома P450 17A1". Научные отчеты. 6: 29468. Bibcode:2016НатСР ... 629468Б. Дои:10.1038 / srep29468. ЧВК 4942611. PMID 27406023.
- ^ Acién P, Acién M (ноябрь 2020 г.). «Нарушения полового развития: классификация, обзор и влияние на фертильность». Журнал клинической медицины. 9 (11). Дои:10.3390 / jcm9113555. PMID 33158283.
- ^ Bordeau BM, Ciulla DA, Callahan BP (сентябрь 2016 г.). «Белки ежа потребляют стероидные антагонисты CYP17A1: потенциальное терапевтическое значение при запущенном раке простаты». ChemMedChem. 11 (18): 1983–6. Дои:10.1002 / cmdc.201600238. ЧВК 5588864. PMID 27435344.
- ^ Фернандес-Кансио, Моника; Каматс, Нурия; Flück, Christa E .; Залевски, Адам; Дик, Бернхард; Frey, Brigitte M .; Монне, Ракель; Торан, Нурия; Ауди, Лаура (2018-04-29). «Механизм двойной активности человеческого CYP17A1 и связывания с лекарственным средством против рака простаты абиратероном, обнаруженный новой мутацией V366M, вызывающей дефицит лиазы 17,20». Фармацевтические препараты. 11 (2): 37. Дои:10.3390 / ph11020037. ЧВК 6027421. PMID 29710837.
- ^ PDB: 3рук; Девор Н.М., Скотт Э.Е. (февраль 2012 г.). «Структуры цитохрома P450 17A1 с препаратами против рака простаты абиратероном и ТОК-001». Природа. 482 (7383): 116–9. Bibcode:2012Натура.482..116D. Дои:10.1038 / природа10743. ЧВК 3271139. PMID 22266943.
- ^ «Реформулированный галетерон Tokai Pharmaceuticals демонстрирует устойчивое снижение уровня ПСА у пациентов с прогрессирующим раком простаты» (Пресс-релиз). Tokai Pharmaceuticals. 29 января 2014 г.
- ^ Bird IM, Abbott DH (октябрь 2016 г.). «Охота на селективный ингибитор лиазы 17,20; уроки природы». Журнал стероидной биохимии и молекулярной биологии. 163: 136–46. Дои:10.1016 / j.jsbmb.2016.04.021. ЧВК 5046225. PMID 27154414.
VT464 - еще одно недавно разработанное соединение, которое, как предполагается, действует как селективный ингибитор лиазы, и более полные данные доступны в открытом доступе, чтобы поддержать это утверждение. Обзор опубликованных предварительных данных показывает, что IC50 для активности лиазы CYP17 человека в десять раз ниже, чем для гидроксилазы 15, и у нечеловеческих приматов VT464 был способен подавлять циркулирующий тестостерон так же эффективно, как абиратерон, но с минимально сниженным уровнем кортизола (оставаясь на уровне 82% по сравнению с контролем. до 9% с абератероном) и без сопутствующего увеличения содержания прегненолона, прогестерона и минералокортикоидов, которое в противном случае наблюдалось с абиратероном. Как и галатерон, VT464 также используется в клинических испытаниях без одновременного приема преднизона. Вместе с явным отсутствием подавления циркулирующего кортизола у нечеловеческих приматов эти данные доказывают, что VT464 действительно может быть селективным ингибитором лиазы 17,20.
- ^ Шарма В.Р., Шарма Д.К., Навнит М, Анил К.С., Батра Н. (2010). «Новые и потенциальные методы лечения рака груди: новости для онкологов». Рак молочной железы. 2. Дои:10.2147 / ECTTS71781.
- ^ Мадан Р.А., Шмидт К.Т., Карзай Ф., Пир С.Дж., Кордес Л.М., Чау С.М., Штайнберг С.М., Оуэнс Х., Эйснер Дж., Мур В.Р., Дахут В.Л., Галли Дж.Л., Фигг В.Д. (август 2020 г.). «Фаза 2 исследования севитеронела (INO-464) у пациентов с метастатическим устойчивым к кастрации раком простаты после лечения энзалутамидом». Клинический рак мочеполовой системы. 18 (4): 258–267.e1. Дои:10.1016 / j.clgc.2019.11.002. PMID 32327394.
- ^ Peer CJ, Schmidt KT, Kindrick JD, Eisner JR, Brown VV, Baskin-Bey E, Madan R, Figg WD (октябрь 2019 г.). «Популяционный фармакокинетический анализ перорального ингибитора лиазы CYP17 и андрогенных рецепторов севитеронела у пациентов с прогрессирующим / метастатическим устойчивым к кастрации раком простаты или раком груди». Химиотерапия и фармакология рака. 84 (4): 759–770. Дои:10.1007 / s00280-019-03908-0. PMID 31367790.
дальнейшее чтение
- Миура К., Ясуда К., Янасэ Т., Ямакита Н., Сасано Х., Навата Х., Иноуэ М., Фукая Т., Шизута Ю. (октябрь 1996 г.). «Мутация гена цитохрома P-45017 альфа (CYP17) у японского пациента, о котором ранее сообщалось о гиперальдостеронизме, чувствительном к глюкокортикоидам: с обзором японских пациентов с мутациями CYP17». Журнал клинической эндокринологии и метаболизма. 81 (10): 3797–801. Дои:10.1210 / jcem.81.10.8855840. PMID 8855840.
- Миллер WL, Геллер DH, Auchus RJ (1999). «Молекулярные основы изолированного дефицита 17,20 лиазы». Эндокринные исследования. 24 (3–4): 817–25. Дои:10.3109/07435809809032692. PMID 9888582.
- Штраус Дж. Ф. (ноябрь 2003 г.). «Некоторые новые мысли о патофизиологии и генетике синдрома поликистозных яичников». Летопись Нью-Йоркской академии наук. 997 (1): 42–8. Bibcode:2003НЯСА.997 ... 42С. Дои:10.1196 / Анналы.1290.005. PMID 14644808. S2CID 23559461.
- Хайдер С.М., Патель Дж. С., Пуджари С. С., Нейдл С. (июль 2010 г.). «Молекулярное моделирование комплексов ингибиторов и динамики активных центров цитохрома P450 C17, мишени для терапии рака простаты». Журнал молекулярной биологии. 400 (5): 1078–98. Дои:10.1016 / j.jmb.2010.05.069. PMID 20595043.
внешние ссылки
- CYP17A1 + белок, + человеческий в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Человек CYP17A1 расположение генома и CYP17A1 страница сведений о генах в Браузер генома UCSC.