Ароматическая O-деметилаза цитохрома P450 - Cytochrome P450 aromatic O-demethylase
| Ароматическая O-деметилаза, субъединица цитохрома P450 | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | gcoA | ||||||
| PDB | 5NCB | ||||||
| UniProt | P0DPQ7 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 1.14.14.- | ||||||
| |||||||
| Ароматическая O-деметилаза, субъединица редуктазы | |||||||
|---|---|---|---|---|---|---|---|
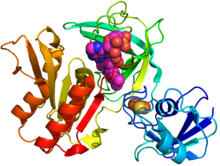 Кристаллическая структура gcoB (мультипликационная диаграмма) в комплексе с FAD (пурпурные сферы) и железо-серный кластер (оранжевый / желтый) на основе PDB: 5OGX.[1] | |||||||
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | gcoB | ||||||
| PDB | 5OGX | ||||||
| UniProt | P0DPQ8 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 1.6.2.- | ||||||
| |||||||
Ароматическая O-деметилаза цитохрома P450 это бактериальный фермент который катализирует деметилирование лигнин и различные лигнолы. Суммарная реакция следует следующей стехиометрии, проиллюстрированной на стандартном метоксиарене:[1]
- ArOCH3 + O2 + 2 е− + 2 ЧАС+ → ArOH + CH2O + H2О
Фермент примечателен своей неразборчивостью, он влияет на O-деметилирование ряда субстратов, включая лигнин.
Это гетеродимерный белок, полученный из продуктов двух генов. Составляющие белки представляют собой цитохром P450 фермент (кодируется геном gcoA из семейства CYP255A) и трехдоменный редуктаза (кодируется геном gcoB) в комплексе с тремя кофакторы (2Fe-2S, FAD, и НАДН ).[1]

Механизм
GcoA и GcoB образуют димерный комплекс в растворе. GcoA обрабатывает субстрат, в то время как GcoB предоставляет электроны для поддержки оксидазы со смешанными функциями. Как и в случае других P450, монооксигенация субстрата происходит одновременно с уменьшением половины эквивалента O2 к воде. An механизм отскока кислорода можно предположить. GcoA позиционирует ароматическое кольцо в полости гидрофобного активного центра, где расположен гем.[2][3]

Структура
GcoA имеет типичную структуру P450: гем, связанный с тиолатом, рядом со скрытым активным центром. Однако GcoB необычен. Цитохром P450 обычно дополняется либо редуктазой цитохрома P450.[4] или ферредоксин и ферредоксинредуктаза; его электроны переносятся НАД + или же НАДФ +. Однако GcoB имеет единственный полипептид. Этот полипептид имеет N-концевой ферредоксин как с NAD (P) +, так и с FAD область связывания.

CcoA и GcoB тесно связаны между собой, действуя в растворе как гетеродимер. На поверхности GcoB есть кислотный участок, который должен взаимодействовать с соответствующей основной областью в GcoA. Предполагается, что часть GcoB, взаимодействующая с GcoA, находится на пересечении между доменом связывания FAD и доменом ферредоксина. Для достижения этой цели GcoB должен пройти через некоторые структурные изменения, которые будут представлять новый класс систем P450 (семейство N).[5][6][7]
Возможные приложения
Ароматическая O-деметилаза цитохрома P450 способствует частичному O-деметилированию лигнина. Полученные 1,2-диолы хорошо подходят для окислительной деградации посредством интра- и экстрадиолдиоксигеназ. Таким образом, O-деметилированные лигнины потенциально подвержены частичной деполимеризации.[8] С меньшим количеством сшивок модифицированный лиганд потенциально более полезен, чем предшественник.[9] начиная от топлива[10][11]
Рекомендации
- ^ а б c d Маллинсон С.Дж., Мачовина М.М., Сильвейра Р.Л., Гарсия-Боррас М., Гэллап Н., Джонсон К.В. и др. (Июнь 2018). «Беспорядочная ароматическая O-деметилаза цитохрома P450 для биоконверсии лигнина». Nature Communications. 9 (1): 2487. Bibcode:2018НатКо ... 9,2487 млн. Дои:10.1038 / s41467-018-04878-2. ЧВК 6021390. PMID 29950589.
- ^ Vaillancourt FH, Bolin JT, Eltis LD (2006). «Плюсы и минусы расщепляющих кольцо диоксигеназ». Критические обзоры в биохимии и молекулярной биологии. 41 (4): 241–67. Дои:10.1080/10409230600817422. PMID 16849108. S2CID 24145324.
- ^ Хуанг В.К., Эллис Дж., Moody PC, Raven EL, Roberts GC (сентябрь 2013 г.). «Редокс-связанные домены в каталитическом цикле цитохром p450 редуктазы». Структура. 21 (9): 1581–9. Дои:10.1016 / j.str.2013.06.022. ЧВК 3763376. PMID 23911089.
- ^ Ван М., Робертс Д.Л., Пашке Р., Ши Т.М., Мастерс Б.С., Ким Дж.Дж. (август 1997 г.). «Трехмерная структура НАДФН-цитохром Р450 редуктазы: прототип FMN- и FAD-содержащих ферментов». Труды Национальной академии наук Соединенных Штатов Америки. 94 (16): 8411–6. Bibcode:1997PNAS ... 94.8411W. Дои:10.1073 / пнас.94.16.8411. ЧВК 22938. PMID 9237990.
- ^ Севрюкова И.Ф., Ли Х., Чжан Х., Петерсон Дж. А., Поулос Т.Л. (март 1999 г.). «Структура комплекса электронного переноса цитохрома Р450-окислительно-восстановительного партнера». Труды Национальной академии наук Соединенных Штатов Америки. 96 (5): 1863–8. Bibcode:1999PNAS ... 96.1863S. Дои:10.1073 / пнас.96.5.1863. ЧВК 26702. PMID 10051560.
- ^ Трипати С., Ли Х, Поулос Т.Л. (июнь 2013 г.). «Структурная основа для эффекторного контроля и распознавания окислительно-восстановительного партнера в цитохроме P450». Наука. 340 (6137): 1227–30. Bibcode:2013Научный ... 340.1227Т. Дои:10.1126 / science.1235797. PMID 23744947. S2CID 23421892.
- ^ Hasemann CA, Kurumbail RG, Boddupalli SS, Peterson JA, Deisenhofer J (январь 1995 г.). «Структура и функция цитохромов P450: сравнительный анализ трех кристаллических структур». Структура. 3 (1): 41–62. Дои:10.1016 / s0969-2126 (01) 00134-4. PMID 7743131.
- ^ Багг Т.Д., Рахманпур Р. (декабрь 2015 г.). «Ферментативное превращение лигнина в возобновляемые химические вещества». Современное мнение в области химической биологии. 29: 10–7. Дои:10.1016 / j.cbpa.2015.06.009. PMID 26121945.
- ^ Beckham GT, Johnson CW, Karp EM, Salvachúa D, Vardon DR (декабрь 2016 г.). «Возможности и проблемы в области биологической валоризации лигнина». Текущее мнение в области биотехнологии. 42: 40–53. Дои:10.1016 / j.copbio.2016.02.030. PMID 26974563.
- ^ Vardon DR, Franden MA, Johnson CW, Karp EM, Guarnieri MT, Linger JG и др. (2015). «Производство адипиновой кислоты из лигнина». Энергетика и экология. 8 (2): 617–628. Дои:10.1039 / c4ee03230f. ISSN 1754-5692.
- ^ Lin L, Cheng Y, Pu Y, Sun S, Li X, Jin M и др. (2016). «Биодизайн консолидированной конверсии лигнина на основе системной биологии». Зеленая химия. 18 (20): 5536–5547. Дои:10.1039 / c6gc01131d. ISSN 1463-9262. OSTI 1326560.
