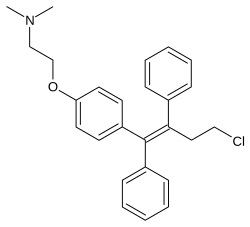
Торемифен - Toremifene
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | /ˈтɔːrəмɪжяп/ |
| Торговые наименования | Фарестон, другие |
| Другие имена | (Z) -Торемифен; 4-хлоротамоксифен; 4-КТ; Акаподен; CCRIS-8745; FC-1157; FC-1157a; GTx-006; НК-622; NSC-613680 |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a608003 |
| Данные лицензии | |
| Маршруты администрация | Устно |
| Класс препарата | Селективный модулятор рецепторов эстрогена |
| Код УВД | |
| Фармакокинетический данные | |
| Биодоступность | Хорошо[1] |
| Связывание с белками | >99%[1] |
| Метаболизм | Печень (CYP3A4 )[4][1] |
| Метаболиты | N-дезметилторемифен; 4-гидрокситоремифен; Оспемифен[2][3] |
| Устранение период полураспада | Торемифен: 5–6 дней[2][1] Метаболиты: 4–21 день.[1][3] |
| Экскреция | Кал: 70% (в виде метаболитов)[1] |
| Идентификаторы | |
| |
| Количество CAS |
|
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Лиганд PDB | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.125.139 |
| Химические и физические данные | |
| Формула | C26ЧАС28ClNО |
| Молярная масса | 405.97 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| (проверять) | |
Торемифен, продается под торговой маркой Фарестон среди прочего, это лекарство, которое используется для лечения распространенный рак груди в постменопаузальный женщины.[3][5][2] Принято устно.[3]
Побочные эффекты из торемифена включают приливы, потливость, тошнота, рвота, головокружение, выделения из влагалища, и вагинальное кровотечение.[4][6] Это также может вызвать сгустки крови, аритмия, катаракта, визуальные нарушения, повышенные ферменты печени, гиперплазия эндометрия, и рак эндометрия.[4] Высокий уровень кальция в крови может возникнуть у женщин с костные метастазы.[4]
Лекарство - это селективный модулятор рецептора эстрогена (SERM) и, следовательно, является смешанным агонист –антагонист из рецептор эстрогена (ER), биологическая мишень из эстрогены подобно эстрадиол.[4][6] Она имеет эстрогенный эффекты в кость, то печень, а матка и антиэстрогенный эффекты в грудь.[5][7][8][4] Это трифенилэтилен производная и тесно связан с тамоксифен.[9]
Торемифен был представлен для медицинского применения в 1997 году.[10][11] Это был первый антиэстроген будет введен с тамоксифена в 1978 году.[12] Он доступен как дженерик в Соединенные Штаты.[13]
Медицинское использование
Торемифен одобрен для лечения метастатический рак груди у женщин в постменопаузе с рецептор эстрогена положительный или неизвестный статус опухоли.[3][5] Это единственное разрешенное использование в Соединенные Штаты.[3] Он показывает эффективность, эквивалентную тамоксифену по этому показанию.[5][14] Было обнаружено, что торемифен эффективен при лечении: боль в груди и может быть более эффективным лекарством, чем тамоксифен, при этом показании.[15] Он также оказывает превосходное воздействие на минеральная плотность костей и липидный профиль, включая уровни холестерин и триглицериды по сравнению с тамоксифеном.[14] Сообщалось, что торемифен значительно улучшает симптомы гинекомастия у мужчин.[16]
Доступные формы
Торемифен выпускается в форме 60 мг. устный таблетки.[17][18]
Побочные эффекты
В побочные эффекты торемифена аналогичны тамоксифену.[4] Наиболее частый побочный эффект: приливы.[4] Другие побочные эффекты включают: потливость, тошнота, рвота, головокружение, выделения из влагалища, и вагинальное кровотечение.[4][6] У женщин с костные метастазы, гиперкальциемия может возникнуть.[4] Торемифен имеет небольшой риск тромбоэмболические события.[4] Катаракты, видение меняется, и повышение ферментов печени не поступало.[4][6] Наркотик удлиняет интервал QT и, следовательно, имеет риск смертельного исхода аритмии.[4] Риск аритмий можно снизить, избегая использования у пациентов с гипокалиемия, гипомагниемия, ранее существовавшее удлинение интервала QT и у тех, кто принимает другие препараты, удлиняющие интервал QT.[4] Поскольку торемифен имеет эстрогенный действия в матка, это может увеличить риск гиперплазия эндометрия и рак эндометрия.[4]
Торемифен кажется более безопасным, чем тамоксифен.[14] Имеет меньший риск Венозная тромбоэмболия (VTE) (например, легочная эмболия ), Инсульт, и катаракта.[14] Более низкий риск ВТЭ может быть связан с тем, что тамоксифен снижает уровень антитромбин III в значительно большей степени, чем торемифен в дозе 60 или 200 мг / день.[14]
Взаимодействия
Торемифен - это субстрат из CYP3A4, а цитохром P450 фермент, и, следовательно, препараты, которые побудить или подавлять этот фермент может соответственно уменьшать или увеличивать уровни торемифена в организме.[4]
Фармакология
Фармакодинамика
Торемифен - это селективный модулятор рецептора эстрогена (SERM).[4][6][19] То есть это селективный смешанный агонист-антагонист из рецепторы эстрогена (ER), с эстрогенный действия в некоторых ткани и антиэстрогенный действия в других тканях.[4][6] Торемифен имеет похожие родство для ER как тамоксифен и ралоксифен, показывая константа торможения (Kя) значения 20,3 ± 0,1 нМ для ERα и 15,4 ± 3,1 нМ для ERβ.[19] Лекарство оказывает эстрогенное действие при кость, частичный эстрогенные эффекты в матка и печень, и антиэстрогенные эффекты в грудь.[5][7][8][4]
Торемифен очень похож на тамоксифен и разделяет большинство его свойств.[5][7][8][4] Есть некоторые признаки того, что торемифен может быть безопаснее тамоксифена, поскольку он не гепатоканцероген у животных и может иметь меньший потенциал генотоксичность.[5][2] Однако клинические исследования не обнаружили существенных различий между торемифеном и тамоксифеном, в том числе в отношении эффективность, переносимость, и безопасность, и, следовательно, клиническое использование торемифена было несколько ограничено.[5][2]
Было обнаружено, что торемифен обладает антигонадотропный эффекты у женщин в постменопаузе,[20] прогонадотропный эффекты у мужчин,[21] увеличить глобулин, связывающий половые гормоны уровни[20] и уменьшить инсулиноподобный фактор роста 1 уровни примерно на 20% у женщин и мужчин в постменопаузе.[22]
На торемифен приходится около одной трети потенция тамоксифена; то есть 60 мг торемифена примерно эквивалентно 20 мг тамоксифена при лечении рака груди.[23]
| Медикамент | Грудь | Кость | Печень | Матка | Влагалище | Мозг | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Липиды | Коагуляция | SHBG | IGF-1 | Приливы | Гонадотропины | |||||||||
| Эстрадиол | + | + | + | + | + | + | + | + | + | + | ||||
| «Идеальный SERM» | – | + | + | ± | ± | ± | – | + | + | ± | ||||
| Базедоксифен | – | + | + | + | + | ? | – | ± | – | ? | ||||
| Кломифен | – | + | + | ? | + | + | – | ? | – | ± | ||||
| Ласофоксифен | – | + | + | + | ? | ? | ± | ± | – | ? | ||||
| Оспемифен | – | + | + | + | + | + | ± | ± | – | ± | ||||
| Ралоксифен | – | + | + | + | + | + | ± | – | – | ± | ||||
| Тамоксифен | – | + | + | + | + | + | + | – | – | ± | ||||
| Торемифен | – | + | + | + | + | + | + | – | – | ± | ||||
| Эффект: + = Эстрогенный / агонистический. ± = Смешанный или нейтральный. – = Антиэстрогенный / антагонистический. Заметка: СЭРМ обычно повышают уровень гонадотропина у мужчин с гипогонадизмом и эугонадой, а также у женщин в пременопаузе (антиэстрогенные), но снижают уровень гонадотропинов у женщин в постменопаузе (эстрогенные). Источники: См. Шаблон. | ||||||||||||||
Фармакокинетика
В биодоступность торемифена точно не определено, но известно, что он эффективен.[1] Препарат более 99% связаны с белками плазмы.[1] это метаболизируется в печень в первую очередь CYP3A4 а затем проходит вторичную гидроксилирование.[1] В метаболиты из торемифена включают N-десметилторемифен и 4-гидрокситоремифен, и они менее активны, чем сам торемифен.[1][24] Оспемифен (деаминогидрокситоремифен) также является основным метаболитом торемифена.[3] Торемифен и 4-гидрокситоремифен имеют очень долгую период полувыведения от 5 до 6 дней, в то время как N-десметилторемифен имеет еще более длительный период полувыведения от 6 до 21 дня, а оспемифен имеет период полувыведения 4 дня.[1][3] Длительный период полувыведения торемифена и его метаболитов можно отнести к энтерогепатическая рециркуляция.[4] Торемифен устранен 70% в кал, как метаболиты.[1]
В отличие от тамоксифена, торемифен не пролекарство и не зависит от метаболизма CYP2D6 за биоактивация; следовательно, тамоксифен может быть предпочтительнее при CYP2D6. плохие метаболизаторы или у пациентов, принимающих препарат, подавляет CYP2D6.[25]
Химия
Торемифен, также известный как 4-хлоротамоксифен, это производная из трифенилэтилен и близкий аналог из тамоксифен.[9] Это также тесно связано с афимоксифен (4-гидрокситамоксифен) и оспемифен (деаминогидрокситоремифен).[25][26]
История
Торемифен был представлен в Соединенные Штаты в 1997 г.[10][11] Это был первый антиэстроген будет внедрен в этой стране с тамоксифена в 1978 году.[12]
Общество и культура
Родовые имена
Торемифен это родовое имя препарата и его ГОСТИНИЦА и БАН, в то время как цитрат торемифена это его USAN и ЯНВАРЬ и Torémifène это его DCF.[27][28][29][30]
Фирменные наименования
Торемифен продается почти исключительно под торговой маркой Fareston.[28][30]
Доступность
Торемифен широко продается во всем мире и доступен в Соединенные Штаты, то объединенное Королевство, Ирландия, много других Европейский страны, Южная Африка, Австралия, Новая Зеландия, и в других местах по всему миру.[28][30]
Исследование
Этот раздел должен быть обновлено. (Апрель 2017 г.) |
Торемифен также оценивался для предотвращения рак простаты и имел предварительное название Acapodene.[31]
В 2007 году фармацевтическая компания GTx, Inc проводил два разных этапа 3 клинические испытания; Во-первых, основную фазу клинических испытаний по лечению серьезных побочных эффектов андрогенная депривационная терапия (ADT) (особенно переломы позвоночника / позвоночника и приливы, липидный профиль и гинекомастия ) для запущенного рака простаты, и, во-вторых, решающее клиническое испытание фазы III для профилактики рака простаты у мужчин высокого риска с высокой степенью интраэпителиальная неоплазия предстательной железы, или PIN-код. Результаты этих испытаний ожидаются к первому кварталу 2008 года.[32]
NDA для первой заявки (облегчение побочных эффектов ADT рака простаты) было подано в феврале 2009 г.[33] а в октябре 2009 г. FDA заявило, что им потребуется больше клинических данных, например еще одно испытание фазы III.[34]
В конечном итоге разработка была прекращена, и торемифен никогда не продавался для лечения осложнений, связанных с ADT или лечением или профилактикой рака простаты.[35]
Торемифен может быть полезен для профилактики: бикалутамид -индуцированная гинекомастия.[14]
Результаты исследования фазы III
Было проведено двойное слепое плацебо-контролируемое рандомизированное трехлетнее клиническое испытание торемифена на выборке из 1260 мужчин. Средний возраст субъектов составлял 64 года, и у них была диагностирована интраэпителиальная неоплазия предстательной железы высокой степени (HGPIN), которая считается предраковой, хотя Томпсон и Лич считают, что ПИН низкой степени также может считаться предраковым.[36]
Спонсор, GTx, который разработал и руководил исследованием, обнаружил, что у 34,7% групп плацебо и 32,3% групп торемифена были случаи рака. Никаких различий в Очки Глисона любой группы.[37]
Предыдущие исследования на мышах с использованием трансгенной аденокарциномы простаты мышей (TRAMP) показали, что торемифен предотвращает пальпируемые опухоли у 60% животных. В этом исследовании торемифен использовался в качестве раннего профилактического средства, что отличает его от исследований фазы III на людях.[38]
Рекомендации
- ^ а б c d е ж грамм час я j k л Винсент Т. ДеВита-младший; Теодор С. Лоуренс; Стивен А. Розенберг (7 января 2015 г.). Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии. Wolters Kluwer Health. С. 1126–. ISBN 978-1-4698-9455-3.
- ^ а б c d е Брюс А. Чабнер; Дэн Л. Лонго (7 декабря 2011 г.). Химиотерапия и биотерапия рака: принципы и практика. Липпинкотт Уильямс и Уилкинс. С. 659–. ISBN 978-1-4511-4820-6.
- ^ а б c d е ж грамм час https://www.accessdata.fda.gov/drugsatfda_docs/label/2011/020497s006lbl.pdf
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты Лаура Розенталь; Жаклин Бурчум (17 февраля 2017 г.). Фармакотерапевтические средства Lehne для продвинутых специалистов - электронная книга. Elsevier Health Sciences. стр. 931–. ISBN 978-0-323-44779-9.
- ^ а б c d е ж грамм час Уильям Р. Миллер; Джеймс Н. Ингл (8 марта 2002 г.). Эндокринная терапия при раке груди. CRC Press. С. 55–57. ISBN 978-0-203-90983-6.
- ^ а б c d е ж Дэвид Шифф; Изабель Аррильяга; Патрик Ю. Вен (16 сентября 2017 г.). Онкологическая неврология в клинической практике: неврологические осложнения рака и их лечение. Humana Press. С. 296–. ISBN 978-3-319-57901-6.
- ^ а б c Моника Морроу; Вирджил Крейг Джордан (2003). Управление риском рака груди. PMPH-США. С. 192–. ISBN 978-1-55009-260-8.
- ^ а б c Селективные модуляторы эстрогеновых рецепторов - достижения в исследованиях и применении: издание 2013 г .: ScholarlyBrief. Научные издания. 1 мая 2013. С. 51–. ISBN 978-1-4901-0447-8.
- ^ а б Антонио Кано; Жоаким Калаф-и-Альсина; Хосе Луис Дуэнас-Диез (22 сентября 2006 г.). Селективные модуляторы эстрогеновых рецепторов: новый бренд многоцелевых препаратов. Springer Science & Business Media. С. 52–. ISBN 978-3-540-34742-2.
- ^ а б Орландо Э. Сильва; Стефано Зуррида (2005). Рак груди: практическое руководство. Elsevier Health Sciences. С. 355–. ISBN 0-7020-2744-8.
- ^ а б Уэйн Р. Бидлак; Стэнли Т. Омайе; Марк С. Мескин; Дебра К.В. Topham (16 марта 2000 г.). Фитохимические вещества как биоактивные вещества. CRC Press. С. 26–. ISBN 978-1-56676-788-0.
- ^ а б Филип Дж. ДиСайя; Уильям Т. Кризман; Роберт С. Маннел; Д. Скотт МакМикин, Дэвид Дж. Матч (4 февраля 2017 г.). Электронная книга по клинической гинекологической онкологии. Elsevier Health Sciences. С. 124–. ISBN 978-0-323-44316-6.
- ^ "Доступность дженерика Фарестона - Drugs.com". Drugs.com. Получено 2019-04-19.
- ^ а б c d е ж Sieber PR (декабрь 2007 г.). «Лечение заболеваний груди, вызванных бикалутамидом». Эксперт Rev Anticancer Ther. 7 (12): 1773–9. Дои:10.1586/14737140.7.12.1773. PMID 18062751. S2CID 40410461.
- ^ Кирби И. Блэнд; Эдвард М. Коупленд; В. Сюзанна Климберг; Уильям Дж. Градишар (29 июня 2017 г.). Электронная книга груди: комплексное лечение доброкачественных и злокачественных заболеваний. Elsevier Health Sciences. С. 86–. ISBN 978-0-323-51187-2.
- ^ Таббал, Махмуд; Фулейхан, Гада Эль-Хадж (2010). «Будущие терапии». Остеопороз у мужчин. С. 713–732. Дои:10.1016 / B978-0-12-374602-3.00057-2. ISBN 9780123746023.
- ^ Мари Дж. Вирфс, PhD, MN, APRN, ANP-BC, FNP-BC, CNE (9 мая 2019 г.). Полное руководство APRN и PA по назначению лекарственной терапии 2020. Издательская компания Springer. С. 60–. ISBN 978-0-8261-7934-0.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Casciato; Мэри К. Террито (2012). Руководство по клинической онкологии. Липпинкотт Уильямс и Уилкинс. С. 122–. ISBN 978-1-4511-1560-4.
- ^ а б Танежа С.С., Смит М.Р., Далтон Дж. Т., Рагоу С., Барнетт Дж., Штайнер М., Веверка К.А. (март 2006 г.). «Торемифен - перспективный препарат для профилактики рака простаты и осложнений терапии андрогенной депривацией». Мнение эксперта по исследованию наркотиков. 15 (3): 293–305. Дои:10.1517/13543784.15.3.293. PMID 16503765. S2CID 29510508.
- ^ а б Элльмен Дж., Хакулинен П., Партанен А., Хейс Д. Ф. (ноябрь 2003 г.). «Эстрогенные эффекты торемифена и тамоксифена у пациентов с раком молочной железы в постменопаузе» (PDF). Рак молочной железы Res. Рассматривать. 82 (2): 103–11. Дои:10.1023 / B: BREA.0000003957.54851.11. HDL:2027.42/44217. PMID 14692654. S2CID 207694212.
- ^ Цурди Э., Куртис А., Фармакиотис Д., Кацикис И., Салмас М., Панидис Д. (апрель 2009 г.). «Влияние селективного введения модулятора рецептора эстрогена на ось гипоталамус-гипофиз-яички у мужчин с идиопатической олигозооспермией». Fertil. Стерил. 91 (4 Suppl): 1427–30. Дои:10.1016 / j.fertnstert.2008.06.002. PMID 18692782.
- ^ Роэльфсема Ф, Ян Р.Дж., Такахаши П.Й., Эриксон Д., Бауэрс С.Ю., Велдхейс Дж.Д. (февраль 2018 г.). «Эффекты торемифена, селективного модулятора рецептора эстрогена, на спонтанную и стимулированную секрецию GH, IGF-I и IGF-связывающих белков у здоровых пожилых людей». Журнал эндокринного общества. 2 (2): 154–165. Дои:10.1210 / js.2017-00457. ЧВК 5789038. PMID 29383334.
- ^ MacGregor JI, Jordan VC (июнь 1998 г.). «Основное руководство по механизмам действия антиэстрогенов». Pharmacol. Rev. 50 (2): 151–96. PMID 9647865.
- ^ Джордж М. Бреннер; Крейг Стивенс (28 сентября 2017 г.). Электронная книга по фармакологии Бреннера и Стивенса. Elsevier Health Sciences. стр. 394–. ISBN 978-0-323-39172-6.
- ^ а б Георг Ф. Вебер (22 июля 2015 г.). Молекулярные методы лечения рака. Springer. С. 304–. ISBN 978-3-319-13278-5.
- ^ Филипп Ю. Максимов; Рассел Э. МакДэниел; В. Крейг Джордан (23 июля 2013 г.). Тамоксифен: новаторское лекарство от рака груди. Springer Science & Business Media. С. 170–. ISBN 978-3-0348-0664-0.
- ^ Дж. Элкс (14 ноября 2014 г.). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Springer. стр. 1222–. ISBN 978-1-4757-2085-3.
- ^ а б c Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. 2000. С. 1048–. ISBN 978-3-88763-075-1.
- ^ И.К. Мортон; Джудит М. Холл (6 декабря 2012 г.). Краткий словарь фармакологических агентов: свойства и синонимы. Springer Science & Business Media. С. 277–. ISBN 978-94-011-4439-1.
- ^ а б c "Торемифен - Drugs.com". Drugs.com. Получено 2018-02-08.
- ^ Цена N, Сартор О, Хатсон Т., Мариани С. (2005). «Роль ингибиторов 5a-редуктазы и селективных модуляторов рецепторов эстрогена как потенциальных химиопрофилактических агентов при раке простаты». Clin рака простаты. 3 (4): 211–4. Дои:10.1016 / с1540-0352 (11) 70089-0. PMID 15882476.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ «Фаза III клинической разработки ACAPODENE компанией GTx в рамках курса после запланированного обзора безопасности» (Пресс-релиз). GTx Inc. 12 июля 2007 г.. Получено 2006-07-14.
- ^ «GTx объявляет о принятии на рассмотрение FDA 80 мг торемифена NDA» (Пресс-релиз).
- ^ «Сотрудничество GTx и Ipsen End по раку простаты из-за затрат на исследование фазы III, запрошенное FDA». 2 марта 2011 г.
- ^ «Торемифен - АдисИнсайт». adisinsight.springer.com. Получено 2018-02-08.
- ^ Томпсон-младший И. М. и Лич Р. Рак простаты и интраэпителиальная неоплазия предстательной железы: правда, правда и не связаны? Дж. Клин Онкол, 2013;31:515-6. https://ascopubs.org/doi/full/10.1200/JCO.2012.46.6151= Проверено 31 июля 2019 г.
- ^ Танеха, С.С., Мортон, Р., Барнетт, Г., Сибер, П., Хэнкок, М.Л., и Штайнер, М., Диагностика рака простаты у мужчин с изолированной интраэпителиальной неоплазией высокой степени злокачественности, включенных в 3-летнюю проспективную фазу III клиническое испытание перорального торемифена Дж. Клин Онкол, 2013;31:523-9. https://ascopubs.org/doi/abs/10.1200/JCO.2012.41.7634= Проверено 31 июля 2019 г.
- ^ Raghow, S., Hooshdaran, M. Z., Katiyar, S., и Steiner, M. S., торемифен предотвращает рак простаты в трансгенной аденокарциноме модели простаты мыши. Исследования рака 2002;62:1370-6. http://cancerres.aacrjournals.org/content/62/5/1370= Проверено 31 июля 2019 г.
дальнейшее чтение
- Тарас Т.Л., Вурц GT, Линарес Г.Р., ДеГрегорио М.В. (2000). «Клиническая фармакокинетика торемифена». Клин Фармакокинет. 39 (5): 327–34. Дои:10.2165/00003088-200039050-00002. PMID 11108432. S2CID 26647296.
- Харви Х.А., Кимура М, Хаджба А (2006). «Торемифен: оценка его профиля безопасности». Грудь. 15 (2): 142–57. Дои:10.1016 / j.breast.2005.09.007. PMID 16289904.
- Танежа С.С., Смит М.Р., Далтон Дж. Т., Рагоу С., Барнетт Дж., Штайнер М., Веверка К.А. (2006). «Торемифен - перспективный препарат для профилактики рака простаты и осложнений терапии андрогенной депривацией». Мнение эксперта по исследованию наркотиков. 15 (3): 293–305. Дои:10.1517/13543784.15.3.293. PMID 16503765. S2CID 29510508.
- Чжоу В.Б., Дин Ц., Чен Л., Лю XA, Ван С. (2011). «Торемифен - эффективная и безопасная альтернатива тамоксифену в адъювантной эндокринной терапии рака груди: результаты четырех рандомизированных исследований». Рак молочной железы Res. Рассматривать. 128 (3): 625–31. Дои:10.1007 / s10549-011-1556-5. PMID 21553116. S2CID 36985808.
- Дженнари Л., Мерлотти Д., Столакис К., Нути Р. (2012). «Фармакокинетическая оценка торемифена и его клиническое значение для лечения остеопороза». Мнение экспертов: Drug Metab Toxicol. 8 (4): 505–13. Дои:10.1517/17425255.2012.665873. PMID 22356442. S2CID 19547631.
- Мао Ц., Ян З.Й., Хэ Б.Ф., Лю С., Чжоу Дж.Х., Ло Р.С., Чен Кью, Тан Дж.Л. (2012). «Торемифен против тамоксифена при распространенном раке груди». Кокрановская база данных Syst Rev (7): CD008926. Дои:10.1002 / 14651858.CD008926.pub2. PMID 22786516.
- Vogel CL, Johnston MA, Capers C, Braccia D (2014). «Торемифен от рака груди: обзор данных за 20 лет». Clin. Рак молочной железы. 14 (1): 1–9. Дои:10.1016 / j.clbc.2013.10.014. PMID 24439786.
- Мустонен М.В., Пирхёнен С., Келлокумпу-Лехтинен П.Л. (2014). «Торемифен в лечении рака груди». Мир J Clin Oncol. 5 (3): 393–405. Дои:10.5306 / wjco.v5.i3.393. ЧВК 4127610. PMID 25114854.
