Норетинодрел - Википедия - Noretynodrel
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Эновид (с местранол ), другие |
| Другие имена | Норэтинодрел; Норетинодрел Норетинодрел; NYD; SC-4642; NSC-15432; 5 (10) -норэтистерон; 17α-этинил-19-нор-5 (10) -тестостерон; 17α-этинил-δ5(10)-19-нортестостерон; 17α-этинилэстр-5 (10) -ен-17β-ол-3-он; 19-Нор-17α-прегн-5 (10) -ен-20-ин-17β-ол-3-он |
| Маршруты администрация | Устно |
| Класс препарата | Прогестаген; Прогестин; Эстроген |
| Код УВД | |
| Фармакокинетический данные | |
| Связывание с белками | Норетинодрел: к альбумин а не SHBG или же CBG[1] |
| Метаболизм | Печень, кишечник (гидроксилирование, изомеризация, спряжение )[1][3] |
| Метаболиты | • 3α-Гидроксиноретинодрел[2] • 3β-гидроксиноретинодрел[2] • Норэтистерон[2][1][3] • Этинилэстрадиол[3][4]• Конъюгаты[3] |
| Устранение период полураспада | Очень короткий (<30 минут)[5] |
| Экскреция | Грудное молоко: 1%[6] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.000.620 |
| Химические и физические данные | |
| Формула | C20ЧАС26О2 |
| Молярная масса | 298.426 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| (проверять) | |
Норетинодрел, или же норэтинодрел, продается под торговой маркой Эновид среди прочего, это прогестин лекарство, которое ранее использовалось в противозачаточные таблетки и в лечении гинекологические расстройства но сейчас больше не продается.[3][6][7][8] Он был доступен как отдельно, так и в сочетании с эстроген.[7][8][9] Лекарство принято устно.[7]
Норетинодрел - это прогестин или синтетический прогестаген, и, следовательно, является агонист из рецептор прогестерона, то биологическая мишень прогестагенов, таких как прогестерон.[3] Это относительно слабый прогестаген.[10] Лекарство слабое эстрогенный активность, нет или очень слабая андрогенный деятельность, и ничего другого важного гормональный Мероприятия.[3][8][11][12] Это пролекарство различных активные метаболиты в теле, например норэтистерон среди прочего.[3][13]
Норетинодрел был введен для медицинского применения в 1957 году.[8] Он был специально одобрен в это время в сочетании с местранол для лечения гинекологический и нарушения менструального цикла.[8] Впоследствии, в 1960 году, этот состав был одобрен для использования в качестве противозачаточных таблеток.[8][14] Это были первые противозачаточные таблетки, за которыми вскоре последовали противозачаточные таблетки, содержащие норэтистерон и другие прогестины.[8][14][15] Из-за того, что норэтинодрел является относительно слабым прогестагеном, он больше не используется в медицине.[10] Таким образом, он больше не продается.[6][16]
Медицинское использование
Норетинодрел ранее применялся в сочетании с эстроген местранол в лечении гинекологический и нарушения менструального цикла и как комбинированные противозачаточные таблетки.[8][14] Он также использовался при лечении эндометриоз в высоких дозировках от 40 до 100 мг / сут.[17] Лекарство было прекращено, больше не продается и не используется в медицине.[10][16][18]
Противопоказания
Никаких побочных эффектов не наблюдалось в кормление грудью младенцы, матери которых лечились норэтинодрелом.[6] Из-за этого Американская академия педиатрии считает, что норетинодрел обычно совместим с грудным вскармливанием.[6]
Побочные эффекты
Сообщается о случае признаков маскулинизация у ребенка женского пола, мать которого лечила норэтинодрелом от угроза выкидыша в течение беременность.[6][19][20]
Передозировка
Взаимодействия
Фармакология
Фармакодинамика

Норетинодрел имеет слабый прогестагенный активность, слабая эстрогенный активность, и нет или очень слабая андрогенный Мероприятия.[3] Считается пролекарство, и по этой причине метаболиты норэтинодрела играют важную роль в его биологическая активность.[3] Таким образом, фармакодинамика Норэтинодрел нельзя понять без ссылки на его метаболизм.[3]
Норетинодрел близок к норэтистерону и тиболону, которые являются δ4-изомер и 7α-метил производные норэтинодрела соответственно.[2][21] Он метаболизируется аналогично тиболону, тогда как метаболизм норэтистерона отличается.[2] И норетинодрел, и тиболон превращаются в 3α- и 3β-гидроксилированные метаболиты и δ4-изомер метаболит (в случае норэтинодрела, это норэтистерон), тогда как норэтистерон не является 3α- или 3β-гидроксилированным (и, конечно, не образует δ4-изомер метаболит).[2][21] Главная метаболиты Норетинодрел представляют собой 3α-гидроксиноретинодрел и, в меньшей степени, 3β-гидроксиноретинодрел, образованные соответственно 3α- и 3β-гидроксистероид дегидрогеназы (AKR1C1 –4 ), а δ4-изомер норэтистерон - второстепенный метаболит, образующийся в небольших количествах.[2]
Тиболон считается пролекарством как его 3α- и 3β-гидроксилированного, так и δ4-изомеризованные метаболиты.[2] Норетинодрел также считается пролекарством, поскольку он быстро метаболизируется и выводится из кровотока, а также проявляет очень слабое относительное сродство к рецептор прогестерона (PR), хотя, по-видимому, он образует норэтистерон только в незначительных количествах.[2][5][13]
| Сложный | Кодовое название | PR | AR | ER | GR | МИСТЕР | SHBG | CBG |
|---|---|---|---|---|---|---|---|---|
| Норетинодрел | – | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| Норэтистерон (δ4-NYD) | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 3α-гидроксиноретинодрел | – | ? | ? | ? | ? | ? | ? | ? |
| 3β-гидроксиноретинодрел | – | ? | ? | ? | ? | ? | ? | ? |
| Этинилэстрадиол | – | 15–25 | 1–3 | 112 | 1–3 | <1 | 0.18 | <0.1 |
| Тиболон (7α-Me-NYD) | ОРГ-ОД-14 | 6 | 6 | 1 | ? | ? | ? | ? |
| Δ4-Тиболон | ОРГ-ОМ-38 | 90 | 35 | 1 | 0 | 2 | 1 | 0 |
| 3α-гидрокситиболон | ORG-4094 | 0 | 3 | 4–6 | 0 | ? | ? | ? |
| 3β-гидрокситиболон | ORG-301260 | 0 | 4 | 3–29 | 0 | ? | ? | ? |
| 7α-метилэтинилэстрадиол | – | ? | ? | ? | ? | ? | ? | ? |
| Примечания: Значения указаны в процентах (%). Ссылка лиганды (100%) были промегестон для PR, метриболон для AR, E2 для ER, DEXA для GR, альдостерон для МИСТЕР, DHT за SHBG, и кортизол за CBG. Источники: См. Шаблон. | ||||||||
| Сложный | Типа | PR | AR | ER | GR | МИСТЕР | SHBG | CBG |
|---|---|---|---|---|---|---|---|---|
| Норэтистерон | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 5α-дигидроноретистерон | Метаболит | 25 | 27 | 0 | 0 | ? | ? | ? |
| 3α, 5α-тетрагидроноретистерон | Метаболит | 1 | 0 | 0–1 | 0 | ? | ? | ? |
| 3α, 5β-тетрагидроноретистерон | Метаболит | ? | 0 | 0 | ? | ? | ? | ? |
| 3β, 5α-Тетрагидроноретистерон | Метаболит | 1 | 0 | 0–8 | 0 | ? | ? | ? |
| Этинилэстрадиол | Метаболит | 15–25 | 1–3 | 112 | 1–3 | 0 | 0.18 | 0 |
| Норэтистерона ацетат | Пролекарство | 20 | 5 | 1 | 0 | 0 | ? | ? |
| Норэтистерона энантат | Пролекарство | ? | ? | ? | ? | ? | ? | ? |
| Норетинодрел | Пролекарство | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| Этинодиол | Пролекарство | 1 | 0 | 11–18 | 0 | ? | ? | ? |
| Этинодиол диацетат | Пролекарство | 1 | 0 | 0 | 0 | 0 | ? | ? |
| Линестренол | Пролекарство | 1 | 1 | 3 | 0 | 0 | ? | ? |
| Примечания: Значения указаны в процентах (%). Ссылка лиганды (100%) были промегестон для PR, метриболон для AR, эстрадиол для ER, дексаметазон для GR, альдостерон для МИСТЕР, дигидротестостерон за SHBG, и кортизол за CBG. Сноски: а = Активный или неактивный метаболит, пролекарство, или ни один из норэтистерона. Источники: См. Шаблон. | ||||||||
Прогестагенная активность
Норетинодрел - относительно слабый прогестаген, обладающий лишь примерно одной десятой прогестагенной активности норэтистерона.[10] В овуляция - ингибирующая доза норэтинодрела составляет 4,0 мг / день по сравнению с 0,4 мг / день в случае норэтистерона.[1] И наоборот, трансформация эндометрия Дозировка норэтинодрела составляет 150 мг на цикл по сравнению с 120 мг на цикл для норэтистерона.[1] Что касается PR, норэтинодрел обладает лишь от 6 до 19% близость норэтистерона для PRА, тогда как сродство двух препаратов к PRB аналогичен (норэтинодрел обладает 94% сродством норэтистерона к PRB).[21] Тиболон и δ4-изомерный метаболит тиболона имеет сходное сродство к PR, как норэтинодрел и норэтистерон, соответственно, тогда как 3α- и 3β-гидроксилированные метаболиты тиболона практически лишены сродства к PR.[21] Поскольку структурно связанные андроген /анаболический стероид трестолон (7α-метил-19-нортестостерон), как известно, является сильнодействующим гестагеном,[22] предполагая, что 7α-метильная замена не влияет на прогестагенную активность, 3α- и 3β-гидроксиноретинодрел, вероятно, лишены сродства к PR аналогично 3α- и 3β-гидроксилированным метаболитам тиболона.[21]
Андрогенная активность
Говорят, что Норетинодрел не обладает или очень слабым андрогенный Мероприятия.[8][11][12] В этом отличие от норэтистерона, который проявляет умеренную, но значительную андрогенность.[8][3] По сравнению с норэтистероном, норэтинодрел имеет на 45-81% более низкое сродство к рецептор андрогенов (AR).[21] В соответствии с этим отсутствуют андрогенные эффекты (например, гирсутизм, увеличение клитора, или же голос меняется ) наблюдались с норетинодрелом даже при использовании в больших дозах (например, 60 мг / день) в течение продолжительных периодов времени (9–12 месяцев) при лечении женщин с эндометриоз.[23] Кроме того, норэтинодрел не вызывает вирилизации у женщин. плоды, в отличие от многих других тестостерон -производные прогестины, включая этистерон, норэтистерон и норэтистерона ацетат.[24] Однако по крайней мере один случай псевдогермафродитизм (вирилизованные гениталии), что могло быть связано с норэтинодрелом.[20] Δ4-изомерный метаболит тиболона демонстрирует резко и непропорционально увеличенное сродство к AR по сравнению с норэтистероном и норэтинодрелом (в 5,7-18,5 раз больше, чем у норэтистерона), что указывает на то, что 7α-метильная группа тиболона заметно увеличивает его андрогенную активность и отвечает за для большего андрогенного действия тиболона по сравнению с норэтинодрелом.[21]
Эстрогенная активность
Норетинодрел, в отличие от большинства прогестинов, но похож на этинодиола диацетат, есть некоторые эстрогенный Мероприятия.[11] Считается, что по сравнению с другими прогестинами 19-нортестостерона норетинодрел обладает гораздо более сильной эстрогенной активностью.[5] В тесте Аллена-Дойзи на эстрогенность у животных сообщалось, что норэтинодрел обладает в 100 раз большей эстрогенной активностью, чем норэтистерон.[3] В то время как норэтистерон практически не имеет сродства с рецепторы эстрогена (ER) норэтинодрел демонстрирует некоторое, хотя и очень слабое сродство к обоим ERα и ERβ (с точки зрения относительная аффинность связывания, 0,7% и 0,22% от эстрадиол, соответственно).[21][25] Эстрогенная активность 3α- и 3β-гидроксиноретинодрела никогда не оценивалась.[2] Однако, в то время как тиболон демонстрирует сходное сродство к ER, как и норэтинодрел, 3α- и 3β-гидроксилированные метаболиты тиболона имеют в несколько раз повышенное сродство к ER.[2][21] Таким образом, 3α- и 3β-гидроксилированные метаболиты норэтинодрела могут также проявлять повышенную эстрогенную активность, и это может объяснять известные эстрогенные эффекты норэтинодрела.[2][21]
Δ4-изомер тиболона, как и норэтистерон, практически лишен сродства к ЭР.[21] Ни тиболон, ни его метаболиты не ароматизируются, тогда как трестолон легко ароматизируется так же, как тестостерон и 19-нортестостерон, и по этим причинам маловероятно, что норэтинодрел или его метаболиты, кроме норэтистерона, также ароматизируются.[26] Таким образом, ароматизация, вероятно, не играет роли в эстрогенной активности тиболона или норетинодрела.[26] Однако по этому поводу существуют разногласия, и другие исследователи предположили, что тиболон и норетинодрел могут ароматизироваться в небольших количествах до сильнодействующих эстрогенов (этинилэстрадиол и его 7α-метильное производное соответственно).[27][28]
Фармакокинетика
Норетинодрел быстро поглощен на пероральное введение и быстро метаболизируется, исчезающий из обращения в течение 30 минут.[29][5] С точки зрения связывание с белками плазмы, норэтинодрел связан с альбумин, и показать нет близость сам для глобулин, связывающий половые гормоны или же кортикостероид-связывающий глобулин.[1] Связывание с белками плазмы его метаболиты, Такие как норэтистерон, однако может отличаться.[3]
Основными метаболитами норетинодрела в кровотоке являются 3α-гидроксиноретинодрел (образованный 3α-HSD ) и в меньшей степени 3β-гидроксиноретинодрел (образованный 3β-HSD ), и более второстепенных метаболитов норэтинодрела являются норэтистерон (образована δ5-4-изомераза ) и возможно этинилэстрадиол (образована ароматаза или, возможно, другой цитохром P450 ферменты, скорее всего монооксигеназы ).[3][2][4][29] Из-за очень короткого период полувыведения и его низкий родство за рецепторы стероидных гормонов в анализы связывания рецепторов, норэтинодрел считается пролекарство что быстро преобразованный в его активные метаболиты в кишечник и печень после перорального приема.[1][3][5][13] Некоторые исследователи заявили, что это определенно пролекарство норэтистерона.[1][3][13] Однако, по мнению других исследователей, из-за отсутствия исследований недостаточно данных, чтобы однозначно показать, что это так в настоящее время.[13]
Около 1% пероральной дозы норэтинодрела обнаруживается в грудное молоко.[6]
В фармакокинетика Норетинодрела.[30]
Химия
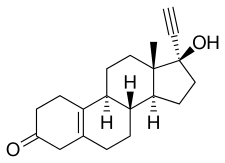
Норетинодрел, также известный как 17α-этинил-δ5(10)-19-нортестостерон или как 17α-этинилэстр-5 (10) -ен-17β-ол-3-он, представляет собой синтетический эстран стероидный препарат и производная из тестостерон.[18][31] Это производное тестостерона, которое было этинилированный в позиции C17α, деметилированный в позиции C19, и дегидрированный (т.е. имеет двойная связь ) между позициями C5 и C10).[18][31] Таким образом, норэтинодрел также является комбинированным производным нандролон (19-нортестостерон) и этистерон (17α-этинилтестостерон).[18][31] Кроме того, это изомер норэтистерона (17α-этинил-19-нортестостерон), в котором двойная связь C4 заменена двойной связью между положениями C5 и C10.[18][31] По этой причине норэтинодрел также известен как 5 (10) -норетистерон.[18][31] Некоторые другие прогестины 19-нортестостерона имеют двойную связь C5 (10) норэтинодрела, но примеры пар, которые действительно включают тиболон, C7α метил производное норэтинодрела (т.е. 7α-метилноретинодрел), и норгестерон, C17α винил аналог норэтинодрел.[18][31]
Синтез
Химический синтез норэтинодрела.[31][30]
История
Норетинодрел был впервые синтезирован Фрэнк Б. Колтон из Г. Д. Сирл и компания в 1952 г., и этому предшествовал синтез норэтистерона Луис Э. Мирамонтес и Карл Джерасси из Syntex в 1951 г.[8] В 1957 году норэтинодрел и норэтистерон в сочетании с местранол, были одобрены в Соединенные Штаты для лечения нарушения менструального цикла.[15] В 1960 году норэтинодрел в сочетании с местранолом (как Эновид), был представлен в США в качестве первого перорального контрацептива, а в 1963 году последовала комбинация норэтистерона и местранола в качестве второго перорального контрацептива.[15] В 1988 г. было прекращено применение Эновида, наряду с другими оральными контрацептивами, содержащими высокие дозы эстрогена.[32][33]
Норетинодрел впервые был изучен для лечения эндометриоз в 1961 году и был первым прогестином, который исследовали для лечения этого состояния.[17]
Общество и культура
Родовые имена
Норетинодрел это ГОСТИНИЦА препарата, пока норэтинодрел это его USAN и БАН.[6][16][18][31] Он также известен своим кодовым названием развития SC-4642.[6][16][18][31]
Фирменные наименования
Норетинодрел продается отдельно под торговыми марками Энидрел, Оргаметрил и Превисон и в сочетании с местранол под торговыми марками Conovid, Conovid E, Enavid, Enavid E, Enovid, Enovid E, Norolen и Singestol.[9]
Доступность
Норетинодрел больше не доступен ни в одной форме в США.[34] и, похоже, он до сих пор не продается в какой-либо другой стране.[16][18]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час Kuhl H (сентябрь 1990 г.). «Фармакокинетика эстрогенов и прогестагенов». Maturitas. 12 (3): 171–97. Дои:10.1016 / 0378-5122 (90) 90003-О. PMID 2170822.
- ^ а б c d е ж грамм час я j k л м Цзинь И, Дуан Л., Чен М., Пеннинг TM, Клоостербур HJ (2012). «Метаболизм синтетического прогестагена норэтинодрела кетостероидредуктазами человека суперсемейства альдокеторедуктаз». J. Steroid Biochem. Мол. Биол. 129 (3–5): 139–44. Дои:10.1016 / j.jsbmb.2011.12.002. ЧВК 3303946. PMID 22210085.
- ^ а б c d е ж грамм час я j k л м п о п q Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ а б Kuhl H (2011). «Фармакология прогестагенов» (PDF). J Reproduktionsmed Эндокринол. 8 (1): 157–177.
- ^ а б c d е Хаммерштейн Дж (1990). «Пролекарства: преимущество или недостаток?». Являюсь. J. Obstet. Гинеколь. 163 (6, п. 2): 2198–203. Дои:10.1016 / 0002-9378 (90) 90561-К. PMID 2256526.
- ^ а б c d е ж грамм час я Свитмен, Шон С., изд. (2009). «Половые гормоны и их модуляторы». Мартиндейл: полный справочник лекарств (36-е изд.). Лондон: Фармацевтическая пресса. С. 2120–2121. ISBN 978-0-85369-840-1.
- ^ а б c Джакер (21 декабря 2013 г.). Прогресс в исследованиях лекарственных средств / Fortschritte der Arzneimittelforschung / Progrès des recherches Pharmaceutiques. Birkhäuser. С. 85–88. ISBN 978-3-0348-7065-8.
- ^ а б c d е ж грамм час я j k Лара Маркс (2010). Сексуальная химия: история противозачаточных таблеток. Издательство Йельского университета. С. 74–75. ISBN 978-0-300-16791-7.
- ^ а б Рабочая группа МАИР по оценке канцерогенного риска химических веществ для человека (1974). Монографии МАИР по оценке канцерогенного риска химических веществ для человека: половые гормоны (PDF). Всемирная организация здоровья. п. 88,191.
- ^ а б c d Дэвид А. Уильямс; Уильям О. Фой; Томас Л. Лемке (январь 2002 г.). Принципы медицинской химии Фуа. Липпинкотт Уильямс и Уилкинс. С. 700–. ISBN 978-0-683-30737-5.
- ^ а б c Бенно Клеменс Руннебаум; Томас Рабе; Людвиг Кизель (6 декабря 2012 г.). Женская контрацепция: новости и тенденции. Springer Science & Business Media. С. 36–. ISBN 978-3-642-73790-9.
- ^ а б Этель Слоун (2002). Биология женщины. Cengage Learning. С. 426–. ISBN 978-0-7668-1142-3.
- ^ а б c d е Станчик, Франк З. (сентябрь 2002 г.). «Фармакокинетика и эффективность прогестинов, используемых для заместительной гормональной терапии и контрацепции». Обзоры в эндокринных и метаболических расстройствах. 3 (3): 211–224. Дои:10.1023 / А: 1020072325818. ISSN 1389-9155. PMID 12215716. S2CID 27018468.
Хотя нет убедительных доказательств того, что in vivo превращение норэтинодрела в норэтиндрон, данные тестов связывания рецепторов и биотестов предполагают, что норэтинодрел также является пролекарством.
- ^ а б c Маннфред А. Холлингер (19 октября 2007 г.). Введение в фармакологию, третье издание. CRC Press. С. 160–. ISBN 978-1-4200-4742-4.
- ^ а б c Энрике Равина (11 января 2011 г.). Эволюция открытия лекарств: от традиционных лекарств к современным лекарствам. Джон Вили и сыновья. С. 190–. ISBN 978-3-527-32669-3.
- ^ а б c d е https://www.drugs.com/international/noretynodrel.html
- ^ а б Эрик Дж. Томас; Дж. Рок (6 декабря 2012 г.). Современные подходы к эндометриозу. Springer Science & Business Media. С. 223–. ISBN 978-94-011-3864-2.
- ^ а б c d е ж грамм час я j Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. Январь 2000. С. 1–. ISBN 978-3-88763-075-1.
- ^ ВИЛКИНС Л. (март 1960 г.). «Маскулинизация плода женского пола из-за перорального приема прогестинов». Проблемы врожденных пороков. J Am Med Assoc. 172. С. 1028–32. Дои:10.1007/978-94-011-6621-8_31. ISBN 978-94-011-6623-2. PMID 13844748.
- ^ а б Корн GW (1961). «Применение норэтинодрела (эновида) в клинической практике». Can Med Assoc J. 84: 584–7. ЧВК 1939348. PMID 13753182.
Псевдогермафродитизм не должен быть проблемой у этих пациентов, поскольку оказывается, что норэтинодрел не обладает андрогенными свойствами, но считается, что теперь Уилкинс обнаружил один такой случай у пациента, который получал терапию норэтинодрелом.
- ^ а б c d е ж грамм час я j k de Gooyer ME, Deckers GH, Schoonen WG, Verheul HA, Kloosterboer HJ (2003). «Профилирование рецепторов и эндокринные взаимодействия тиболона». Стероиды. 68 (1): 21–30. Дои:10.1016 / s0039-128x (02) 00112-5. PMID 12475720. S2CID 40426061.
- ^ Бери, Рипла; Кумар, Нарендер; Savage, T .; Benalcazar, L .; Сундарам, Калян (1998). «Эстрогенная и прогестагенная активность 7α-метил-19-нортестостерона, синтетического андрогена». Журнал стероидной биохимии и молекулярной биологии. 67 (3): 275–283. Дои:10.1016 / S0960-0760 (98) 00114-9. ISSN 0960-0760. PMID 9879986. S2CID 21302338.
- ^ Кистнер RW (1964). «Стероидные соединения с прогестагенной активностью». Постградская медицина. 35 (3): 225–32. Дои:10.1080/00325481.1964.11695038. PMID 14129897.
Это различие важно с клинической точки зрения, поскольку не сообщалось об андрогенных эффектах (гирсутизм, увеличение клитора, изменение голоса) даже при приеме больших доз норэтинодрела (60 мг в день) у пациентов с эндометриозом от 9 до 12 месяцев.
- ^ Симпсон, Джо Ли; Кауфман, Раймонд Х. (1998). «Влияние эстрогенов, прогестагенов и диэтилстильбестрола на плод». Во Фрейзере, Ян С. (ред.). Эстрогены и прогестагены в клинической практике (3-е изд.). Лондон: Черчилль Ливингстон. С. 533–53. ISBN 978-0-443-04706-0.
- ^ Kuiper GG, Carlsson B, Grandien K, Enmark E, Häggblad J, Nilsson S, Gustafsson JA (1997). «Сравнение специфичности связывания лиганда и распределения транскриптов в тканях рецепторов эстрогена альфа и бета». Эндокринология. 138 (3): 863–70. Дои:10.1210 / endo.138.3.4979. PMID 9048584.
- ^ а б de Gooyer, Marcel E .; Oppers-Tiemissen, Hendrika M .; Лейзен, Дирк; Verheul, Herman A.M .; Kloosterboer, Helenius J. (2003). «Тиболон не превращается ароматазой человека в 7α-метил-17α-этинилэстрадиол (7α-MEE)». Стероиды. 68 (3): 235–243. Дои:10.1016 / S0039-128X (02) 00184-8. ISSN 0039-128X. PMID 12628686. S2CID 29486350.
- ^ Kuhl, H .; Вигратц, И. (2009). «Могут ли производные 19-нортестостерона ароматизироваться в печени взрослых людей? Есть ли клинические последствия?». Климактерический. 10 (4): 344–353. Дои:10.1080/13697130701380434. ISSN 1369-7137. PMID 17653961. S2CID 20759583.
- ^ Kloosterboer, H. J. (2009). «Тиболон не ароматизируется у женщин в постменопаузе». Климактерический. 11 (2): 175–176. Дои:10.1080/13697130701752087. ISSN 1369-7137. PMID 18365860. S2CID 37940652.
- ^ а б Г. Сейффарт (6 декабря 2012 г.). Дозировка препарата при почечной недостаточности. Springer Science & Business Media. С. 423–. ISBN 978-94-011-3804-8.
- ^ а б Die Gestagene. Springer-Verlag. 27 ноября 2013. С. 15, 285. ISBN 978-3-642-99941-3.
- ^ а б c d е ж грамм час я Дж. Элкс (14 ноября 2014 г.). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Springer. С. 886–. ISBN 978-1-4757-2085-3.
- ^ Служба новостей Рейтер (1988-04-15). «Сирл и еще двое должны прекратить делать таблетки с высоким содержанием эстрогена». Сент-Луис Пост-Диспетч. стр. 7D. Получено 2009-08-29.
- ^ "Таблетки с высоким содержанием эстрогена уходят с рынка". Новости Сан-Хосе Меркьюри. 1988-04-15. Получено 2009-08-29.
- ^ "Drugs @ FDA: одобренные FDA лекарственные препараты". Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 27 ноября 2016.
