Анализ связывания лиганда - Википедия - Ligand binding assay
А анализ связывания лиганда (LBA) является проба, или аналитическая процедура, основанная на привязке лиганд молекулы к рецепторы, антитела или другой макромолекулы.[1] Метод обнаружения используется для определения наличия и степени образования комплексов лиганд-рецептор, и это обычно определяется электрохимически или через обнаружение флуоресценции метод.[2] Этот тип аналитический тест может использоваться для проверки наличия в образце целевых молекул, которые, как известно, связываются с рецептором.[3]
Существует множество типов анализов связывания лигандов, как радиоактивный и нерадиоактивный.[4][5][6] Таким образом, анализы связывания лиганда являются расширенным набором радиоактивные анализы, которые концептуально инвертируют радиоиммуноанализы (РИА). Некоторые более новые типы называются анализами «смешай и измерий», потому что они не требуют отделения связанного от несвязанного лиганда.[5]
Анализы связывания лиганда используются в основном в фармакология для различных требований. В частности, несмотря на то, что человеческое тело эндогенный рецепторы, гормоны, и другие нейротрансмиттеры, фармакологи использовать анализы для создания наркотики которые являются селективными или имитируют эндогенно обнаруженные клеточные компоненты. С другой стороны, такие методы также доступны для создания антагонистов рецепторов, чтобы предотвратить дальнейшие каскады.[7] Такие достижения дают исследователям возможность не только количественно определять гормоны и рецепторы гормонов, но также вносить важную фармакологическую информацию в разработку лекарств и планы лечения.[8]
История
Исторически методы анализа связывания лиганда широко использовались для количественного определения концентрации гормона или гормональных рецепторов в плазме или в ткани. В лиганд переплет проба Методология количественно оценивала концентрацию гормона в исследуемом материале путем сравнения эффектов исследуемого образца с результатами различных количеств известного белка (лиганд ).
Основы, для которых был построен анализ связывания лигандов, являются результатом Карл Ландштайнер в 1945 г. и его работа по иммунизации животных путем производства антител к определенным белкам.[9] Работа Ландштейнера продемонстрировала, что технология иммуноанализа позволяет исследователям проводить анализ на молекулярном уровне. О первом успешном анализе связывания лиганда сообщил в 1960 г. Розалин Сассман Ялоу и Соломон Берсон.[9] Они исследовали связывающее взаимодействие инсулина и инсулино-специфических антител в дополнение к разработке первых радиоиммуноанализ (РИА) для инсулина. Эти открытия предоставили ценную информацию о чувствительности и специфичности белковых гормонов, обнаруженных в жидкостях крови.[9] Ялоу и Берсон получили Нобелевскую премию по медицине за свои достижения. Благодаря развитию технологии РИА исследователи смогли выйти за рамки использования радиоактивности и вместо этого использовать жидкие и твердофазные, конкурентные и иммунорадиометрические анализы.[9] Как прямой результат этих грандиозных открытий, исследователи продолжили продвижение анализов связывания лигандов во многих аспектах в области биологии, химии и т.п.
Приложения
Анализы связывания лиганда позволяют измерить взаимодействия, которые происходят между двумя молекулами, такие как связывание с белками, а также степень близость (слабое, сильное или отсутствие связи), при котором реагенты связываются вместе.[10] Существенные аспекты анализов связывания включают, помимо прочего, уровень концентрации реагентов или продуктов (см радиоактивный раздел ), поддерживая константа равновесия реагентов на протяжении всего анализа, а также надежность и достоверность связанных реакций.[10] Хотя анализы связывания просты, они не могут предоставить информацию о том, влияет ли тестируемое соединение на функцию мишени.[11]
Анализ радиолигандов
Радиолиганды используются для измерения связывания лиганда с рецепторами и в идеале должны иметь высокое сродство, низкое неспецифическое связывание, высокую специфическую активность для обнаружения низкой плотности рецептора и специфичность рецептора.[7]
Уровни радиоактивности радиолиганда (на моль) называются удельной активностью (SA), которая измеряется в Ки / ммоль.[12] Фактическая концентрация радиолиганда определяется конкретной смесью исходных материалов, для которой радиолиганд был получен (от производителей).[12] Следующее уравнение определяет фактическую концентрацию:
Привязка насыщенности
Анализ насыщения используется в различных типах тканей, таких как фракции частично очищенной плазмы из ткани. гомогенаты, клетки, трансфицированные клонированными рецепторами, и клетки, которые либо находятся в культуре, либо выделены перед анализом.[7] Анализ связывания насыщения может определять сродство и плотность рецептора. Это требует, чтобы выбранная концентрация для нового лиганда определялась эмпирически.
Для этого типа экспериментов используются две общие стратегии:[7] Увеличение количества радиолиганд добавлен при сохранении как константы специфическая деятельность и постоянная концентрация радиолиганда или снижение удельной активности радиолиганда из-за добавления немеченого лиганда.[7]
Сюжет Скэтчарда

А Сюжет Скэтчарда (График Розенталя) можно использовать для демонстрации сродства к радиолиганду. На графике этого типа соотношение «связанный / свободный радиолиганд» отображается против связанного радиолиганда. В склон линии равна отрицательному обратному значению константа сродства (К). Пересечение линии с осью X является оценкой Bmax.[7] График Скэтчарда можно стандартизировать относительно соответствующего эталона, чтобы можно было прямое сравнение плотности рецепторов в различных исследованиях и тканях.[7] Этот примерный график показывает, что радиолиганд связывается с одним сродством. Если бы лиганд должен был связываться с несколькими сайтами, имеющими разное сродство к радиолигандам, то график Скэтчарда показал бы вогнутый линия вместо этого.[7]
Подгонка нелинейной кривой
Программы подбора нелинейной кривой, такие как анализ данных равновесного связывания (EBDA) и LIGAND, используются для расчета оценок параметров связывания из экспериментов по насыщению и конкурентному связыванию.[13] EBDA выполняет первоначальный анализ, который преобразует измеренную радиоактивность в молярные концентрации и создает Склоны холмов и Преобразования Скэтчарда из данных. Затем LIGAND может использовать анализ, проведенный EBDA, для оценки конкретной модели привязки.[13]
Обязанность соревнований
Связывание с конкуренцией используется для определения наличия селективности в отношении конкретного лиганда для подтипов рецепторов, что позволяет определять плотность и долю каждого подтипа в ткани.[7] Кривые конкуренции получают путем построения графика специфического связывания, которое представляет собой процент от общего связывания, против log концентрации конкурирующего лиганда.[7] Крутая кривая конкуренции обычно указывает на связывание с одной популяцией рецепторов, тогда как неглубокая кривая или кривая с четкими точками перегиба указывает на множественные популяции сайтов связывания.[13]
Анализы нерадиоактивного связывания
Несмотря на различные методы, используемые для нерадиоактивных анализов, они требуют, чтобы лиганды проявляли характеристики связывания, аналогичные его радиоактивному эквиваленту. Таким образом, результаты как нерадиоактивных, так и радиоактивных анализов останутся неизменными.[5] Одно из самых больших различий между анализами радиоактивных и нерадиоактивных лигандов заключается в опасностях для здоровья человека. Радиоактивные анализы вредны тем, что производят радиоактивные отходы; тогда как в анализах нерадиоактивных лигандов используется другой метод, чтобы избежать образования токсичных отходов. Эти методы включают, но не ограничиваются, поляризацию флуоресценции (FP), флуоресцентный резонансный перенос энергии (FRET) и поверхностный плазмонный резонанс (SPR). Чтобы измерить процесс связывания лиганд-рецептор, большинство нерадиоактивных методов требует, чтобы мечение не мешало молекулярным взаимодействиям.[5]
Поляризация флуоресценции
Поляризация флуоресценции (FP) является синонимом анизотропия флуоресценции. Этот метод измеряет изменение скорости вращения флуоресцентно меченного лиганда после его связывания с рецептором.[5] Поляризованный свет используется для возбуждения лиганда, и измеряется количество испускаемого света.[5] Деполяризация излучаемого света зависит от лиганда, связанного (например, с рецептором). Если лиганд не связан, он будет иметь большую деполяризацию (лиганд может быстро вращаться, вращая свет). Если лиганд связан, объединенный больший размер приводит к более медленному вращению и, следовательно, к снижению деполяризации.[5] Преимущество этого метода в том, что он требует только одного шага маркировки. Однако этот метод менее точен при малых наномолярный концентрации.[5]
Флуоресцентный резонансный перенос энергии

Передача энергии резонанса флуоресценции (FRET) использует энергию, передаваемую между донорными и акцепторными молекулами, которые находятся в непосредственной близости.[5] FRET использует флуоресцентно меченый лиганд, как и FP.[5] Передача энергии внутри FRET начинается с возбуждения донора.[5] В диполь-дипольное взаимодействие между донором и молекулой акцептора передает энергию от донора к молекуле акцептора.[5] Если лиганд связан с комплексом рецептор-антитело, то акцептор будет излучать свет.[5] При использовании FRET критически важно, чтобы между акцептором и донором было расстояние менее 10 нм, в дополнение к перекрывающимся спектр поглощения между акцептором и донором, и что антитело не мешает и не блокирует сайт связывания лиганда.[5]
Поверхностный плазмонный резонанс

Поверхностный плазмонный резонанс (SPR) не требует мечения лиганда.[5] Вместо этого он работает, измеряя изменение угла, под которым поляризованный свет отражается от поверхности (показатель преломления ).[5] Угол связан с изменением массы или толщины слоя, таким как иммобилизация лиганда, изменяющая резонансный угол, что увеличивает отраженный свет.[5] Устройство, для которого рассчитывается SPR, включает в себя сенсорный чип, проточную ячейку, источник света, призма, и детектор положения с фиксированным углом.[5]
Анализы связывания жидкой фазы
Иммунопреципитация
Жидкофазный анализ связывания лиганда Иммунопреципитация (IP) - это метод, который используется для очистки или обогащения определенного белка или группы белков с использованием антитело из сложной смеси. Экстракт поврежденной ткани или клеток смешивают с антителом против представляющего интерес антигена, которое продуцирует комплекс антиген-антитело.[14] Когда концентрация антигена низкая, осаждение комплекса антиген-антитело может занять часы или даже дни, и становится трудно изолировать небольшое количество образовавшегося осадка.[14]
Иммуноферментный анализ (ELISA ) или же Вестерн-блоттинг представляют собой два разных способа получения и анализа очищенного антигена (или нескольких антигенов). Этот метод включает очистку антигена с помощью прикрепленного антитела на твердой (гранулированной) подложке, такой как агарозная смола.[15] Обездвиженные белковый комплекс может быть выполнено за один шаг или последовательно.[15]
IP также можно использовать в сочетании с биосинтетическим радиоизотопным мечением. Используя эту комбинацию методов, можно определить, синтезируется ли конкретный антиген тканью или клеткой.[14]
Анализы твердофазного связывания
Многолуночный планшет

Многолуночные планшеты бывают множественными чашки Петри включены в один контейнер с количеством отдельных лунок от 6 до более 1536. Анализы на многолуночных планшетах удобны для работы с необходимыми дозировками и повторениями.[16] Существует широкий спектр типов пластин со стандартизированной площадью основания, вспомогательным оборудованием и системами измерения.[16] Электроды могут быть встроены в дно планшетов для сбора информации в результате анализов связывания.[9] Связывающие реагенты иммобилизуются на поверхности электрода и затем могут быть проанализированы.[9]
Многолуночные планшеты производятся, чтобы позволить исследователям создавать и управлять различными типами анализов (т. Е. биоанализы, иммуноанализ и т. д.) в каждом многолуночном планшете.[16] Из-за вариабельности форматирования многолуночных планшетов нередко возникают артефакты. Артефакты возникают из-за разной среды, обнаруженной в разных лунках планшета, особенно у краев и в центре лунок. Такие эффекты известны как эффекты скважины, краевые эффекты и эффекты пластины. Таким образом, подчеркивается необходимость правильного размещения образцов для анализа как внутри, так и между каждым планшетом.[16]
Многолуночные планшеты часто используются при измерении активности биологического анализа in vitro или измерении иммунореактивности с помощью иммуноанализов.[16]Артефактов можно избежать, поддерживая однородность планшета, применяя одну и ту же дозу конкретной среды в каждой лунке, в дополнение к поддержанию норм атмосферного давления и температуры для снижения влажности.[16]
Обвязка борта
Анализы связывания лигандов на бусах представляют собой методы выделения основных белков, ДНК / РНК или других биомолекул, находящихся в неопределенных суспензиях, и могут использоваться во многих биохроматографических приложениях. Биоаффинные лиганды ковалентно связаны с гранулами диоксида кремния с концевыми отрицательно заряженными силанольными группами или гранулами полистирола и используются для выделения и очистки основных белков или адсорбции биомолекул. После связывания разделение выполняется центрифугированием (разделение по плотности) или притяжением магнитного поля (только для магнитных частиц). Гранулы можно промыть для обеспечения чистоты выделенной молекулы перед ее растворением методами ионного обмена. Методы прямого анализа, основанные на ферментативном / флуоресцентном детектировании (например, HRP, флуоресцентный краситель), могут использоваться для определения на гранулах или количественного определения связанных биомолекул.[17][18][19]
Связывание по столбцу
Фильтр
Анализы с фильтром - это твердофазный анализ связывания лиганда, в котором используются фильтры для измерения сродства между двумя молекулами. В анализ связывания фильтра фильтры используются для улавливания клеточных мембран путем всасывания через них среды.[8] Этот быстрый метод осуществляется с высокой скоростью, при которой может быть достигнута фильтрация и извлечение найденной фракции.[20] Промывка фильтров буфером удаляет несвязанные остатки. лиганды и любые другие присутствующие лиганды, которые способны отмываться от сайтов связывания.[8] Комплексы рецептор-лиганд, присутствующие во время промывки фильтра, не будут диссоциировать в значительной степени, потому что они будут полностью захвачены фильтрами.[8] Характеристики фильтра важны для каждой выполняемой работы. Более толстый фильтр полезен для более полного восстановления мелких частиц мембраны, но может потребовать более длительного времени промывки.[8] Рекомендуется предварительно обработать фильтры, чтобы улавливать отрицательно заряженные части мембраны.[8] Погрузка фильтра в раствор, который придаст фильтру положительный поверхностный заряд, привлечет отрицательно заряженные фрагменты мембраны.[8]
Связывание ячеек в реальном времени
В этом типе анализа за связыванием лиганда с клетками следят во времени. Полученный сигнал пропорционален количеству лигандов, связанных с целевой структурой, часто с рецептором, на поверхности клетки. Информация о взаимодействии лиганд-мишень получается из изменения сигнала во времени и кинетических параметров, таких как константа скорости ассоциации kа, константа скорости диссоциации kd и сродство KD можно рассчитать.[21] При измерении взаимодействия непосредственно на клетках не требуется выделения целевого белка, что в противном случае может быть проблематичным, особенно для некоторых мембранных белков.[22] Чтобы гарантировать, что взаимодействие с намеченной структурой-мишенью измеряется, рекомендуются соответствующие биологические средства контроля, такие как клетки, не экспрессирующие целевую структуру.
Измерения в реальном времени с использованием подходов без меток или на основе меток использовались для анализа биомолекулярных взаимодействий на фиксированных или живых клетках.[23][24]
Преимущество измерения взаимодействий лиганд-рецептор в режиме реального времени состоит в том, что для точного определения аффинности не требуется достигать равновесия связывания.[25]
Специфичность связывания
Действие лекарства - результат их селективность связывания с макромолекула свойства организма или сродство, с которым различные лиганды связываются с субстратом.[26] В частности, специфичность и избирательность лиганд к соответствующему рецептору дает исследователям возможность изолировать и производить определенные лекарственные эффекты путем манипулирования концентрацией лиганда и плотностью рецептора.[26] Гормоны и нейротрансмиттеры являются важными эндогенными регуляторными лигандами, которые влияют на физиологические рецепторы в организме.[26] Лекарства, которые действуют на эти рецепторы, невероятно избирательны, чтобы вызывать требуемые ответы от сигнальных молекул.[26]
Специфическое связывание относится к связыванию лиганда с рецептором, и возможно, что существует более одного сайта специфического связывания для одного лиганда.[27] Неспецифическое связывание относится к связыванию лиганда с чем-то другим, кроме назначенного ему рецептора, таким как различные другие рецепторы или различные типы переносчиков в клеточной мембране.[27] Например, различные антагонисты могут связываться с рецепторами нескольких типов. В случае мускариновых антагонистов они также могут связываться с рецепторами гистамина.[27] Такие модели связывания технически считаются специфическими, поскольку назначение лиганда специфично для множества рецепторов. Однако исследователи могут не сосредотачиваться на таком поведении по сравнению с другими связывающими факторами.[27] Тем не менее, неспецифическое связывание - очень важная информация, которую необходимо получить. Эти оценки измеряются путем изучения того, как лиганд связывается с рецептором, одновременно реагируя на замещающий агент (антагонист), который предотвращает специфическое связывание.[27]
Специфические типы связывания с лигандом и рецептором взаимодействий:[26]
| Имитирует эндогенные эффекты | Подавляет эндогенные эффекты |
|---|---|
| Агонист | Антагонист |
| Частичный агонист | Отрицательные антагонисты (см .: Обратный агонист ) |
Технический прогресс
Технологии анализа связывания лигандов продолжают развиваться в связи с увеличением скорости и сохранением экономичных процедур при сохранении и повышении точности и чувствительности.[9] Некоторые технологические достижения включают новые связывающие реагенты в качестве альтернативы антителам.[9] альтернативные растворы красителей и системы микропланшетов, а также разработка метода пропуска стадии фильтрации, которая требуется во многих процессах анализа связывания лиганда.[13]
Важной сигнальной молекулой в клетках является Кальций, (Ca2+), который можно обнаружить с помощью Флуо-4 ацетоксиметиловый краситель. Он связывается со свободным Ca2+ ионы, которые, в свою очередь, немного увеличивают флуоресценцию Fluo-4 AM.[13] Недостатком состава красителя Fluo-4 является то, что требуется стадия промывки для удаления внеклеточного красителя, который может давать нежелательные фоновые сигналы. Например, мытье создает дополнительную нагрузку на клетки, а также требует времени, что препятствует своевременному анализу.[13]Недавно был разработан альтернативный раствор красителя и система микропланшетов под названием FLIPR® (флюорометрический считыватель планшетов), в котором используется реагент для анализа на кальций 3, который не требует стадии промывки. В результате изменение флуоресценции красителя можно наблюдать в режиме реального времени без задержки с помощью возбуждающего лазера и устройство с зарядовой связью.[13]
Многие анализы связывания лигандов перед скринингом требуют стадии фильтрации для разделения связанных и несвязанных лигандов. Метод под названием Сцинтилляционный анализ близости (SPA) была недавно разработана, что исключает этот важный шаг. Он работает через шарики кристаллической решетки, которые покрыты связующими лигандами молекулами и заполнены церий ионы. При стимуляции изотопом они испускают вспышки света, которые легко измерить. Лиганды метят радиоактивным изотопом с использованием 3H или 125I и вводят в анализ. Поскольку только радиолиганды, которые непосредственно связываются с шариками, инициируют сигнал, свободные лиганды не мешают во время процесса скрининга.[13]
Ограничения
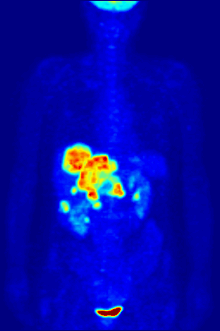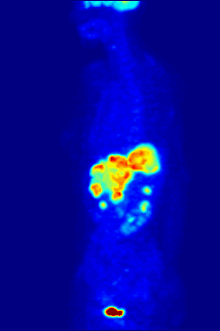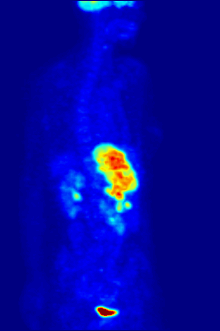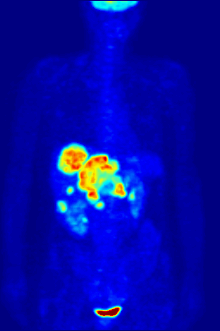
По своей природе анализы должны проводиться в контролируемой среде in vitro, поэтому этот метод не дает информации о связывании рецепторов in vivo. Полученные результаты могут только подтвердить, что конкретный лиганд подходит рецептору, но анализы не дают возможности узнать распределение лиганд-связывающих рецепторов в организме.
Связывание лиганда и распределение рецепторов in vivo можно изучить с помощью Позитронно-эмиссионная томография (ПЭТ), который работает путем индукции радионуклида в лиганд, который затем попадает в организм исследуемого организма. Радиоактивно меченые лиганды пространственно локализуются с помощью ПЭТ-сканера для выявления участков в организме с высокими концентрациями рецепторов.[13]
Смотрите также
Рекомендации
- ^ Luckey JA, Drossman H, Kostichka T, Smith LM (1993). «Высокоскоростное секвенирование ДНК методом капиллярного гель-электрофореза». Методы в энзимологии. 218 (12): 154–72. Дои:10.1016/0076-6879(93)18014-4. ISBN 9780121821197. PMID 8510530.
- ^ Нинфа А.Дж., Баллоу Д.П., Бенор М., ред. (2010). Фундаментальные лабораторные подходы к биохимии и биотехнологии. Дирборн, Мичиган: Мичиганский университет.
- ^ Муллис КБ, Фалуна Ф.А. (1987). «Специфический синтез ДНК in vitro с помощью цепной реакции, катализируемой полимеразой». Методы в энзимологии. 155 (21): 335–50. Дои:10.1016/0076-6879(87)55023-6. PMID 3431465.
- ^ Sittampalam GS, Kahl SD, Janzen WP (октябрь 1997 г.). «Высокопроизводительный скрининг: достижения в области технологий анализа». Современное мнение в области химической биологии. 1 (3): 384–91. Дои:10.1016 / S1367-5931 (97) 80078-6. PMID 9667878.
- ^ а б c d е ж грамм час я j k л м п о п q р де Йонг Л.А., Угес Д.Р., Франке Дж. П., Бишофф Р. (декабрь 2005 г.). «Анализы связывания рецептор-лиганд: технологии и приложения». Журнал хроматографии. B, Аналитические технологии в биомедицине и науках о жизни. 829 (1–2): 1–25. Дои:10.1016 / j.jchromb.2005.10.002. PMID 16253574.
- ^ Джозеф Р. Лакович. (1991) Темы флуоресцентной спектроскопии: биохимические приложения.
- ^ а б c d е ж грамм час я j Давенпорт А.П., Рассел Ф.Д. (1996). «Анализы связывания радиолиганда: теория и практика». В Стивене Дж. Мазере (ред.). Актуальные направления радиофармацевтических исследований и разработок. Springer Нидерланды. С. 169–179. ISBN 978-94-010-7289-2.
- ^ а б c d е ж грамм Hulme EC, Trevethick MA (ноябрь 2010 г.). «Анализ связывания лиганда в равновесии: проверка и интерпретация». Британский журнал фармакологии. 161 (6): 1219–37. Дои:10.1111 / j.1476-5381.2009.00604.x. ЧВК 3000649. PMID 20132208.
- ^ а б c d е ж грамм час Хан MN, Findlay JW, ред. (2009). Разработка, валидация и внедрение анализов связывания лигандов в области разработки лекарственных препаратов. Хобокен, штат Нью-Джерси: John Wiley & Sons. ISBN 978-0470541494.
- ^ а б Pollard TD (декабрь 2010 г.). «Руководство по простым и информативным тестам связывания». Молекулярная биология клетки. 21 (23): 4061–7. Дои:10.1091 / mbc.e10-08-0683. ЧВК 2993736. PMID 21115850.
- ^ Offermanns S, Walter Rosenthal, ред. (2008). Энциклопедия молекулярной фармакологии (2-е изд.). Берлин: Springer. п. 585. ISBN 9783540389163.
- ^ а б c Каль С.Д., Ситтампалам Г.С., Вайднер Дж. (Май 2012 г.). «Расчеты и приборы, используемые для анализов связывания радиолигандов». Руководство по проведению анализа: 1–21. PMID 22553868.
- ^ а б c d е ж грамм час я Давенпорт AP (2005). Методы связывания рецепторов. Humana Press. С. 18–19, 101–102, 121–122, 203–204. ISBN 978-1-58829-420-3.
- ^ а б c Голдсби Р.А. (2003). Иммунология (5e изд. Ред.). Нью-Йорк: У. Х. Фриман. п.152. ISBN 978-0716749479.
- ^ а б «Техническое руководство и протоколы иммунопреципитации (IP)» (PDF). Thermo Fisher Scientific Inc. Архивировано с оригинал (PDF) 24 марта 2014 г.. Получено 20 марта 2014.
- ^ а б c d е ж Робинсон С.Дж., Садик М., Деминг С.Н., Эстдейл С., Бергельсон С., Литтл Л. (январь 2014 г.). «Критерии приемлемости анализа для тестов биологической активности на основе многолуночных планшетов». BioProcess International. 12 (1): 30–41.
- ^ «SIMAG Basic: Магнитные нано и микрочастицы».
- ^ «SIMAG Affinity: магнитные нано- и микрочастицы от Chemicell».
- ^ "На главную - Accelero® Bioanalytics GMBH".
- ^ Мосс Т., изд. (2001). «Анализы связывания с фильтром». ДНК-белковые взаимодействия: принципы и протоколы (2-е изд.). Тотова, Нью-Джерси: Humana Press. С. 1–12. ISBN 9780896036710.
- ^ Бондза С., Фой Е., Брукс Дж., Андерссон К., Робинсон Дж., Ришале П., Буйс Дж. (2017). «Характеристика связывания антител с рецепторами на живых иммунных клетках в реальном времени». Границы иммунологии. 8: 455. Дои:10.3389 / fimmu.2017.00455. ЧВК 5401896. PMID 28484455.
- ^ Смит С.М. (2011). «Стратегии очистки мембранных белков». Хроматография белков. Методы молекулярной биологии. 681. Humana Press. С. 485–96. Дои:10.1007/978-1-60761-913-0_29. HDL:2262/72470. ISBN 9781607619123. PMID 20978985.
- ^ Ван В., Инь Л., Гонсалес-Малерва Л., Ван С., Ю Х, Итон С. и др. (Октябрь 2014 г.). «Кинетика связывания лекарственного средства с рецептором in situ в отдельных клетках: количественное исследование устойчивости к противоопухолевым лекарственным средствам без меток». Научные отчеты. 4 (1): 6609. Bibcode:2014НатСР ... 4E6609W. Дои:10.1038 / srep06609. ЧВК 4196117. PMID 25312029.
- ^ Бьоркелунд Х, Гедда Л., Барта П., Мальмквист М., Андерссон К. (12 сентября 2011 г.). «Гефитиниб индуцирует димеры рецепторов эпидермального фактора роста, которые изменяют характеристики взаимодействия с ²⁵I-EGF». PLOS ONE. 6 (9): e24739. Bibcode:2011PLoSO ... 624739B. Дои:10.1371 / journal.pone.0024739. ЧВК 3171474. PMID 21931838.
- ^ Xu B, Varasteh Z, Orlova A, Andersson K, Larhammar D, Björkelund H (ноябрь 2013 г.). «Обнаружение взаимодействий лиганда с рецепторами, связанными с G-белком, в реальном времени на живых клетках». Сообщения о биохимических и биофизических исследованиях. 441 (4): 820–4. Дои:10.1016 / j.bbrc.2013.10.149. PMID 24211197.
- ^ а б c d е Гудман и Гилман: Фармакологические основы терапии. McGraw Hill Companies Inc., 1996. С. 29–37. ISBN 978-0-07-026266-9.
- ^ а б c d е Хейлетт Д.Г. (2003). «Прямое измерение связывания лекарств с рецепторами». В Foreman JC, Johansen T (ред.). Учебник рецепторной фармакологии (Второе изд.). Бока-Ратон, Флорида: CRC L.L.C. С. 153–180. ISBN 978-0849310294.

