Минимальная ингибирующая концентрация - Minimum inhibitory concentration
В микробиология, то минимальная ингибирующая концентрация (MIC) - самая низкая концентрация химического вещества, обычно лекарственного средства, которое предотвращает появление видимых рост бактерии или бактерии. МИК зависит от микроорганизма, пораженного человека (только in vivo) и самого антибиотика.[1] Часто выражается в микрограммах на миллилитр (мкг / мл) или миллиграммах на литр (мг / л).
МИК определяется путем приготовления растворов химического in vitro при возрастающих концентрациях, инкубируя растворы с отдельными партиями культивируемых бактерий и измеряя результаты с помощью разведение агара или же микроразбавление бульона. Результаты были разделены на чувствительные (часто называемые чувствительными), промежуточные или устойчивые к определенному противомикробному препарату с использованием контрольной точки. Точки останова - это согласованные значения, опубликованные в рекомендациях справочного органа, такого как США. Институт клинических и лабораторных стандартов (CLSI), Британское общество антимикробной химиотерапии (BSAC) или Европейского комитета по тестированию чувствительности к противомикробным препаратам (EUCAST).[2] На протяжении многих лет наблюдались серьезные расхождения между контрольными точками в различных европейских странах, а также между контрольными точками Европейского комитета по тестированию на чувствительность к противомикробным препаратам (EUCAST) и Института клинических и лабораторных стандартов США (CLSI).[3]
Хотя МИК является самой низкой концентрацией антибактериального агента, необходимой для подавления видимого роста, минимальная бактерицидная концентрация (МБК) - минимальная концентрация антибактериального агента, приводящая к гибели бактерий. Чем ближе МИК к МБК, тем бактерициднее соединение.[4]
Первый шаг в открытие лекарств часто является скринингом библиотеки-кандидата в лекарственное средство на предмет выявления МПК против представляющих интерес бактерий.[5] Таким образом, МПК обычно являются отправной точкой для более масштабных доклинических оценок новых противомикробных средств.[6] Цель измерения минимальной ингибирующей концентрации - убедиться, что антибиотики выбраны эффективно для повышения эффективности лечения.
Фон
История
После открытия и коммерциализации антибиотиков микробиолог, фармаколог и врач Александр Флеминг разработали методику разбавления бульона, используя для оценки мутность бульона.[7] Это обычно считается точкой зарождения минимальных ингибирующих концентраций.[8] Позже, в 1980-х, Институт клинических и лабораторных стандартов объединил методы и стандарты для определения МИК и клинического использования. После открытия новых антибактериальных средств, патогенов и их эволюции протоколы CLSI также постоянно обновляются, чтобы отразить эти изменения.[9] Протоколы и параметры, установленные CLSI, считаются «золотым стандартом» в Соединенных Штатах и используются регулирующими органами, такими как FDA, для проведения оценок.[10]
Клиническое использование
В настоящее время МПК используется для определения чувствительности к противомикробным препаратам. МИК указывается путем предоставления интерпретации чувствительности рядом с каждым антибиотиком. Существуют разные интерпретации восприимчивости: S (чувствительная), I (средняя) и R (устойчивая). Эти интерпретации были созданы и внедрены Институтом клинических и лабораторных стандартов (CLSI). В клиниках чаще всего нелегко определить точные возбудители по симптомам пациента. Тогда, даже если возбудитель определен, разные серотипы патогенов, таких как Золотистый стафилококк, имеют разный уровень устойчивости к противомикробным препаратам. Таким образом, трудно назначить правильные противомикробные препараты.[11] В таких случаях MIC определяется путем выращивания изолята патогена от пациента на чашке или бульоне, который позже используется в анализе.[12] Таким образом, знание МПК предоставит врачу ценную информацию для выписки рецепта. Точное и точное использование противомикробных препаратов также важно в контексте бактерий с множественной лекарственной устойчивостью. Микробы, такие как бактерии, приобрели устойчивость к противомикробным препаратам, к которым они ранее были восприимчивы.[13] Использование несовместимых уровней противомикробных препаратов обеспечивает давление отбора, которое определяет направление и эволюцию устойчивости бактериальных патогенов.[14] Это было замечено при уровнях антибиотиков ниже МПК.[15] Таким образом, становится все более важным определить МПК, чтобы сделать лучший выбор при назначении противомикробных препаратов.
МИК используется клинически по сравнению с МБК, потому что МИК легче определить.[9] Минимальная бактерицидная концентрация (МБК), которая представляет собой минимальную антибактериальную концентрацию, приводящую к гибели микробов, определяется невозможностью повторного культивирования бактерий. Кроме того, эффективность лекарственного средства обычно схожа при приеме как в концентрациях MIC, так и в концентрации MBC, поскольку иммунная система хозяина может изгнать патоген, когда размножение бактерий остановлено.[16] Когда МБК намного выше, чем МПК, токсичность лекарственного средства делает прием МБК лекарственного средства вредным для пациента. Противомикробная токсичность может проявляться во многих формах, например, при иммунной гиперчувствительности и нецелевой токсичности.[17]
Методы
Анализ разбавления бульона
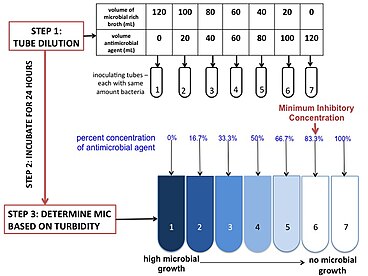
Есть три основных реагенты необходимые для проведения этого анализа: среда, антимикробный агент и тестируемый микроб. Наиболее часто используемой средой является бульон Мюллера-Хинтона с поправкой на катионы из-за его способности поддерживать рост большинства патогенов и отсутствия ингибиторов обычных антибиотиков.[18] В зависимости от исследуемого патогена и антибиотиков среду можно менять и / или регулировать. Концентрация противомикробного препарата доводится до нужной концентрации путем смешивания исходного антимикробного средства со средой. Скорректированный антимикробный препарат серийно разбавленный в несколько пробирок (или лунок) для получения градиента. Степень разведения можно регулировать в зависимости от точки останова и потребностей практикующего врача. Микроб или инокулянт должен происходить из одной колониеобразующей единицы и иметь правильную концентрацию. Это может быть скорректировано временем инкубации и разбавлением. Для проверки положительный контроль помещают в 100-кратное разведение для подсчета колониеобразующих единиц. Микробы инокулируют в пробирки (или планшет) и инкубируют в течение 16–20 часов. МИК обычно определяется по мутности.[18]
Etest

Etests также может использоваться в качестве альтернативного метода для определения минимальных значений ингибирующей концентрации широкого спектра противомикробных агентов против различных групп организмов, который широко используется в микробиологических лабораториях по всему миру. Изготовлены по bioMérieux, Etests - это готовые к использованию непористые пластиковые полоски с реагентами с заранее заданным градиентом антибиотика, охватывающие непрерывный диапазон концентраций.[19]
Смотрите также
Рекомендации
- ^ Маккиннон П.С., Дэвис С.Л. (апрель 2004 г.). «Фармакокинетические и фармакодинамические вопросы в лечении бактериальных инфекционных заболеваний». Европейский журнал клинической микробиологии и инфекционных заболеваний. 23 (4): 271–88. Дои:10.1007 / s10096-004-1107-7. PMID 15015030.
- ^ Эндрюс Дж. М. (июль 2001 г.). «Определение минимальных ингибирующих концентраций». Журнал антимикробной химиотерапии. 48 Дополнение 1 (приложение 1): 5–16. Дои:10.1093 / jac / 48.suppl_1.5. PMID 11420333.
- ^ Диен С.М., Абат С., Ролайн Дж. М., Рауль Д. (июль 2017 г.). «Насколько искусственно определение устойчивости к антибиотикам?». Ланцетные инфекционные болезни. 17 (7): 690. Дои:10.1016 / S1473-3099 (17) 30338-9. PMID 28653629.
- ^ Трипати К.Д. (2013). Основы медицинской фармакологии (7-е изд.). Нью-Дели, Индия: издательство Jaypee Brothers Medical. С. 696, 697. ISBN 9789350259375.
- ^ Тернидж Дж. Д., Ферраро М. Дж., Йоргенсен Дж. Х. (2003). «Методы испытаний на чувствительность: общие соображения». В Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH (ред.). Руководство по клинической микробиологии (8-е изд.). Вашингтон: Американское общество клинической микробиологии. п. 1103. ISBN 1-55581-255-4.
- ^ О'Нил AJ, Чопра I (август 2004 г.). «Доклиническая оценка новых антибактериальных средств микробиологическими и молекулярными методами». Заключение эксперта по исследуемым препаратам. 13 (8): 1045–63. Дои:10.1517/13543784.13.8.1045. PMID 15268641. S2CID 24016698.
- ^ Флеминг А. (1944). Об антибактериальном действии культур пенициллов с особым упором на их использование для изоляции B. influenzae. H.K. Льюис. OCLC 25424051.
- ^ Пшеничный ПФ (июль 2001 г.). «История и развитие методологии определения чувствительности к противомикробным препаратам». Журнал антимикробной химиотерапии. 48 Suppl 1 (Suppl_1): 1–4. Дои:10.1093 / jac / 48.suppl_1.1. PMID 11420332.
- ^ а б Кокерилл FR (2012). Методы разведения тестов на чувствительность к противомикробным препаратам для бактерий, которые растут в аэробных условиях: утвержденный стандарт (9-е изд.). Уэйн, Пенсильвания: Институт клинических и лабораторных стандартов. ISBN 978-1562387846. OCLC 1016466655.
- ^ Кокерилл Ф (2012). Стандарты эффективности тестирования на чувствительность к противомикробным препаратам: двадцать второе информационное приложение. Уэйн, Пенсильвания: Институт клинических и лабораторных стандартов. ISBN 978-1562387853. OCLC 795927370.
- ^ Кэмерон Д.Р., Хауден Б.П., Пелег А.Ю. (сентябрь 2011 г.). «Взаимодействие между устойчивостью к антибиотикам и вирулентностью у Staphylococcus aureus и его влияние на клинические исходы». Клинические инфекционные болезни. 53 (6): 576–82. Дои:10.1093 / cid / cir473. PMID 21865195.
- ^ Schwalbe R, Стил-Мур L, Goodwin AC (2007). Протоколы тестирования на чувствительность к противомикробным препаратам. Бока-Ратон: CRC Press. ISBN 9781420014495. OCLC 666899344.
- ^ Всемирная организация здравоохранения (2015-12-15). Глобальная система эпиднадзора за устойчивостью к противомикробным препаратам: руководство для скорейшего внедрения. Всемирная организация здоровья. Женева, Швейцария. ISBN 978-9241549400. OCLC 950637154.
- ^ Гейзингер Э., Исберг Р.Р. (февраль 2017 г.). «Взаимодействие между устойчивостью к антибиотикам и вирулентностью во время заболевания, вызываемого бактериями с множественной лекарственной устойчивостью». Журнал инфекционных болезней. 215 (Suppl_1): S9 – S17. Дои:10.1093 / infdis / jiw402. ЧВК 5853982. PMID 28375515.
- ^ Гуллберг Э., Цао С., Берг О.Г., Ильбек К., Сандегрен Л., Хьюз Д., Андерссон Д.И. (июль 2011 г.). «Отбор устойчивых бактерий при очень низких концентрациях антибиотиков». PLoS Патогены. 7 (7): e1002158. Дои:10.1371 / journal.ppat.1002158. ЧВК 3141051. PMID 21811410.
- ^ Галлахер Дж.С. (21 ноября 2016 г.). Антибиотики упрощены. ISBN 9781284111293. OCLC 952657550.
- ^ Guengerich FP (2011). «Механизмы токсичности лекарств и актуальность для фармацевтических разработок». Метаболизм и фармакокинетика лекарств. 26 (1): 3–14. Дои:10.2133 / дмпк.DMPK-10-RV-062. ЧВК 4707670. PMID 20978361.
- ^ а б Кокерилл Ф (2015). Методы разведения тестов на чувствительность к противомикробным препаратам для бактерий, которые растут в аэробных условиях: утвержденный стандарт (Десятое изд.). Уэйн, Пенсильвания: Институт клинических и лабораторных стандартов. ISBN 978-1562387839. OCLC 932608948.
- ^ "ЭТЕСТ". bioMérieux. Получено 2019-04-23.
