Устойчивость к лекарству - Drug resistance
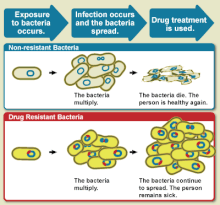
Устойчивость к лекарству снижение эффективности лекарства, такого как противомикробный или противоопухолевый в лечении болезнь или состояние.[1] Этот термин используется в контексте сопротивления, которое патогены или рак «приобрел», то есть резистентность развилась. Устойчивость к противомикробным препаратам и противоопухолевое сопротивление бросить вызов клинической помощи и стимулировать исследования. Когда организм устойчив к более чем одному лекарству, говорят, что он множественная лекарственная устойчивость.
Развитие устойчивости к антибиотикам, в частности, происходит из-за лекарств, нацеленных только на определенные бактериальные молекулы (почти всегда на белки). Потому что препарат так В частности, любая мутация в этих молекулах будет препятствовать или сводить на нет их деструктивный эффект, что приводит к устойчивости к антибиотикам.[2] Кроме того, растет озабоченность по поводу злоупотребления антибиотиками в животноводстве, что в Евросоюз только на его долю приходится в три раза больше, чем у человека, что приводит к развитию сверхустойчивых бактерий.[3][4]
Бактерии способны не только изменять фермент, на который нацелены антибиотики, но также использовать ферменты для модификации самого антибиотика и, таким образом, нейтрализовать его. Примеры патогенов, изменяющих цель: Золотистый стафилококк, устойчивый к ванкомицину энтерококки устойчивы к макролидам Стрептококк, а примерами микробов, модифицирующих антибиотики, являются Синегнойная палочка и устойчивые к аминогликозидам Acinetobacter baumannii.[5]
Короче говоря, отсутствие согласованных усилий со стороны правительств и фармацевтической промышленности вместе с врожденной способностью микробов развивать резистентность со скоростью, опережающей разработку новых лекарств, предполагает, что существующие стратегии для разработки жизнеспособных, долгосрочных антимикробных препаратов в конечном итоге обречены на провал. Без альтернативных стратегий приобретение лекарственной устойчивости патогенными микроорганизмами может стать, возможно, одной из самых серьезных угроз общественному здоровью, с которыми сталкивается человечество в 21 веке.[6]
Типы
Устойчивость к лекарствам, токсинам или химическим веществам является следствием эволюция и является ответом на давление, оказываемое на любой живой организм. Отдельные организмы различаются по своей чувствительности к используемому препарату, а некоторые имеют большую фитнес может выжить после лечения наркотиками. Соответственно, признаки лекарственной устойчивости наследуются последующим потомством, в результате чего популяция становится более устойчивой к лекарствам. Если применяемый препарат не способствует половому размножению или деление клеток или горизонтальный перенос генов невозможно во всей целевой популяции, неизбежно последует резистентность к препарату. Это можно увидеть в раковый опухоли, в которых некоторые клетки могут развить устойчивость к лекарствам, используемым в химиотерапия.[7] Причины химиотерапии фибробласты возле опухоли производить большое количество белка WNT16B. Этот белок стимулирует рост раковых клеток, устойчивых к лекарствам.[8] МикроРНК также было показано, что они влияют на приобретенную лекарственную устойчивость раковых клеток, и это может быть использовано в терапевтических целях.[9] Малярия в 2012 году вновь стала угрозой в Юго-Восточная Азия и К югу от Сахары, и лекарственно-устойчивые штаммы Плазмодий falciparum создают огромные проблемы для органов здравоохранения.[10][11] Проказа проявил растущее сопротивление дапсон.
Существует быстрый процесс разделения сопротивления между одноклеточные организмы, и называется горизонтальным переносом генов, при котором происходит прямой обмен генами, особенно в биопленка штат.[12] Аналогичный асексуальный метод используют грибы и называется "парасексуальность ". Примеры устойчивых к лекарственным средствам штаммов можно найти у микроорганизмов.[13] такие как бактерии и вирусы, паразиты и эндо- и экто-, растения, грибы, членистоногие,[14][15] млекопитающие[16] птицы[17] рептилии[18] рыбы и земноводные.[18]
В домашних условиях устойчивые к лекарствам штаммы организмов могут возникать в результате, казалось бы, безопасных действий, таких как использование отбеливатель,[19] чистка зубов и полоскание рта,[20] использование антибиотиков, дезинфицирующих и моющих средств, шампуни, и мыло, особенно антибактериальное мыло,[21][22] мытье рук,[23] поверхностные спреи, нанесение дезодоранты, солнцезащитные кремы а также любые косметические или медицинские продукты, инсектициды, и провалы.[24] Химические вещества, содержащиеся в этих препаратах, помимо вреда для полезных организмов, могут преднамеренно или непреднамеренно нацеливаться на организмы, у которых может развиться резистентность.[25]
Механизмы
Четыре основных механизма устойчивости микроорганизмов к противомикробным препаратам:[26][27]
- Инактивация или модификация лекарственного средства: например, ферментативная дезактивация Пенициллин грамм у некоторых устойчивых к пенициллину бактерий за счет производства β-лактамазы.
- Изменение целевого сайта: например, изменение PBP - целевой сайт связывания пенициллинов - в MRSA и другие устойчивые к пенициллину бактерии.
- Нарушение метаболического пути: например, некоторые сульфонамид -резистентные бактерии не требуют парааминобензойная кислота (ПАБК), важный прекурсор для синтеза фолиевая кислота и нуклеиновые кислоты в бактериях ингибируется сульфаниламидами. Вместо этого, как и клетки млекопитающих, они обращаются к использованию предварительно образованной фолиевой кислоты.
- Уменьшение накопления лекарства: за счет уменьшения количества лекарства проницаемость и / или увеличение активности отток (откачка) лекарств через поверхность клетки.
Механизмы приобретенной лекарственной устойчивости:[28]
| Механизм | Противомикробный агент | Действие препарата | Механизм сопротивления |
|---|---|---|---|
| Уничтожить наркотик | Аминогликозид Бета-лактамные антибиотики (пенициллин и цефалоспорин) Хлорамфеникол | Связывается с субъединицей 30S рибосомы, подавляя синтез белка. Связывается с пенициллин-связывающими белками, подавляя синтез пептидогликана. Связывается с субъединицей 50S рибосомы, подавляя образование пептидных связей | Плазмида кодирует ферменты, которые химически изменяют лекарство (например, путем ацетилирования или фосфорилирования), тем самым инактивируя его. Плазмиды кодируют бета-лактамазы, которые открывают бета-лактамное кольцо, инактивируя его. Плазмида кодирует фермент, который ацетилирует лекарство, тем самым инактивируя его. |
| Изменяет цель препарата | Аминогликозиды Бета-лактамные антибиотики (пенициллин и цефалоспорин) Эритромицин Хинолоны Рифампицин Триметоприм | Связывается с субъединицей 30S рибосомы, подавляя синтез белка. Связывается с пенициллин-связывающими белками, подавляя синтез пептидогликана. Связывается с 50S субъединицей рибосомы, подавляя синтез белка. Связывается с ДНК-топоизомеразой, ферментом, необходимым для синтеза ДНК. Связывается с РНК-полимеразой; подавление инициации синтеза РНК Подавляет фермент дигидрофолат, снижает, блокируя путь фолиевой кислоты | Бактерии создают измененные рибосомы 30S, которые не связываются с лекарством. Бактерии вырабатывают измененные связывающие пенициллин белки, которые не связываются с лекарством. Бактерии образуют форму 50S рибосомы, которая не связывается с лекарством. Бактерии производят измененную ДНК-топоизомеразу, которая не связывается с лекарством. Бактерии вырабатывают измененную полимеразу, которая не связывается с лекарством. Бактерии вырабатывают измененный фермент, который не связывается с лекарством. |
| Подавляет поступление лекарства или удаляет лекарство | Пенициллин Эритромицин Тетрациклин | Связывается с пенициллин-связывающими белками, подавляя синтез пептидогликана. Связывается с 50S субъединицей рибосомы, подавляя синтез белка. Связывается с субъединицей 30S рибосомы, подавляя синтез белка, блокируя тРНК | Бактерии изменяют форму пориновых белков внешней мембраны, предотвращая попадание лекарства в клетку. Новая мембранная транспортная система предотвращает попадание лекарства в клетку. Новая мембранная транспортная система выкачивает лекарство из клетки. |
Метаболическая стоимость
Биологическая стоимость является мерой возросшего энергетический обмен требуется для выполнения функции.
Устойчивость к лекарствам имеет высокую метаболическую цену[30] патогенами, для которых актуально это понятие (бактерии,[31] эндопаразиты и опухолевые клетки.) В вирусах эквивалентной «стоимостью» является геномная сложность. Высокая метаболическая стоимость означает, что в отсутствие антибиотиков устойчивый патоген будет иметь меньшую эволюционную пригодность по сравнению с чувствительными патогенами.[32] Это одна из причин, по которой адаптация к лекарственной устойчивости редко наблюдается в условиях отсутствия антибиотиков. Однако в присутствии антибиотиков преимущество в выживаемости компенсирует высокие метаболические затраты и позволяет устойчивым штаммам размножаться.
Уход
У человека ген ABCB1 кодирует MDR1 (p-гликопротеин) который является ключевым переносчиком лекарств на клеточном уровне. Если MDR1 сверхэкспрессируется, устойчивость к лекарствам возрастает.[33] Следовательно, можно контролировать уровни ABCB1.[33] У пациентов с высоким уровнем экспрессии ABCB1 вторичные методы лечения, такие как метформин, с некоторым успехом применялись в сочетании с первичным медикаментозным лечением.[33]
За устойчивость к антибиотикам, что представляет собой широко распространенную в настоящее время проблему, используются препараты, предназначенные для блокирования механизмов устойчивости бактерий к антибиотикам. Например, устойчивость бактерий к бета-лактамные антибиотики (такие как пенициллин и цефалоспорины ) можно обойти с помощью антибиотиков, таких как нафциллин которые не поддаются разрушению определенными бета-лактамазы (группа ферментов, ответственных за расщепление бета-лактамов).[34] С резистентностью к бета-лактамным бактериям также можно бороться, назначая бета-лактамные антибиотики с лекарствами, блокирующими бета-лактамазы, такими как клавулановая кислота так что антибиотики могут работать, не будучи уничтоженными бактериями.[35] Недавно исследователи признали необходимость в новых лекарствах, подавляющих насосы для удаления бактерий, которые вызывают устойчивость к нескольким антибиотикам, таким как бета-лактамы, хинолоны, хлорамфеникол, и триметоприм отправляя молекулы этих антибиотиков из бактериальной клетки.[36][37] Иногда комбинация антибиотиков разных классов может использоваться синергетически; то есть они работают вместе, чтобы эффективно бороться с бактериями, которые могут быть устойчивы только к одному из антибиотиков.[38]
Уничтожение стойких бактерии также может быть достигнуто фаговая терапия, в котором конкретный бактериофаг (вирус, убивающий бактерии).[39]
Смотрите также
- Устойчивость к антибиотикам
- Фекальная бактериотерапия
- Массовое введение лекарств
- Множественная лекарственная устойчивость
- Фармакоэпидемиология
- Физические факторы, влияющие на микробную жизнь
- Малый белок множественной лекарственной устойчивости
- Элефтерия терра
Рекомендации
- ^ Альфарук, нокаут; Шток, см; Тейлор, S; Уолш, М; Муддатир, AK; Verduzco, D; Башир, АХ; Mohammed, OY; Эльхассан, GO; Харгинди, S; Решкин, SJ; Ибрагим, Мэн; Раух, C (2015). «Устойчивость к химиотерапии рака: отсутствие лекарственного ответа от ADME на P-gp». Cancer Cell International. 15: 71. Дои:10.1186 / s12935-015-0221-1. ЧВК 4502609. PMID 26180516.
- ^ «Устойчивость к антибиотикам и эволюция». Detectingdesign.com.[требуется проверка ]
- ^ Харви, Фиона (16 октября 2016 г.). «Использование сильнейших антибиотиков на фермах Европы достигает рекордного уровня». хранитель. Получено 1 октября 2018.[требуется проверка ]
- ^ Дакенфилд, Джоан (30 декабря 2011 г.). «Устойчивость к антибиотикам в связи с современной сельскохозяйственной практикой: этическая перспектива». Журнал сельскохозяйственной и экологической этики. 26 (2): 333–350. Дои:10.1007 / s10806-011-9370-у. ISSN 1187-7863. S2CID 55736918.[требуется проверка ]
- ^ Фишер, Джед Ф .; Mobashery, Shahriar (2010). «Энзимология бактериальной резистентности». Комплексные натуральные продукты II. Том 8: Ферменты и механизмы ферментов. Эльзевир. С. 443–201. Дои:10.1016 / B978-008045382-8.00161-1. ISBN 978-0-08-045382-8.[требуется проверка ]
- ^ "Чтение: феномен устойчивости микробов и переносчиков инфекционных заболеваний: последствия для здоровья человека и стратегии сдерживания - Резюме семинара - The National Academies Press". nap.edu.[требуется проверка ]
- ^ «Толерантность и устойчивость к наркотикам». Руководства Merck для потребителей.
- ^ "Химиотерапия" подрывает себя "через мошенническую реакцию",Новости BBC, 5 августа 2012 г.
- ^ Гасаби М., Мансури Б., Мохаммади А., Дуйф PH, Шомали Н., Ширафкан Н., Мохтарзаде А., Барадаран Б. (2019). «МикроРНК в лекарственной устойчивости рака: основные доказательства и клиническое применение». Журнал клеточной физиологии. Икс (3): 2152–2168. Дои:10.1002 / jcp.26810. PMID 30146724.
- ^ МакГрат, Мэтт (05.04.2012). «Сопротивление распространяет« компрометирующую »борьбу с малярией». Новости BBC.
- ^ Морелль Р. (20 октября 2015 г.). «Малярия с лекарственной устойчивостью может заразить африканских комаров». Новости BBC. Получено 21 октября 2015.
- ^ Молин С., Толкер-Нильсен Т. (июнь 2003 г.). «Перенос генов происходит с повышенной эффективностью в биопленках и вызывает усиленную стабилизацию структуры биопленок». Текущее мнение в области биотехнологии. 14 (3): 255–61. Дои:10.1016 / S0958-1669 (03) 00036-3. PMID 12849777.
- ^ «Механизмы действия и устойчивости лекарств». tulane.edu.
- ^ Брун Л.О., Уилсон Дж. Т., Дэйнес П. (март 1983 г.). «Устойчивость к этиону клещей крупного рогатого скота (Boophilus microplus) в Новой Каледонии» (PDF). Международный журнал борьбы с вредителями. 29 (1): 16–22. Дои:10.1080/09670878309370763.
- ^ «Обзорная статья об устойчивости колорадского картофельного жука к инсектицидам». potatobeetle.org. Получено 1 октября 2018.
- ^ Лунд М (1972). «Устойчивость грызунов к родентицидам-антикоагулянтам, с особым упором на Данию». Бюллетень Всемирной организации здравоохранения. 47 (5): 611–8. ЧВК 2480843. PMID 4540680.
- ^ Шефте Н., Брюггерс Р.Л., Шафер Е.В. (апрель 1982 г.). «Репеллент и токсичность трех химикатов для борьбы с птицами для четырех видов африканских птиц, питающихся зерном». Журнал управления дикой природой. 46 (2): 453–7. Дои:10.2307/3808656. JSTOR 3808656.
- ^ а б "Журнал" Рептилии ", ваш источник статей по уходу за рептилиями и рептилиями, разведению и энтузиастам". reptilechannel.com. Архивировано из оригинал на 2011-01-03.
- ^ «Как бытовой отбеливатель убивает бактерии». Physorg.com.
- ^ "Compete50 Комплексные продукты для ухода за полостью рта". Архивировано из оригинал на 2010-04-03. Получено 2010-07-18.
- ^ "Грязь на чистом: антибактериальное мыло против обычного мыла". CBC Новости. Архивировано из оригинал 6 августа 2011 г.
- ^ "Следует ли объявить антибактериальное мыло вне закона?". Как это работает. 2007-11-07.
- ^ Вебер DJ, Рутала, Вашингтон (октябрь 2006 г.). «Использование бактерицидов в домашних условиях и в медицинских учреждениях: существует ли связь между использованием бактерицидов и устойчивостью к антибиотикам?». Инфекционный контроль и больничная эпидемиология. 27 (10): 1107–19. Дои:10.1086/507964. PMID 17006819. S2CID 20734025.
- ^ Юн К.С., Квон Д.Х., Стрихарз Дж. П., Холлингсворт С.С., Ли С.Х., Кларк Дж.М. (ноябрь 2008 г.). «Биохимический и молекулярный анализ устойчивости к дельтаметрину у обычного постельного клопа (Hemiptera: Cimicidae)». Журнал медицинской энтомологии. 45 (6): 1092–101. Дои:10.1603 / 0022-2585 (2008) 45 [1092: BAMAOD] 2.0.CO; 2. PMID 19058634.
- ^ «Антибактериальные чистящие средства». Австралийский департамент здравоохранения и социальных служб. Архивировано из оригинал 4 марта 2015 г.. Получено 1 октября 2018.
- ^ Ли XZ, Никайдо Х (август 2009 г.). «Опосредованная оттоком лекарственная устойчивость бактерий: обновленная информация». Наркотики. 69 (12): 1555–623. Дои:10.2165/11317030-000000000-00000. ЧВК 2847397. PMID 19678712.
- ^ Sandhu P, Akhter Y (январь 2018 г.). «Эволюция структурной приспособленности и многофункциональные аспекты переносчиков семейства микобактериальных РНД». Архив микробиологии. 200 (1): 19–31. Дои:10.1007 / s00203-017-1434-6. PMID 28951954. S2CID 13656026.
- ^ Кэтрин А. Ингрэм, Джон Л. Ингрэм (2000). Введение в микробиологию второе издание.
- ^ Кэтрин А. Ингрэм, Джон Л. Ингрэм (2000). Введение в микробиологию.
- ^ Гиллеспи Ш., Макхью Т. Д. (сентябрь 1997 г.). «Биологическая стоимость устойчивости к противомикробным препаратам». Тенденции в микробиологии. 5 (9): 337–9. Дои:10.1016 / S0966-842X (97) 01101-3. PMID 9294886.
- ^ Wichelhaus TA, Böddinghaus B, Besier S, Schäfer V, Brade V, Ludwig A (ноябрь 2002 г.). «Биологическая стоимость устойчивости к рифампину с точки зрения Staphylococcus aureus». Противомикробные препараты и химиотерапия. 46 (11): 3381–5. Дои:10.1128 / AAC.46.11.3381-3385.2002. ЧВК 128759. PMID 12384339.
- ^ Гендель, Надин; Schuurmans, J. Merijn; Брюл, Стэнли; тер Куиле, Бенно Х. (август 2013 г.). «Компенсация метаболических затрат устойчивости к антибиотикам за счет физиологической адаптации Escherichia coli». Противомикробные препараты и химиотерапия. 57 (8): 3752–3762. Дои:10.1128 / AAC.02096-12. ISSN 0066-4804. ЧВК 3719774. PMID 23716056.
- ^ а б c Рамос-Пеньяфьель С., Оларте-Каррильо I, Серон-Мальдонадо Р., Розен-Фуллер Э., Кассак-Ипинья Дж. Дж., Мелендес-Майер Дж., Колласо-Халома Дж., Мартинес-Товар А. (сентябрь 2018 г.). «Влияние метформина на выживаемость пациентов с ОЛЛ, которые экспрессируют высокие уровни гена устойчивости к лекарствам ABCB1». Журнал трансляционной медицины. 16 (1): 245. Дои:10.1186 / s12967-018-1620-6. ЧВК 6122769. PMID 30176891.
- ^ Барбер М., Уотеруорт П.М. (август 1964 г.). «Пенициллиназарезистентные пенициллины и цефалоспорины». Британский медицинский журнал. 2 (5405): 344–9. Дои:10.1136 / bmj.2.5405.344. ЧВК 1816326. PMID 14160224.
- ^ Буш К. (январь 1988 г.). «Ингибиторы бета-лактамаз из лаборатории в клинику». Обзоры клинической микробиологии. 1 (1): 109–23. Дои:10.1128 / CMR.1.1.109. ЧВК 358033. PMID 3060240.
- ^ Уэббер М.А., Пиддок Л.Дж. (январь 2003 г.). «Важность оттокных насосов в устойчивости бактерий к антибиотикам». Журнал антимикробной химиотерапии. 51 (1): 9–11. Дои:10.1093 / jac / dkg050. PMID 12493781.
- ^ Тегос Г.П., Хейнс М., Страус Дж.Дж., Хан М.М., Болога К.Г., Опреа Т.И., Скляр Л.А. (2011). «Ингибирование микробного оттока: тактика и стратегия». Текущий фармацевтический дизайн. 17 (13): 1291–302. Дои:10.2174/138161211795703726. ЧВК 3717411. PMID 21470111.
- ^ Глю Р. Х., Миллеринг Р. С., Веннерстен С. (июнь 1975 г.). «Сравнительная синергетическая активность нафциллина, оксациллина и метициллина в сочетании с гентамицином против». Противомикробные препараты и химиотерапия. 7 (6): 828–32. Дои:10.1128 / aac.7.6.828. ЧВК 429234. PMID 1155924.
- ^ Лин, Дерек М; Коскелла, Бритт; Лин, Генри С. (2017). «Фаговая терапия: альтернатива антибиотикам в эпоху множественной лекарственной устойчивости». Всемирный журнал желудочно-кишечной фармакологии и терапии. 8 (3): 162–173. Дои:10.4292 / wjgpt.v8.i3.162. ISSN 2150-5349. ЧВК 5547374. PMID 28828194.
внешняя ссылка
- БРЕМЯ резистентности и болезней в европейских странах —Проект ЕС по оценке финансового бремени устойчивости к антибиотикам в европейских больницах.
- Мерк - Терпимость и сопротивление
- База данных косметики
- Инструмент для мутаций лекарственной устойчивости HCMV
- Борьба с лекарственной устойчивостью - Информативная статья о множественной лекарственной устойчивости
- Битва ошибок: борьба с устойчивостью к антибиотикам
- MDRIpred : Веб-сервер для прогнозирования ингибиторов устойчивости к лекарствам M. Tuberculosis, опубликованный в Центральный журнал химии
- Рак: База данных по устойчивости к лекарствам от рака. Научные отчеты 3, 1445
