Бета-лактам - Beta-lactam
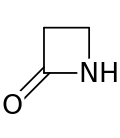
А бета-лактам (β-лактам) кольцо является четырехчленным лактам.[1] А лактам циклический амид, и бета-лактамы названы так потому, что атом азота присоединен к β-углерод атом относительно карбонила. Самый простой возможный β-лактам - это 2-азетидинон. β-лактамы - важные структурные единицы лекарственных средств.[2]
Клиническое значение

Β-лактамное кольцо является частью основной структуры нескольких антибиотик семьи, главными из которых являются пенициллины, цефалоспорины, карбапенемы, и монобактамы, которые, следовательно, также называются β-лактамные антибиотики. Почти все эти антибиотики действуют путем подавления бактериального клеточная стенка биосинтез. Это губительно для бактерии, хотя любая данная популяция бактерий обычно содержит подгруппу, стойкий к β-лактамным антибиотикам. Бактериальная устойчивость происходит в результате экспрессии одного из многих генов продукции β-лактамазы, класс ферментов, которые разрывают β-лактамное кольцо. Более 1800 различных ферментов β-лактамазы были зарегистрированы у различных видов бактерий.[3] Эти ферменты широко различаются по своей химической структуре и каталитической эффективности.[4] Когда популяции бактерий имеют эти устойчивые подгруппы, лечение β-лактамом может привести к тому, что устойчивый штамм станет более распространенным и, следовательно, более вирулентным. Антибиотики на основе β-лактама можно рассматривать как один из наиболее важных классов антибиотиков, но они склонны к клинической устойчивости. β-лактам проявляет свои антибиотические свойства, имитируя природный субстрат d-Ala-d-Ala для группы ферментов, известных как связывающие пенициллин белки (PBP), которые имеют функцию сшивания пептидогликановой части клеточной стенки бактерий.[5]
История
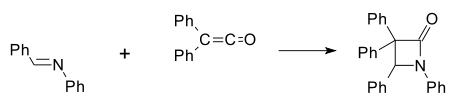
Первый синтетический β-лактам был получен Герман Штаудингер в 1907 г. по реакции База Шиффа из анилин и бензальдегид с дифенилкетен[6][7] в [2 + 2] циклоприсоединение (Ph указывает на фенильную функциональную группу):
До 1970 года большинство исследований β-лактама касалось пенициллин и цефалоспорин группы, но с тех пор было описано большое разнообразие структур.[8][9]
Синтез и реакционная способность
Разработано множество методов синтеза β-лактамов.[10]
Синтез Breckpot: синтез замещенных β-лактамов в результате циклизации сложных эфиров бета-аминокислот с использованием Реактив Гриньяра.[11]
Из-за напряжение кольца, β-лактамы легче гидролизованный чем линейные амиды или более крупные лактамы. Этот штамм дополнительно увеличивается за счет слияния со вторым кольцом, как обнаружено в большинстве β-лактамных антибиотиков. Эта тенденция связана с тем, что амидный характер β-лактама восстанавливается за счет апланарность системы. Атом азота идеального амида равен зр2-гибридизированный из-за резонанс, и sp2-гибридизированные атомы имеют геометрия тригональной плоской связи. Как пирамидальный Геометрия связи навязывается атому азота деформацией кольца, резонанс амидной связи уменьшается, и карбонильная группа становится более кетон -подобно. Нобелевский лауреат Роберт Бернс Вудворд описал параметр час как мера высоты тригональной пирамиды, определяемой азотом (как вершина ) и его трех соседних атомов. час соответствует силе β-лактамной связи с более низкими числами (более планарными, больше похожими на идеальные амиды), которые являются более прочными и менее реактивными.[12] Монобактамы имеют час значения от 0,05 до 0,10 ангстремы (Å). Цефемы имеют час значения в 0,20–0,25 Å. Пенамы имеют значения в диапазоне 0,40–0,50 Å, в то время как карбапенемы и клавамы имеют значения 0,50–0,60 Å, являясь наиболее реактивными из β-лактамов по отношению к гидролизу.[13]
Другие приложения
Новое исследование показало, что β-лактамы могут открывать кольцо. полимеризация с образованием амидных связей с образованием полимеров нейлона-3. Основные цепи этих полимеров идентичны пептидам, что обеспечивает им биофункциональность. Эти полимеры нейлона-3 могут имитировать пептиды защиты хозяина или действовать как сигналы для стимуляции 3T3 стволовая клетка функция.[13]
Антипролиферативные агенты также сообщалось о том, что тубулин нацелен на β-лактамы в своей структуре.[14][15]
Смотрите также
Рекомендации
- ^ Гилкрист Т (1987). Гетероциклическая химия. Харлоу: Longman Scientific. ISBN 978-0-582-01421-3.
- ^ Фишер, Дж. Ф .; Meroueh, S.O .; Mobashery, С. (2005). «Бактериальная резистентность к β-лактамным антибиотикам: неотразимый оппортунизм, неотразимая возможность». Химические обзоры. 105 (2): 395–424. Дои:10.1021 / cr030102i. PMID 15700950.
- ^ Брандт С., Браун С.Д., Штейн С., Сликерс П., Эрихт Р., Плетц М.В., Макаревич О. (февраль 2017 г.). «Анализ in silico сериновых β-лактамаз показывает огромный потенциал резистома у экологических и патогенных видов». Научные отчеты. 7: 43232. Bibcode:2017НатСР ... 743232Б. Дои:10.1038 / srep43232. ЧВК 5324141. PMID 28233789.
- ^ Эманн Д.Е., Яхич Х., Росс П.Л., Гу РФ, Ху Дж., Керн Г., Уолкап Г.К., Фишер С.Л. (июль 2012 г.). «Авибактам представляет собой ковалентный обратимый ингибитор не-β-лактамных β-лактамаз». Труды Национальной академии наук Соединенных Штатов Америки. 109 (29): 11663–8. Bibcode:2012PNAS..10911663E. Дои:10.1073 / pnas.1205073109. ЧВК 3406822. PMID 22753474.
- ^ Самосвал DJ, Strominger JL (октябрь 1965). «Механизм действия пенициллинов: предложение, основанное на их структурном сходстве с ацил-D-аланил-D-аланином». Труды Национальной академии наук Соединенных Штатов Америки. 54 (4): 1133–41. Bibcode:1965ПНАС ... 54.1133Т. Дои:10.1073 / pnas.54.4.1133. ЧВК 219812. PMID 5219821.
- ^ Тидвелл TT (2008). «Хьюго (Уго) Шифф, основания Шиффа и век синтеза бета-лактамов». Angewandte Chemie. 47 (6): 1016–20. Дои:10.1002 / anie.200702965. PMID 18022986.
- ^ Staudinger H (1907). "Zur Kenntniss der Ketene. Diphenylketen". Justus Liebigs Ann. Chem. 356 (1–2): 51–123. Дои:10.1002 / jlac.19073560106.
- ^ Флинн EH (1972). Цефалоспорины и пенициллины: химия и биология. Нью-Йорк и Лондон: Academic Press.
- ^ Хоссейни С., Джаррахпур А. (октябрь 2018 г.). «Последние достижения в синтезе β-лактамов». Органическая и биомолекулярная химия. 16 (38): 6840–6852. Дои:10.1039 / c8ob01833b. PMID 30209477.
- ^ Алькаиде, Бенито; Альмендрос, Педро; Арагонсилло, Кристина (2007). «Β-лактамы: универсальные строительные блоки для стереоселективного синтеза не-β-лактамных продуктов». Химические обзоры. 107 (11): 4437–4492. Дои:10.1021 / cr0307300. PMID 17649981.
- ^ Богданов Б, Здравковски З., Христовски К. "Брекпот-синтез". Институт химии Скопье.
- ^ Вудворд РБ (май 1980 г.). «Пенемы и родственные вещества». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 289 (1036): 239–50. Bibcode:1980RSPTB.289..239W. Дои:10.1098 / рстб.1980.0042. PMID 6109320.
- ^ а б Нангиа А., Бирада К., Десираджу Г.Р. (1996). «Корреляция биологической активности β-лактамных антибиотиков со структурными параметрами Вудворда и Коэна: исследование базы данных Кембриджа». J. Chem. Soc. Перкин Транс. 2 (5): 943–53. Дои:10.1039 / p29960000943.
- ^ О'Бойл Н.М., Карр М., Грин Л.М., Бергин О., Натвани С.М., МакКейб Т., Ллойд Д.Г., Зистерер Д.М., Миган М.Дж. (декабрь 2010 г.). «Синтез и оценка азетидиноновых аналогов комбретастатина А-4 в качестве нацеленных на тубулин агентов». Журнал медицинской химии. 53 (24): 8569–84. Дои:10.1021 / jm101115u. HDL:2262/81779. PMID 21080725.
- ^ О'Бойл Н.М., Грин Л.М., Бергин О., Фишет Дж. Б., МакКейб Т., Ллойд Д. Г., Зистерер Д. М., Миган М. Дж. (Апрель 2011 г.). «Синтез, оценка и структурные исследования азетидин-2-онов, направленных против тубулина» (PDF). Биоорганическая и медицинская химия. 19 (7): 2306–25. Дои:10.1016 / j.bmc.2011.02.022. HDL:2262/54923. PMID 21397510.