Нейропсихофармакология - Neuropsychopharmacology
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
Нейропсихофармакология, междисциплинарная наука, связанная с психофармакология (как наркотики влияют на разум) и фундаментальные нейробиология, это исследование нейронных механизмов, на которые действуют наркотики, чтобы влиять на поведение. Это влечет за собой исследование механизмов невропатология, фармакодинамика (действие препарата), психическое заболевание, и состояния сознание. Эти исследования инициируются на детальном уровне с участием нейротрансмиссия /рецептор Мероприятия, биохимический процессы и нервный схема. Нейропсихофармакология заменяет психофармакология в областях «как» и «почему» и дополнительно обращается к другим вопросам функционирования мозга. Соответственно, клинический аспект данной области включает: психиатрический (психоактивный), а также неврологический (непсихоактивные) методы лечения на основе фармакологии. Развитие нейропсихофармакологии может напрямую повлиять на исследования тревожные расстройства, аффективные расстройства, психотические расстройства, дегенеративные расстройства, пищевое поведение, и поведение во сне.
История
Такие препараты как опиум, алкоголь, и некоторые растения тысячелетиями использовались людьми для облегчения страданий или изменения осведомленности, но до современной научной эры знания о том, как эти вещества на самом деле работал был довольно ограничен, большая часть фармакологических знаний была скорее серией наблюдений, чем последовательной моделью. В первой половине ХХ века психология и психиатрия так же в значительной степени феноменологический, в том смысле, что поведение или темы, которые наблюдались у пациентов, часто можно было коррелировать с ограниченным набором факторов, таких как детский опыт, унаследованные тенденции или травмы определенных областей мозга. На таких наблюдениях были основаны модели психических функций и дисфункций. Действительно, поведенческий Раздел психологии вообще обходился без того, что на самом деле происходило внутри мозга, рассматривая большинство психических дисфункций как то, что можно было бы назвать ошибками "программного обеспечения". В ту же эпоху нервная система постепенно изучалась на микроскопическом и химическом уровне, но практически не было взаимной выгоды от клинических областей - до тех пор, пока после Вторая Мировая Война начал их сближать. Можно считать, что нейропсихофармакология началась в начале 1950-х годов с открытия таких лекарств, как Ингибиторы МАО, трициклические антидепрессанты, торазин и литий который показал некоторую клиническую специфичность для психических заболеваний, таких как депрессия и шизофрения.[1] До этого времени лечения, направленного на эти сложные заболевания, практически не существовало. Известные методы, которые мог напрямую влияют на схемы мозга и уровни нейромедиаторов. префронтальная лоботомия, и электрошоковой терапии, последний из которых проводился без миорелаксантов, и оба из них часто причиняли пациенту серьезные физические и психологические травмы.
Область, известная теперь как нейропсихофармакология, возникла в результате роста и расширения многих ранее изолированных областей, которые встретились в основе психиатрической медицины, и привлекает широкий круг профессионалов от психиатров до исследователей в области генетики и химии. Использование этого термина приобрело популярность с 1990 года, когда было основано несколько журналов и организаций, таких как Венгерский колледж нейропсихофармакологии.[1] Эта быстро развивающаяся область демонстрирует некоторую степень подвижности, поскольку исследовательские гипотезы часто реструктурируются на основе новой информации.
Обзор
Неявная предпосылка нейропсихофармакологии в отношении психологических аспектов состоит в том, что все состояния разум, включая как нормальные, так и вызванные лекарствами измененные состояния, а также заболевания, связанные с психическими или познавательный дисфункция, есть нейрохимический основы на фундаментальном уровне, а также определенных схемных путей в Центральная нервная система на более высоком уровне. (Смотрите также: Доктрина нейронов ) Таким образом, понимание нервных клеток или нейроны в мозгу занимает центральное место в понимании разума. Считается, что задействованные механизмы могут быть объяснены с помощью современных клинический и методы исследования, такие как генетическая манипуляция у животных - методы визуализации, такие как функциональная магнитно-резонансная томография (фМРТ ), и in vitro исследования с использованием селективных связывающих агентов на культурах живых тканей. Это позволяет отслеживать и измерять нервную активность в ответ на различные условия тестирования. Другие важные инструменты наблюдения включают радиологическое изображение.[2] Такие как позитронно-эмиссионная томография (ДОМАШНИЙ ПИТОМЕЦ ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ ). Эти методы визуализации чрезвычайно чувствительны и позволяют отображать крошечные концентрации молекул порядка 10.−10 M, например, при экстрастриатальном D1 рецептор дофамина.
Одна из конечных целей - разработать и разработать рецепты лечения различных заболеваний. невропатологический условия и психические расстройства. Однако более глубоко полученные знания могут дать представление о самой природе человеческого мышления, умственных способностях, таких как обучение и память, и, возможно, самом сознании. Непосредственным продуктом нейропсихофармакологических исследований является база знаний, необходимая для разработки наркотики которые действуют на очень специфические рецепторы в системе нейротрансмиттеров. Эти препараты «гиперселективного действия» позволят напрямую воздействовать на определенные участки релевантной нервной активности, тем самым максимизируя эффективность (или технически потенция) препарата в пределах клинической цели и минимизации побочные эффекты. Однако бывают случаи, когда некоторая степень фармакологической неразборчивости допустима и даже желательна и дает более желаемые результаты, чем более селективный агент. Примером этого является вортиоксетин, лекарство, которое не является особенно селективным в качестве ингибитора обратного захвата серотонина, обладает значительной степенью модулирующей активности серотонина, но которое продемонстрировало уменьшение симптомов отмены (и снижение вероятности рецидива) и значительно снижает частоту сексуальной дисфункции. без потери антидепрессивной эффективности.
В настоящее время закладывается фундамент для следующего поколения фармакологический процедуры, которые улучшат качество жизни с повышением эффективности. Например, вопреки предыдущей мысли, теперь известно, что мозг взрослого человека в некоторой степени вырастает новые нейроны - изучение которых, помимо нейротрофические факторы, может дать надежду на нейродегенеративные заболевания, такие как Болезнь Альцгеймера, Болезнь Паркинсона, ALS, и типы хорея. Все белки участвующие в нейротрансмиссии составляют небольшую часть из более чем 100 000 белков мозга. Таким образом, есть много белков, которые даже не находятся на прямом пути преобразование сигнала, любой из которых все еще может быть мишенью для конкретной терапии. В настоящее время о новых фармакологических подходах к заболеваниям или состояниям сообщается почти один раз в неделю.[3]
Нейротрансмиссия
Насколько нам известно, все, что мы воспринимаем, чувствуем, думаем, знаем и делаем, является результатом срабатывания и перезагрузки нейронов. Когда клетка в мозгу срабатывает, небольшие химические и электрические колебания, называемые потенциал действия может повлиять на срабатывание до тысячи других нейронов в процессе, называемом нейротрансмиссия. Таким образом, сигналы генерируются и передаются через нейронные сети, электрическое воздействие которых можно измерить непосредственно на коже черепа с помощью ЭЭГ устройство.
К последнему десятилетию 20-го века были получены важные знания обо всех основных особенностях нейротрансмиссии.[4] Вот эти особенности:
- В синтез и хранение нейротрансмиттер вещества,
- Транспорт синаптического пузырьки и последующий выпуск в синапс,
- Рецептор активация и каскад функция
- Транспорт механизмы (обратный захват) и / или деградация ферментов
Более поздние достижения предполагают понимание органический молекулярный уровень; биохимическое действие эндогенный лиганды, ферменты, рецепторные белки и т. д. Критические изменения, влияющие на активацию клеток, происходят, когда сигнальные нейротрансмиттеры от одного нейрона, действуя как лиганды, связываются с рецепторами другого нейрона. Многие системы нейротрансмиттеров и рецепторы хорошо известны, и исследования продолжаются в направлении идентификации и характеристики большого числа очень специфических подтипов рецепторов. Для шести более важных нейротрансмиттеров Glu, ГАМК, Ах, NE, DA, и 5HT (перечислено в нейротрансмиттер ) существует не менее 29 основных подтипов рецепторов. Другие «подтипы» существуют вместе с вариантами, всего для этих 6 передатчиков насчитываются сотни единиц. - (видеть рецептор серотонина Например.) Часто обнаруживается, что подтипы рецепторов имеют дифференцированную функцию, что в принципе открывает возможность точного преднамеренного контроля над функцией мозга.
Ранее было известно, что окончательный контроль над мембранным напряжением или потенциалом нервной клетки и, следовательно, активацией клетки, находится в трансмембранном ионные каналы которые управляют мембранными токами через ионы K+, Na+, и Ca++, и менее важно Mg++ и Cl−. Разница концентраций внутри и снаружи клетки определяет мембранное напряжение.
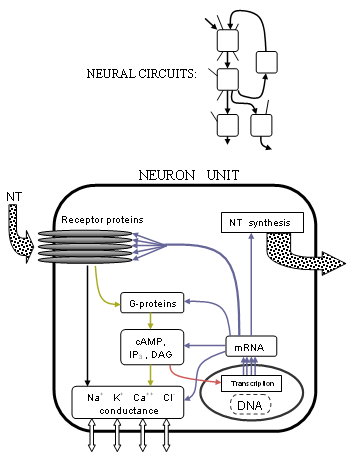
То, как именно контролируются эти токи, стало намного яснее с развитием рецепторной структуры и Связанный с G-белком процессы. Обнаружено, что многие рецепторы представляют собой пентамерные кластеры из пяти трансмембранных белков (не обязательно одинаковых) или субъединицы рецептора, каждая из которых представляет собой цепочку из множества аминокислот. Передатчики обычно связываются на стыке между двумя из этих белков на частях, которые выступают из клеточной мембраны. Если рецептор ионотропный типа, центральная пора или канал в середине белков будет механически перемещаться, чтобы позволить определенным ионам проходить через них, тем самым изменяя разницу концентраций ионов. Если рецептор метаботропный типа G-белки вызывают метаболизм внутри клетки, который в конечном итоге может изменить другие ионные каналы. Исследователи лучше понимают, как именно происходят эти изменения, в зависимости от формы структуры белка и химических свойств.
Масштабы этой деятельности расширились еще больше до самой схемы жизни с момента выяснения механизма, лежащего в основе транскрипция гена. В синтез клеточных белков из ядерных ДНК имеет тот же фундаментальный механизм[5] для всех ячеек; исследование которого теперь имеет прочную основу благодаря Проект "Геном человека" который перечислил всю последовательность ДНК человека, хотя многие из примерно 35 000 генов еще предстоит идентифицировать. Полный процесс нейротрансмиссии простирается до генетического уровня. Экспрессия гена определяет белковые структуры через тип II РНК-полимераза. Итак, ферменты, которые синтезируют или разрушают нейротрансмиттеры, рецепторы и ионные каналы, состоят из мРНК через транскрипцию ДНК их соответствующего гена или генов. Но нейротрансмиссия в дополнение к прямому или иному контролю ионных каналов через метаботропный процессы, также фактически модулирует экспрессию генов. Наиболее заметно это достигается за счет модификации процесс инициации транскрипции множеством факторов транскрипции, производимых рецепторной активностью.
Помимо важных фармакологических возможностей путей экспрессии генов, соответствие гена его белку позволяет использовать важный аналитический инструмент нокаут гена. Живые экземпляры можно создать с помощью рекомбинация гомологов в котором не может быть экспрессирован конкретный ген. В этом случае организм будет испытывать дефицит ассоциированного белка, который может быть специфическим рецептором. Этот метод позволяет избежать химической блокады, которая может вызвать запутанные или неоднозначные вторичные эффекты, так что последствия отсутствия рецептора могут быть изучены в более чистом смысле.
Наркотики
Создание многих классов лекарств в принципе несложно: любое химическое вещество, которое может усиливать или уменьшать действие целевого белка, может быть дополнительно исследовано на предмет такого использования. Уловка состоит в том, чтобы найти такое химическое вещество, которое является специфическим для рецептора (см. "грязный наркотик ") и безопасен для употребления. 2005 Справочник врача перечисляет вдвое большее количество отпускаемые по рецепту лекарства как версия 1990 года.[6] Многие люди уже знакомы с "селективные ингибиторы обратного захвата серотонина "или СИОЗС, которые служат примером современных фармацевтические препараты. Эти СИОЗС антидепрессант препараты, такие как Паксил и Прозак, избирательно и, следовательно, в первую очередь ингибируют транспорт серотонина, который продлевает активность в синапсе. Существует множество категорий селективных препаратов, и блокировка транспорта - это только один из способов действия. В FDA одобрил препараты, которые избирательно действуют на каждый из основных нейромедиаторов, таких как NE ингибиторы обратного захвата антидепрессанты, DA блокиратор антипсихотики, и ГАМК агонист транквилизаторы (бензодиазепины ).
Постоянно выявляются новые эндогенные химические вещества. Для препаратов были обнаружены специфические рецепторы. THC (каннабис) и GHB,[7] с эндогенными трансмиттерами анандамидом и GHB. Еще одно недавнее крупное открытие произошло в 1999 году, когда орексин, или гипокретин, играет роль в возбуждении, поскольку отсутствие рецепторов орексина отражает состояние нарколепсия. Агонизм орексина может объяснить антинарколептическое действие препарата. модафинил который уже использовался только годом ранее.
Следующий шаг, который Фармацевтические компании в настоящее время усиленно работают над разработкой препаратов, специфичных для подтипов рецепторов, и других специфических агентов. Примером может служить стремление к созданию лучших успокаивающих средств (анксиолитики ) на основе ГАМКА(α2) агонисты, CRF1 антагонисты и 5HT2c антагонисты.[8] Другим является предложение о новых маршрутах исследования антипсихотических средств, таких как ингибиторы обратного захвата глицина.[9] Хотя существуют возможности для рецептор-специфических лекарств, недостатком лекарственной терапии является отсутствие способности обеспечивать анатомический специфичность. Изменяя функцию рецепторов в одной части мозга, можно вызвать ненормальную активность в других частях мозга из-за того же типа изменений рецепторов. Типичный пример - эффект D2 изменяющие препараты (нейролептики), которые могут помочь при шизофрении, но вызывают различные дискинезии своим действием на моторную кору.
Современные исследования раскрывают детали механизмов повреждения нервной системы, таких как: апоптоз (запрограммированная гибель клеток) и свободный радикал срыв. Фенциклидин было обнаружено, что вызывает гибель клеток стриатопаллидных клеток и аномальные вакуолизация в гиппокамп и другие нейроны. В галлюциногены стойкое расстройство восприятия (HPPD), также известный как постпсиходелическое расстройство восприятиянаблюдается у пациентов спустя 26 лет после употребления ЛСД. Вероятной причиной HPPD является повреждение тормозной цепи ГАМК в зрительном пути (агонисты ГАМК, такие как мидазолам, могут уменьшить некоторые эффекты интоксикации ЛСД). Ущерб может быть результатом эксайтотоксический ответ 5HT2 интернейроны. [Примечание: подавляющее большинство пользователей LSD не испытывают HPPD. Его проявление может в равной степени зависеть как от химического состава мозга, так и от самого употребления наркотиков]. МДМА, помимо постоянных потерь 5HT и SERT, длительное снижение серотонинергических аксоны и терминалы обнаруживаются при кратковременном использовании, и повторный рост может быть нарушен.
Нейронные схемы
Не так давно было обнаружено, что многие функции мозга в некоторой степени локализованы в связанных областях, таких как двигательные и речевые способности. Функциональные ассоциации анатомии головного мозга в настоящее время дополняются клиническими, поведенческими и генетическими коррелятами действия рецепторов, дополняя знания о нейронных сигналах. (смотрите также: Проект человеческого когнома ). Сигнальные пути нейронов гиперорганизованы за пределы клеточного масштаба в часто сложные нервные цепи. Знание об этих путях, пожалуй, легче всего интерпретировать, поскольку оно наиболее узнаваемо с точки зрения системного анализа, что можно увидеть в следующих отрывках.
Было обнаружено, что почти все препараты с известным потенциалом злоупотребления модулируют активность (прямо или косвенно) в мезолимбической дофаминовой системе, которая включает и соединяет вентральную тегментальную область в среднем мозге с гиппокампом, медиальной префронтальной корой и миндалевидным телом в переднем мозге. ; а также прилежащее ядро в брюшном полосатом теле базальных ганглиев.[2] В частности, прилежащее ядро (NAc) играет важную роль в интеграции эмпирической памяти из гиппокампа, эмоций из миндалевидного тела и контекстной информации из PFC, чтобы помочь связать определенные стимулы или поведение с чувствами удовольствия и вознаграждения; Непрерывная активация этой системы индикаторов вознаграждения наркотиком, вызывающим привыкание, также может привести к кодированию ранее нейтральных стимулов как сигналов о том, что мозг собирается получить вознаграждение. Это происходит за счет избирательного высвобождения дофамина, нейромедиатора, ответственного за чувство эйфории и удовольствия. Использование дофаминергических препаратов изменяет количество дофамина, высвобождаемого в мезолимбической системе, и регулярное или чрезмерное употребление препарата может привести к долгосрочному подавлению передачи сигналов дофамина.[3] даже после того, как человек перестает принимать препарат. Это может привести к тому, что человек будет проявлять склонность к поиску наркотиков от легкой до экстремальной, поскольку мозг начинает регулярно ожидать повышенного присутствия дофамина и сопутствующего ему чувства эйфории, но насколько это проблематично, в значительной степени зависит от препарата и ситуации.
Значительный прогресс был достигнут в отношении центральных механизмов определенных галлюциногенные препараты. На данный момент с относительной уверенностью известно, что основные общие эффекты широкой фармакологической группы галлюциногенов, иногда называемых «классическими психоделиками», могут быть в значительной степени приписаны агонизму рецепторов серотонина. 5HT2А рецептор, который, по-видимому, является наиболее важным рецептором психоделической активности, и 5HT2C рецепторы, которые являются важной мишенью для большинства психоделиков, но не играют четкой роли в галлюциногенезе, задействованы, высвобождая глутамат в лобная кора, а одновременно в голубое пятно сенсорная информация продвигается, а спонтанная активность снижается. 5HT2А активность имеет чистый продофаминергический эффект, тогда как 5HT2C рецепторный агонизм оказывает ингибирующее действие на дофаминергическую активность, особенно в префронтальной коре. Одна из гипотез предполагает, что во фронтальной коре 5HT2А способствует поздней асинхронности возбуждающие постсинаптические потенциалы, процесс, которому противодействует сам серотонин через 5HT1 рецепторы, которые могут объяснить, почему СИОЗС и другие препараты, влияющие на серотонин, обычно не вызывают у пациента галлюцинации. Однако тот факт, что многие классические психоделики на самом деле имеют значительную близость к 5HT1 рецепторы ставят это утверждение под сомнение. Реакция на подергивание головы, тест, используемый для оценки классической психоделической активности у грызунов, вырабатывается самим серотонином только в присутствии бета-аррестинов, но запускается классическими психоделиками независимо от набора бета-аррестина.[4] Это может лучше объяснить разницу между фармакологией серотонинергической нейротрансмиссии (даже если ее стимулируют такие препараты, как СИОЗС) и фармакологией классических психоделиков. Однако более новые открытия показывают, что связывание с 5HT2А-mGlu2 гетеродимер также необходим для классической психоделической деятельности.[5][6][7] Это тоже может иметь отношение к фармакологическим различиям между ними. Хотя в начале истории исследований психоделических препаратов предполагалось, что эти галлюцинации сравнимы с галлюцинациями, вызванными психозом, и, таким образом, классические психоделики могут служить моделью психоза, важно отметить, что современные нейропсихофармакологические знания о психозах значительно продвинулись с тех пор. тогда, и теперь мы знаем, что психозы мало похожи на эффекты классических психоделиков по механизму, описанному опыту или большинству других аспектов, если не считать внешнего сходства с «галлюцинациями».

Циркадный ритм, или чередование сна / бодрствования, сосредоточено в супрахиазматическое ядро (SCN) в гипоталамусе и отмечен мелатонин уровни на 2000–4000% выше во время сна, чем днем. Известно, что цепь начинается с меланопсин клетки глаза, которые стимулируют SCN через глутаматные нейроны гипоталамический тракт. ГАМКергические нейроны из SCN ингибируют паравентрикулярное ядро, что сигнализирует о верхний шейный ганглий (SCG) через сочувствующий волокна. Выход SCG стимулирует рецепторы NE (β ) в шишковидная железа который производит N-ацетилтрансферазу, вызывая производство мелатонина из серотонина. Тогда ингибирующие рецепторы мелатонина в SCN обеспечивают положительную обратную связь. путь. Поэтому свет подавляет производство мелатонина, который "увлекает «24-часовой цикл активности СКС.[10][11] SCN также получает сигналы от других частей мозга, и его (приблизительно) 24-часовой цикл зависит не только от световых паттернов. Фактически, срезанная ткань из SCN будет демонстрировать суточный цикл in vitro в течение многих дней. Кроме того, (не показано на схеме) базальное ядро обеспечивает ГАМК-ергический ингибирующий вход в преоптический передний гипоталамус (ПАУ). Когда аденозин накапливается в результате метаболизма АТФ в течение дня, он связывается с аденозиновыми рецепторами, подавляя базальное ядро. Затем активируется ЛАГ, вызывая медленноволновую активность сна. Кофеин известно, что он блокирует аденозиновые рецепторы, тем самым, среди прочего, подавляя сон.
Исследование
Исследования в области нейропсихофармакологии охватывают широкий круг задач. Они могут включать изучение нового химического соединения для потенциально полезных когнитивных или поведенческих эффектов или изучение старого химического соединения, чтобы лучше понять механизм его действия на клеточном и нервном уровнях. Например, кокаин, вызывающий привыкание, давно известен тем, что действует на систему вознаграждения в головном мозге, повышая уровень дофамина и норадреналина и на короткое время вызывая эйфорию. Однако недавно опубликованные исследования пошли глубже, чем уровень контуров, и обнаружили, что особый рецепторный комплекс, связанный с G-белком, называемый A2AR-D2R-Sigma1R, образуется в NAc после употребления кокаина; этот комплекс снижает передачу сигналов D2R в мезолимбическом пути и может быть фактором, способствующим кокаиновой зависимости.[8] Другие передовые исследования были сосредоточены на генетике, чтобы определить конкретные биомаркеры, которые могут предсказать конкретные реакции человека или степень ответа на лекарство или его склонность к развитию зависимости в будущем.[9] Эти результаты важны, поскольку они дают подробное представление о нейронных цепях, участвующих в употреблении наркотиков, и помогают уточнить старые, а также разработать новые методы лечения расстройств или зависимостей. Различные связанные с лечением исследования изучают потенциальную роль пептидных нуклеиновых кислот в лечении болезни Паркинсона и шизофрении.[10] в то время как третьи пытаются установить ранее неизвестные нейронные корреляты, лежащие в основе определенных явлений.[11]
Исследования в области нейропсихофармакологии связаны с широким спектром деятельности в области нейробиологии и клинических исследований. Это мотивировало такие организации, как Американский колледж нейропсихофармакологии (ACNP), то Европейский колледж нейропсихофармакологии (ECNP), а Collegium Internationale Neuro-psychopharmacologicum (CINP) будет устанавливаться как мера фокусировки. ECNP издает Европейская нейропсихофармакология, и как часть Reed Elsevier Group, ACNP издает журнал Нейропсихофармакология, а НИИЯФ издает журнал Международный журнал нейропсихофармакологии с Издательство Кембриджского университета.В 2002 г. был составлен последний комплексный сборник работ ACNP «Нейропсихофармакология: пятое поколение прогресса». Это один из показателей состояния знаний в 2002 году, и можно сказать, что он представляет собой веху в вековой цели по установлению основных нейробиологических принципов, управляющих действиями мозга.
Существует множество других журналов, которые содержат соответствующую информацию, например Неврология.Некоторые из них перечислены на Библиотека Университета Брауна.
Смотрите также
Примечания
- ^ Лопес-Муньос, Ф .; Аламо, К. (2009). «Моноаминергическая нейротрансмиссия: история открытия антидепрессантов с 1950-х годов до наших дней». Текущий фармацевтический дизайн. 15 (14): 1563–1586. Дои:10.2174/138161209788168001. PMID 19442174.
- ^ Пирс, Р. К., и Кумаресан, В. (2006). Мезолимбическая дофаминовая система: последний общий путь усиления эффекта злоупотребления наркотиками? Неврология и биоповеденческие обзоры, 30 (2), 215–238. DOI: 10.1016 / j.neubiorev.2005.04.016
- ^ Бари, А., Дисесар, Дж., Бабаян, Д., Ранси, М., Спаркс, Х., и Уилсон, Б. (2018). Нейромодуляция при наркозависимости у людей: обзор. Neuroscience & Biobehavioral Reviews, 95, 33–43. DOI: 10.1016 / j.neubiorev.2018.09.013
- ^ Schmid, C.L .; Raehal, K. M .; Бон, Л. М. (14 января 2008 г.). «Направленная агонистами передача сигналов рецептора серотонина 2А зависит от взаимодействий -аррестин-2 in vivo». Труды Национальной академии наук. 105 (3): 1079–1084. Дои:10.1073 / pnas.0708862105. ISSN 0027-8424. ЧВК 2242710. PMID 18195357.
- ^ Гонсалес-Маесо, Хавьер; Бенсон, Дина Л .; Меана, Дж. Хавьер; Лопес-Хименес, Хуан Ф .; Sealfon, Stuart C .; Миллиган, Грэм; Неве, Рэйчел Л .; Калладо, Луис Ф .; Сето, Джереми (2012-12-28). «Идентификация трех остатков, необходимых для гетеромеризации рецептора 5-гидрокситриптамина 2A-метаботропного глутамата 2 (5-HT2A · mGlu2) и его психоактивной поведенческой функции». Журнал биологической химии. 287 (53): 44301–44319. Дои:10.1074 / jbc.M112.413161. ISSN 0021-9258. ЧВК 3531745. PMID 23129762.
- ^ Sealfon, Stuart C .; Меана, Дж. Хавьер; Филизола, Марта; Гингрич, Джей А .; Миллиган, Грэм; Калладо, Луис Ф .; Юя Окава; Чжоу, Минмин; Лопес-Хименес, Хуан Ф. (март 2008 г.). «Идентификация комплекса рецепторов серотонина / глутамата, причастного к психозу». Природа. 452 (7183): 93–97. Дои:10.1038 / природа06612. ISSN 1476-4687. ЧВК 2743172. PMID 18297054.
- ^ Морено, Хосе Л .; Холлоуэй, Террелл; Альбизу, Лаура; Sealfon, Stuart C .; Гонсалес-Маесо, Хавьер (15 апреля 2011 г.). «Метаботропный рецептор глутамата mGlu2 необходим для фармакологических и поведенческих эффектов, вызываемых галлюциногенными агонистами рецептора 5-HT2A». Письма о неврологии. 493 (3): 76–79. Дои:10.1016 / j.neulet.2011.01.046. ISSN 0304-3940. ЧВК 3064746. PMID 21276828.
- ^ Боррото-Эскуэла, Д. О., Выдра, К., Филип, М., и Фьюкс, К. (2018). Гетерорецепторные комплексы A2AR-D2R в вознаграждении за кокаин и зависимости. Направления фармакологических наук. DOI: 10.1016 / j.tips.2018.10.007
- ^ Квако, Л. Э., Бикель, В. К., и Гольдман, Д. (2018). Биомаркеры зависимости: размерные подходы к пониманию зависимости. Тенденции в молекулярной медицине, 24 (2), 121–128. DOI: 10.1016 / j.molmed.2017.12.007
- ^ Лаборатория нейропсихофармакологии: Эллиот Ричельсон - Текущие проекты. (2013, 23 мая). Извлекаются из https://www.mayo.edu/research/labs/neuropsychopharmacology/projects
- ^ Исследовательские проекты. (нет данных). Извлекаются из http://caliparilab.com/research-projects/
Рекомендации
- («4-е поколение» и «5-е поколение» относятся к ACNP, см. Ссылки)
- ^ «История HCNP: обмен информацией и ускорение прогресса», Информационный бюллетень ECNP, №7 (2004)
- ^ Фуджита М. и Иннис Р. Б. "В естественных условиях Молекулярная визуализация: разработка лигандов и их применение в исследованиях », (5-е поколение прог.)
- ^ Таллман, Дж. Ф., «Нейропсихофармакология в новом тысячелетии: новые направления индустрии», Нейропсихофармакология 20 (1999)
- ^ Блум, Ф. Э., "Введение в доклиническую нейропсихофармакологию", (4-е поколение Prog.)
- ^ Уотсон, С. Дж. И Куллинан, В. Е., "Цитология и схемотехника", (4-е поколение прогр.)
- ^ Справочник врача, 1990, 2005
- ^ Erowid, «Нейрофармакология γ-гидроксибутирата (GHB)» (2004)
- ^ Таллман, Дж. Ф., Касселла, Дж., Кене, Дж., "Механизм действия анксиолитиков", (5-е поколение прогр.)
- ^ Депоортер Р., и другие., "Нейрохимические, электрофизиологические и фармакологические профили селективного ингибитора переносчика глицина-1 SSR504734, потенциально нового типа антипсихотика", Нейропсихофармакология 30, стр. 1963–1985, (2005)
- ^ Абрахам, Х. Д., Макканн, У. Д., Рикаурте, Г. А., "Психоделические препараты", (5-е поколение прогр.)
- ^ Колвелл, С. С., «Циркадные ритмы», (4-е поколение прог.)
- ^ Леви, А. Дж., "Циркадная фаза сна и расстройства настроения", (5-е поколение прогр.)
внешняя ссылка
- Ресурсы ACNP
- Организации
- Collegium Internationale Neuro-psychopharmacologicum Глобальная организация, занимающаяся нейропсихофармакологией
- Европейский колледж нейропсихофармакологии
- Журналы
- Журнал нейропсихофармакологии - официальное издание Американского колледжа нейропсихофармакологии
- Европейская нейропсихофармакология - Журнал Elsevier
- Международный журнал нейропсихофармакологии - Публикация Cambridge University Press
- Нейропсихофармакология и терапия Айвором Эбенезером (2015), John Wiley & Sons, Чичестер, Великобритания, ISBN 978-1-118-38565-4

