Эфир прогестагена - Progestogen ester

А эфир прогестагена является сложный эфир из прогестаген или прогестин (а синтетический прогестаген). Прототипом прогестагена является прогестерон, эндогенный половой гормон. Этерификация часто используется для улучшения фармакокинетика из стероиды, в том числе устный биодоступность, липофильность, и период полувыведения.[1] Кроме того, с внутримышечная инъекция сложные эфиры стероидов часто медленнее всасываются в организм, что позволяет применять их реже.[1] Многие (но не все) эфиры стероидов действуют как пролекарства.
Этерификация особенно важна в случае прогестерона, потому что сам прогестерон показывает очень плохую пероральную фармакокинетику и, таким образом, неэффективен при пероральном приеме.[2][3] В немодифицированном виде он имеет период полувыведения всего 5 минут и почти полностью инактивируется печень в течение метаболизм первого прохождения.[3] Микронизация Тем не менее, прогестерон стал эффективным при пероральном приеме, хотя микронизированный прогестерон для перорального применения не был разработан до недавних лет.[2]
Примеры важных сложных эфиров прогестагена включают 17α-гидроксипрогестерон производные медроксипрогестерона ацетат, мегестрола ацетат, ципротерона ацетат, и гидроксипрогестерона капроат, то 19-норпрогестерон производная номегестрола ацетат, а 19-нортестостерон производные норэтистерона ацетат и норэтистерона энантат.
Эфиры прогестагена
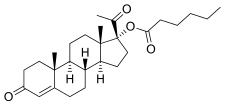
Эстрогены были открыты в 1929 г.,[4] и начиная с 1936 г. эфиры эстрадиола, такие как эстрадиол бензоат и дипропионат эстрадиола, были введены для клинического использования.[4][5] Сложные эфиры тестостерона, такие как пропионат тестостерона и тестостерон фенилацетат, также были представлены примерно в это время.[6] В отличие от эстрадиол и тестостерон, прогестерон оказалось сложнее этерифицировать.[7] Фактически, этерификация предполагает замену гидроксил группа с алкокси группа[8] в отличие от эстрадиола и тестостерона, прогестерон не имеет гидроксильных групп,[9] поэтому фактически химически невозможно этерифицировать сам прогестерон. Первые эфиры прогестагена не были представлены до середины 1950-х гг.[4][7][10] и были эфирами 17α-гидроксипрогестерон (который, в отличие от прогестерона, имеет гидроксильную группу, доступную для этерификации), а не прогестерона; они включали 17α-гидроксипрогестерона капроат (Делалутин, Пролутон) и 17α-гидроксипрогестерона ацетат (Продрокс).[2][10] Следующая цитата de Médicis Sajous et al. (1961) подробно описывает разработку сложных эфиров прогестагена:[11]

В течение нескольких лет Upjohn вложила несколько десятков тысяч долларов в попытки найти легко усваиваемый, активный при пероральном приеме сложный эфир прогестерона. Эта попытка увенчалась ограниченным успехом. Был обнаружен один многообещающий сложный эфир, [17α-гидроксипрогестерона ацетат], продаваемый как Prodox. Он был более активен при приеме внутрь, чем другие препараты прогестерона, представленные на рынке, но при приеме внутрь он не был столь активен, как хотелось бы.Чтобы получить прогестагенный препарат с желаемыми свойствами, оказалось необходимым изменить саму молекулу прогестерона. Начиная примерно с 1957 года химики-стероиды Апджона соответственно подготовили серию прогестеронов, модифицированных различными способами, которые, как было обнаружено, умножали действие кортизона и гидрокортизона. Одна из модификаций, разработанная группой под руководством доктора Джона С. Бэбкока, заключалась в присоединении атома углерода и трех атомов водорода - метильной группы - к углероду 6 в первом кольце стероидного ядра прогестерона. Подобная модификация стала ключевым шагом в создании Medrol, высокоэффективного противовоспалительного стероида типа кортизона Апджона. Новым прогестагенным агентом был [6α-метил-17α-гидроксипрогестерона ацетат] или [медроксипрогестерона ацетат], товарный знак которого - Provera. Доказано, что это наиболее сильнодействующий прогестагенный препарат из всех известных - он в сотни раз более активен при приеме внутрь, чем прогестерон, и примерно в пятьдесят раз более активен при подкожной инъекции. Провера была выпущена на рынок в 1959 году.
Медроксипрогестерона ацетат (Provera) вошел в клиническое использование и стал широко продаваться, в значительной степени вытеснив сложные эфиры 17α-гидроксипрогестерона.[4] Разнообразные аналоги ацетата медроксипрогестерона, такие как хлормадинона ацетат, ципротерона ацетат, и мегестрола ацетат, были впоследствии разработаны и внедрены.[2][4][12] Эфиры прогестагена других групп прогестины также были введены, в том числе 19-норпрогестерон производные гестонорон капроат, сегестерона ацетат (несторон), номегестрола ацетат, и Norgestomet (11β-метил-17α-ацетокси-19-норпрогестерон) и 19-нортестостерон производные этинодиола диацетат, норэтистерона ацетат, норэтистерона энантат, и кингестанола ацетат.
Хотя сложные эфиры стероидных андрогенов и эстрогенов, как правило, сами по себе неактивны и действуют как пролекарства, это не относится ко многим эфирам прогестагена. Например, сложные эфиры производных 17α-гидроксипрогестерона, такие как капроат гидроксипрогестерона, ацетат медроксипрогестерона и ацетат ципротерона, сами по себе очень активны (на самом деле, они гораздо более активны, чем их неэтерифицированные формы) и не являются пролекарствами, образуя мало или совсем не образующие их исходные соединения (в случаях, приведенных в примерах, гидроксипрогестерон, медроксипрогестерон, и ципротерон соответственно).[13][14] С другой стороны, сложные эфиры производных 19-нортестостерона, такие как диацетат этинодиола, ацетат норэтистерона, энантат норэтистерона и ацетат кингестанола, все являются пролекарствами.[15]
Эфиры прогестагена


Хотя прогестерон не может быть этерифицирован, он обладает кетон группы в позициях C3 и C20, и по этой причине возможно этерифицировать Это; то есть возможны эфиры прогестерона. Quingestrone (Enol-Luteovis) представляет собой простой эфир прогестерона (в частности, 3-циклопентиловый эфир прогестерона), продаваемый в Италия как оральный контрацептив.[16][17] Квингестрон представляет собой вариант прогестерона с улучшенной фармакокинетикой, включая более высокую эффективность, пероральную активность, большую липофильность и более длительный период полувыведения.[18][19][20][21][22] Два других прогестагена, пентагестрон (никогда не продавался) и пентагестрон ацетат (Gestovis, Gestovister) представляют собой 3-циклопентиленольные эфиры 17α-гидроксипрогестерона и 17α-гидроксипрогестерона ацетата соответственно, в то время как прогестерон 3-ацетил енол эфир (никогда не продается) представляет собой 3-ацетиленольный эфир прогестерона.[3][16][23][24][25]
Хотя первоначально считалось, что простые эфиры прогестерона, такие как квингестрон, являются пролекарствами прогестерона, впоследствии было обнаружено, что это не так, и что квингестрон вместо этого, по-видимому, непосредственно превращается в соответствующий спирты а не кетоны.[26] Эти спирты - прогестерон метаболиты любить прегнанолоны и прегнандиолы, и как некоторые из этих метаболитов, например 3β-дигидропрогестерон, обладают сильной прогестагенной активностью, это может объяснять клиническую эффективность простых эфиров прогестагена, таких как квингестрон, в качестве прогестагенов.[26][27][25]
Оксимы прогестагена
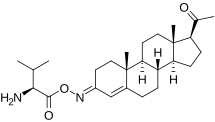
Пока не сложные эфиры, C3 и C20 оксим конъюгирует прогестерона, такого как карбоксиметилоксим прогестерона (прогестерон 3- (О-карбоксиметил) оксим; П4-3-СМО), P1-185 (прогестерон 3-О-(L-валин) -E-оксим), EIDD-1723 (прогестерон (20E)-20-[О- [(фосфоноокси) метил] оксим] натриевая соль), EIDD-036 (прогестерон 20-оксим) и ВОЛЬТ-02 (химическая структура не выпущена), были разработаны как вода прогестерон и пролекарства нейростероидов, хотя ни одно из них еще не завершено клинических разработок и не поступило в продажу.[28][29][30][31][32][33]
Некоторые прогестины 19-нортестостерона, включая продаваемые прогестины Norgestimate и норэлгестромин и нерыночный прогестин оксим ацетата норэтистерона, представляют собой оксимы C3, хотя они обладают собственной сильной прогестагенной активностью и не обязательно являются пролекарствами соответствующих кетоны.[34]
Смотрите также
- Список эфиров прогестагена
- Стероидный эфир
- Эстрогеновый эфир
- Андрогенный эфир
- Список эфиров стероидов
- Список прогестагенов
использованная литература
- ^ а б Фрейзер, Ян С. (1998). Эстрогены и прогестагены в клинической практике. Черчилль Ливингстон. п. 13. ISBN 978-0-443-04706-0.
- ^ а б c d Лобо, Роджер; Crosignani, P.G .; Паолетти, Родольфо (31 октября 2002 г.). Женское здоровье и менопауза: новые стратегии - улучшение качества жизни. Springer Science & Business Media. С. 91–. ISBN 978-1-4020-7149-2.
- ^ а б c Корольковас, Андреюс (16 августа 1988 г.). Основы медицинской химии. Вайли. п. 1021. ISBN 978-0-471-88356-2.
- ^ а б c d е Равина, Энрике (11 января 2011 г.). Эволюция открытия лекарств: от традиционных лекарств к современным лекарствам. Джон Вили и сыновья. С. 174–175, 194. ISBN 978-3-527-32669-3.
- ^ Обзор Рош ... Хоффман-Ля Рош и Рош-органон. 1944 г.
- ^ Коренчевский В, Деннисон М, Элдридж М (1937). «Длительное лечение кастрированных и овариэктомированных крыс пропионатом тестостерона». Biochem. J. 31 (3): 475–85. Дои:10.1042 / bj0310475. ЧВК 1266958. PMID 16746360.
- ^ а б Шарль Евхаристия Медичи Сажус (1939). Аналитическая циклопедия практической медицины. Дэвис. п. 75.
- ^ ИЮПАК, Сборник химической терминологии 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "сложные эфиры ". Дои:10.1351 / goldbook.E02219
- ^ Корегуляторы ядерных рецепторов. Академическая пресса. 11 августа 2004 г. С. 69–. ISBN 978-0-08-052288-3.
- ^ а б Снидер, Уолтер (23 июня 2005 г.). Открытие лекарств: история. Джон Вили и сыновья. С. 204–. ISBN 978-0-471-89979-2.
- ^ Энгель, Леонард (1961). Создатели лекарств Каламазу. Макгроу-Хилл. п. 125.
- ^ Шоуп, Донна (7 ноября 2007 г.). Справочник по контрацепции: руководство по практическому ведению. Springer Science & Business Media. С. 103–. ISBN 978-1-59745-150-5.
- ^ Attardi BJ, Zeleznik A, Simhan H, Chiao JP, Mattison DR, Caritis SN (2007). «Сравнение связывания рецепторов прогестерона и глюкокортикоидов и стимуляции экспрессии генов прогестероном, 17-альфа-гидроксипрогестерона капроатом и родственными прогестинами». Am. J. Obstet. Гинеколь. 197 (6): 599.e1–7. Дои:10.1016 / j.ajog.2007.05.024. ЧВК 2278032. PMID 18060946.
- ^ Вебер, Георг Ф. (22 июля 2015 г.). Молекулярные методы лечения рака. Springer. С. 316–. ISBN 978-3-319-13278-5.
- ^ Робертс, Стэнли М .; Цена, Барри Дж. (1985). Лечебная химия: роль органической химии в исследованиях лекарственных средств. Академическая пресса. ISBN 978-0-12-589730-3.
- ^ а б Элкс, Дж. (14 ноября 2014 г.). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Springer. С. 886–887, 943, 1058. ISBN 978-1-4757-2085-3.
- ^ Международная федерация планируемого родительства. Медицинский комитет. Устная консультативная группа (1965). Справочник по оральной контрацепции. Маленький, Браун. п. 18.
- ^ Burton, Eunice R .; Вахтель, Эрика Г. (1967). «Клинические испытания и цитологическая оценка Enol Luteovis в лечении угрожающего и рецидивирующего аборта». BJOG: Международный журнал акушерства и гинекологии. 74 (4): 533–536. Дои:10.1111 / j.1471-0528.1967.tb03986.x. PMID 5340429.
- ^ Чарман, Уильям Н .; Портер, Кристофер Дж. Х. (1996). «Липофильные пролекарства, предназначенные для лимфатического транспорта кишечника». Расширенные обзоры доставки лекарств. 19 (2): 149–169. Дои:10.1016 / 0169-409X (95) 00105-G.
- ^ Джозеф Боливар Де Ли (1965). ... Ежегодник акушерства и гинекологии. Издатели ежегодников. п. 150.
- ^ Бентли, П. Дж. (1980). Эндокринная фармакология: физиологические основы и терапевтическое применение. КУБОК Архив. С. 274–. ISBN 978-0-521-22673-8.
- ^ Современные лекарства и лекарственные препараты. 1962.
Enol Luteovis (3-циклопентиленоловый эфир прогестерона) является единственным пероральным прогестином, продуцирующим прегнандиол в качестве метаболита. Он не очень эффективен и, вероятно, имеет очень небольшой риск вызвать вирилизирующий эффект на плод женского пола. Таким образом, он более тесно связан с прогестероном, чем другие синтетические прогестины.
- ^ Вермут, Камилла Жорж (2 мая 2011 г.). Практика медицинской химии. Академическая пресса. С. 731–. ISBN 978-0-08-056877-5.
- ^ Лутвак-Манн, Сесилия; Адамс, К. Э. (апрель 1957 г.). «Карбоангидраза в женском репродуктивном тракте. II. Карбоангидраза эндометрия как индикатор лютеоидной активности: корреляция с прогестационной пролиферацией». J. Эндокринол. 15 (1): 43–55. Дои:10.1677 / joe.0.0150043. PMID 13439082.
- ^ а б Пинкус Г., Мияке Т., Меррил А.П., Лонго П. (ноябрь 1957 г.). «Биопробы прогестерона». Эндокринология. 61 (5): 528–33. Дои:10.1210 / эндо-61-5-528. PMID 13480263.
- ^ а б Meli, A .; Wolff, A .; Lucker, W. E .; Стейнец, Б. Г. (1965). «Биологический профиль эфира прогестерона 3-циклопентил енола по сравнению с прогестероном». Экспериментальная биология и медицина. 118 (3): 714–717. Дои:10.3181/00379727-118-29947. PMID 14264537.
- ^ Юнкерманн Х., Руннебаум Б., Лиссабон Б.П. (июль 1977 г.). «Новые метаболиты прогестерона в миометрии человека». Стероиды. 30 (1): 1–14. Дои:10.1016 / 0039-128X (77) 90131-3. PMID 919010.
В биоанализе Клауберга 3β-гидрокси-4-прегнен-20-он показывает примерно такую же эффективность, что и прогестерон (34). Относительно биологической активности 3α-эпимера данные отсутствуют.
- ^ Басу, Кришнакали; Митра, Ашим К. (1990). «Влияние модификации 3-гидразона на метаболизм и связывание белков прогестерона». Международный журнал фармацевтики. 65 (1–2): 109–114. Дои:10.1016 / 0378-5173 (90) 90015-В.
- ^ Вали Б., Саид И., Гатри Д. Б., Натчус М. Г., Туран Н., Лиотта Д. К., Штейн Д. Г. (октябрь 2016 г.). «Оценка нейротерапевтического потенциала водорастворимого аналога прогестерона после черепно-мозговой травмы у крыс». Нейрофармакология. 109: 148–158. Дои:10.1016 / j.neuropharm.2016.05.017. PMID 27267687.
- ^ Гатри Д. Б., Локвуд М. А., Натчус М. Г., Лиотта Д. К., Штейн Д. Г. и Сайид И. (2017). «Аналоги фосфата прогестерона и связанные с ними виды применения» Патент США 9,802,978 .
- ^ МакНевин С.Дж., Атиф Ф., Сайид И., Штейн Д.Г., Лиотта, округ Колумбия (октябрь 2009 г.). «Разработка и проверка водорастворимых аналогов прогестерона и аллопрегнанолона на моделях черепно-мозговой травмы». J. Med. Chem. 52 (19): 6012–23. Дои:10.1021 / jm900712n. PMID 19791804.
- ^ Гатри ДБ, Штейн Д.Г., Лиотта Д.К., Локвуд М.А., Сайид И., Атиф Ф., Аррендейл Р.Ф., Редди Г.П., Эверс Т.Дж., Маренго-младший, Ховард Р.Б., Калвер Д.Г., Натчус М.Г. (май 2012 г.). «Водорастворимые аналоги прогестерона являются эффективными инъекционными препаратами для лечения черепно-мозговой травмы на животных». ACS Med Chem Lett. 3 (5): 362–6. Дои:10,1021 / мл200303р. ЧВК 4025794. PMID 24900479.
- ^ Конъюгат прогестерона - Levolta Pharmaceuticals. springer.com
- ^ Станчик Ф.З. (ноябрь 2003 г.). «Не все прогестины созданы равными». Стероиды. 68 (10–13): 879–90. Дои:10.1016 / j.steroids.2003.08.003. PMID 14667980.
внешние ссылки
 СМИ, связанные с Эфиры прогестагена в Wikimedia Commons
СМИ, связанные с Эфиры прогестагена в Wikimedia Commons
