Апрепитант - Aprepitant
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Исправить |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a604003 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | В рот (капсулы ) |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | 60–65% |
| Связывание с белками | >95% |
| Метаболизм | Печень (по большей части CYP3A4 - опосредованный; некоторые вклады CYP2C19 & CYP1A2 ) |
| Устранение период полураспада | 9–13 часов |
| Экскреция | Моча (5%), фекалии (86%) |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.202.762 |
| Химические и физические данные | |
| Формула | C23ЧАС21F7N4О3 |
| Молярная масса | 534.435 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| (проверять) | |
Апрепитант, продается под торговой маркой Исправить среди прочего, это лекарство, используемое для предотвращения тошнота и рвота, вызванные химиотерапией (CINV) и предотвратить послеоперационная тошнота и рвота.[1] Может использоваться вместе с ондансетрон и дексаметазон.[1] Принимается внутрь.[1]
Общие побочные эффекты включают усталость, потерю аппетита, диарею, боль в животе, икоту, зуд, пневмонию и изменения артериального давления.[1] Другие серьезные побочные эффекты могут включать: анафилаксия.[1] При использовании в беременность не представляется вредным, такое использование недостаточно изучено.[2] Апрепитант относится к классу антагонисты рецептора нейрокинина-1 лекарства.[1] Работает путем блокировки вещество P от прикрепления к Рецепторы NK1.[3]
Апрепитант был одобрен для медицинского применения в Европе и США в 2003 году.[1][3] Это сделано Merck & Co.[1] Это на Список основных лекарственных средств Всемирной организации здравоохранения.[4] Форма, которую может дать инъекция в вену, известный как фосапрепитант также доступен.[1]
Медицинское использование
Апрепитант применяется для предотвращения тошнота и рвота, вызванные химиотерапией (CINV) и предотвратить послеоперационная тошнота и рвота.[1] Безопасность и полезность длительного использования или для тех, у кого уже есть тошнота, неясны.[1]
Может использоваться вместе с ондансетрон и дексаметазон.[1] Принимается внутрь.[1]
Механизм действия
Апрепитант классифицируется как НК1 антагонист потому что он блокирует сигналы, исходящие от NK1 рецепторы. Следовательно, это снижает вероятность рвоты у пациентов.
NK1 это Рецептор, связанный с G-белком расположены в центральной и периферической нервной системе. Этот рецептор имеет доминантный лиганд, известный как Вещество P (SP). SP - это нейропептид, состоящий из 11 аминокислот, который посылает импульсы и сообщения из мозга. Он находится в высоких концентрациях в центр рвоты мозга, и при активации вызывает рвотный рефлекс. В дополнение к этому он также играет ключевую роль в передаче болевых импульсов от периферических рецепторов к центральной нервной системе.
Было показано, что апрепитант подавляет как острую, так и замедленную рвоту, вызванную цитотоксическими химиотерапевтическими препаратами, блокируя попадание вещества P на рецепторы нейронов мозга. Позитронно-эмиссионная томография (ПЭТ) исследования показали, что апрепитант может преодолевать гематоэнцефалический барьер и связываться с NK1 рецепторы в головном мозге человека.[5] Также было показано, что он увеличивает активность Рецептор 5-HT3 антагонисты ондансетрон и кортикостероид дексаметазон, которые также используются для предотвращения тошноты и рвоты, вызванных химиотерапией.[6]
Апрепитант принимают внутрь в форме капсулы. Перед клиническими испытаниями новый класс терапевтических агентов должен быть охарактеризован с точки зрения доклинических исследований метаболизма и экскреции. Средний биодоступность составляет около 60-65%. Апрепитант метаболизируется главным образом CYP3A4 с незначительным метаболизмом CYP1A2 и CYP2C19. В плазме человека были идентифицированы семь метаболитов апрепитанта, которые слабо активны. Как умеренный ингибитор CYP3A4, апрепитант может увеличивать плазменные концентрации совместно вводимых лекарственных средств, которые метаболизируются через CYP3A4. Конкретное взаимодействие было продемонстрировано с оксикодон, где апрепитант увеличивал эффективность и усиливал побочные эффекты оксикодона; однако неясно, связано ли это с ингибированием CPY3A4 или с его действием антагониста NK-1.[7] После в / в введения 14С маркировкой C пролекарство апрепитанта (L-758298), который быстро и полностью превращается в апрепитант, примерно 57% общей радиоактивности выводится с мочой и 45% с калом. Неизмененное вещество не выводится с мочой.[8]
Структура и свойства
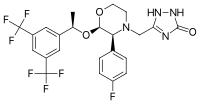
Апрепитант состоит из морфолин ядро с двумя заместителями, присоединенными к соседнему кольцу угли. Эти замещающие группы трифторметилированы. 1-фенилэтанол и фторфенил группа. Апрепитант также имеет третий заместитель (триазолинон ), который присоединен к морфолиновому кольцу азот. В нем три хиральные центры очень близко друг к другу, что в совокупности дает аминоацеталь расположение. Его эмпирическая формула это C23ЧАС21F7N4О3.
Апрепитант кремовый кристаллический твердый что есть молекулярный вес около 534,53. Он имеет очень ограниченный растворимость в воде. Он действительно имеет достаточно высокую растворимость в неполярных молекулах, таких как масла. Таким образом, можно предположить, что апрепитант в целом, несмотря на наличие полярных компонентов, является неполярный субстанция.
Синтез
Вскоре после того, как Merck начала исследования по снижению тяжести и вероятности CINV, исследователи обнаружили, что апрепитант эффективен в профилактике. Исследователи работали над созданием апрепитанта, и в течение короткого времени они пришли к эффективному синтезу этого вещества. Этот оригинальный синтез был признан работоспособным и оказался решающим шагом в достижении коммерциализации; однако компания Merck решила, что этот процесс не является экологически устойчивым. Это было связано с тем, что исходный синтез требовал шести стадий, многие из которых требовали использования опасных химикатов, таких как цианид натрия, диметилтитаноцен и газообразный аммиак. В дополнение к этому, чтобы процесс был эффективным криогенный температура была необходима для некоторых стадий, и на других стадиях образовывались опасные побочные продукты, такие как метан.[9] Экологические проблемы синтеза апрепитанта стали настолько серьезными, что исследовательская группа Merck решила вывести препарат из клинических испытаний и попытаться создать другой синтез апрепитанта.[10]
Ставка на исключение препарата из клинических испытаний оказалась успешной, когда вскоре после этого группа исследователей Merck предложила альтернативный и более экологически чистый синтез апрепитанта. В новом процессе четыре соединения одинакового размера и сложности сливаются вместе. Следовательно, это намного более простой процесс, требующий всего трех шагов, что вдвое меньше, чем при первоначальном синтезе.
Новый процесс начинается с присоединения энантиочистого трифторметилированного фенилэтанола к предшественнику рацемического морфолина. Это приводит к разыскиваемым изомер кристаллизуется на верхней части раствора, и нежелательный изомер остается в растворе. Затем нежелательный изомер превращается в желаемый химиком, контролирующим условия реакции, и происходит процесс, известный как индуцированное кристаллизацией асимметричное превращение. К концу этого шага вторичный амин, основа препарата.
На втором этапе фторфенильная группа присоединяется к морфолиновому кольцу. Как только это будет достигнуто, можно начинать третий и последний шаг. На этом этапе к кольцу добавляется боковая цепь триазолинона. После успешного завершения этого этапа образуется стабильная молекула апрепитанта.[11]
Этот более оптимизированный маршрут дает примерно на 76% больше прочности, чем исходный процесс, и значительно снижает эксплуатационные расходы. Кроме того, новый процесс также снижает количество необходимого растворителя и реагентов примерно на 80% и позволяет сэкономить примерно 340 000 литров на тонну производимого апрепитанта.[10]
Улучшения в процессе синтеза также снизили долгосрочный ущерб окружающей среде, связанный с первоначальной процедурой, благодаря исключению использования нескольких опасных химикатов.
История
Он был одобрен Управление по контролю за продуктами и лекарствами (FDA) в 2003 году.[12] В 2008, фосапрепитант, внутривенная форма апрепитанта была одобрена в США.
Исследование
Большая депрессия
Планы по развитию апрепитанта как антидепрессант были сняты.[13] Впоследствии другие испытания с NK1 антагонисты рецепторов, казопитант и орвепитант, показали многообещающие результаты.[14][15][16]
Помимо предложений о том, что занятость рецептора ПЭТ не должна использоваться в повседневной практике для ограничения дозировки по новым медицинским показаниям для этого класса,[17] или что для устойчивых психофармакологических или других терапевтических эффектов может потребоваться> 99% занятости рецепторов человека,[16] критический научный анализ и обсуждение вышеперечисленных данных может потребоваться для того, чтобы апрепитант, и класс NK1 антагонистов в целом, для выполнения доклинических предсказаний полезности помимо CINV (например, для других психических расстройств, зависимостей, нейропатической боли, мигрени, остеоартрита, гиперактивного мочевого пузыря, воспалительного заболевания кишечника и других заболеваний с подозрением на воспалительные или иммунологические компоненты. Однако большая часть данных остается патентованные и, следовательно, обзоры расширенного клинического потенциала таких препаратов, как апрепитант, варьируются от оптимистических[18] к бедным.[19]
Рекомендации
- ^ а б c d е ж грамм час я j k л м "Монография по апрепитанту / фосапрепитанту димеглумина для профессионалов". Drugs.com. Получено 13 октября 2019.
- ^ «Апрепитант во время беременности». Drugs.com. Получено 13 октября 2019.
- ^ а б "Исправить". Европейское агентство по лекарствам. 17 сентября 2018 г.. Получено 13 октября 2019.
- ^ Всемирная организация здоровья (2019). Типовой список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г.. Женева: Всемирная организация здравоохранения. HDL:10665/325771. WHO / MVP / EMP / IAU / 2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ Bergström, M; Харгривз, Р. Дж.; Бернс, HD; и другие. (Май 2004 г.). «Исследования с использованием позитронно-эмиссионной томографии человека для определения занятости рецептора нейрокинина-1 мозга апрепитантом». Биологическая психиатрия. 55 (10): 1007–1012. Дои:10.1016 / j.biopsych.2004.02.007. PMID 15121485. S2CID 21071199.
- ^ Гралла Р., де Вит Р., Херрстедт Дж., Каридес А., Янус Дж., Гуогуанг-Ма Дж., Эванс Дж., Хорган К. (2005). «Противорвотная эффективность антагониста нейрокинина-1, апрепитанта, плюс антагониста 5HT3 и кортикостероида у пациентов, получающих антрациклины или циклофосфамид в дополнение к цисплатину в высоких дозах: анализ объединенных данных двух рандомизированных клинических испытаний фазы III». Рак. 104 (4): 864–8. Дои:10.1002 / cncr.21222. PMID 15973669. S2CID 24860776.
- ^ Walsh, S.L .; Heilig, M .; Нуццо, П. А .; Henderson, P .; Лофуолл, М. Р. (2012). «Влияние антагониста NK1, апрепитанта, на реакцию на пероральный и интраназальный оксикодон у лиц, злоупотребляющих опиоидами по рецепту». Биология зависимости. 18 (2): 332–43. Дои:10.1111 / j.1369-1600.2011.00419.x. ЧВК 4354863. PMID 22260216.
- ^ Справочный пакет Консультативного комитета FDA
- ^ Хейл, Джеффри Дж. (1998). «Оптимизация структуры с получением 2- (R) - (1- (R) -3,5-бис (трифторметил) фенилэтокси) -3- (S) - (4-фтор) фенил-4- (3-оксо-1, 2,4-триазол-5-ил) метилморфолин, мощный, активный при пероральном приеме, длительно действующий антагонист рецептора человеческого NK-1 морфолин-ацеталь ». Журнал медицинской химии. 41 (23): 4607–4614. Дои:10.1021 / jm980299k. PMID 9804700.
- ^ а б Харгривз, Ричард (2011). «Разработка апрепитанта, первого антагониста рецептора нейрокинина-1 для предотвращения тошноты и рвоты, вызванных химиотерапией». Летопись Нью-Йоркской академии наук. 1222 (1): 40–48. Bibcode:2011НЯСА1222 ... 40ч. Дои:10.1111 / j.1749-6632.2011.05961.x. PMID 21434941. S2CID 21202644.
- ^ Бренды, Карел М. Дж. (2003). «Эффективный синтез апрепитанта антагониста рецептора NK1 с использованием диастереоселективной трансформации, индуцированной кристаллизацией †». Журнал Американского химического общества. 125 (8): 2129–2135. Дои:10.1021 / ja027458g. PMID 12590540.
- ^ «Пакет одобрения лекарственных средств: EMEND (Aprepitant) NDA № 21-549». Получено 2011-04-19.
- ^ Рупняк, СМП; Крамер, М.С. (1 декабря 2017 г.). «Антагонисты рецепторов NK1 при депрессии: почему от утвержденной концепции отказались». Журнал аффективных расстройств. 223: 121–125. Дои:10.1016 / j.jad.2017.07.042. PMID 28753469.
- ^ Ратти, Э; Bellew, K; Bettica, P; Брайсон, Н; Замунер, С; Арчер, G; Squassante, L; Пока, А; Трист, Д; Кришнан, К. Р .; Фернандес, S (2011). «Результаты 2 рандомизированных двойных слепых плацебо-контролируемых исследований нового антагониста рецепторов NK1 казопитанта у пациентов с большим депрессивным расстройством». Журнал клинической психофармакологии. 31 (6): 727–33. Дои:10.1097 / JCP.0b013e31823608ca. PMID 22020354. S2CID 24609826.
- ^ Trist, DG; Ратти, Э; Пока, А (2013). «Почему резерв рецепторов имеет значение для антагонистов рецепторов нейрокинина-1 (NK1)». J. Recept. Сигнал Transduct. Res. 33 (6): 333–7. Дои:10.3109/10799893.2013.843194. PMID 24106886. S2CID 21799710.
- ^ а б Ратти, Э; Bettica, P; Александр, Р; Арчер, G; Карпентер, Д. Евонюк, Г; Gomeni, R; Лоусон, Э; Лопес, М; Millns, H; Rabiner, E. A .; Трист, Д; Trower, M; Замунер, С; Кришнан, Р. Фава, М. (2013). «Полная блокада центрального рецептора нейрокинина-1 необходима для эффективности при депрессии: данные или клинические исследования». Журнал психофармакологии. 27 (5): 424–34. Дои:10.1177/0269881113480990. PMID 23539641. S2CID 6523822.
- ^ Barrett, J. S .; Макгуайр, Дж; Везина, Н; Спицин, С; Дуглас, С. Д. (2013). «ПЭТ-измерение занятости рецепторов как инструмент для выбора дозы в нейрофармакологии: задаем ли мы правильные вопросы?». Журнал клинической психофармакологии. 33 (6): 725–8. Дои:10.1097 / JCP.0b013e3182a88654. PMID 24100788.
- ^ Herpfer, I; Либ, К. (2005). «Антагонисты рецептора вещества P в психиатрии: обоснование развития и терапевтический потенциал». Препараты ЦНС. 19 (4): 275–93. Дои:10.2165/00023210-200519040-00001. PMID 15813642. S2CID 25497814.
- ^ Грибель, G; Holsboer, F (2012). «Лиганды нейропептидных рецепторов как лекарства от психических заболеваний: конец начала?». Обзоры природы Drug Discovery. 11 (6): 462–478. Дои:10.1038 / nrd3702. PMID 22596253. S2CID 10721248.
внешняя ссылка
- «Апрепитант». Портал информации о наркотиках. Национальная медицинская библиотека США.
