N-Формилметионин-лейцил-фенилаланин - N-Formylmethionine-leucyl-phenylalanine
 | |
| Имена | |
|---|---|
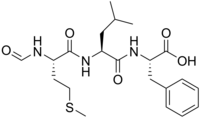
| Название ИЮПАК (2S)-2-[[(2S)-2-[[(2S) -2-формамидо-4-метилсульфанилбутаноил] амино] -4-метилпентаноил] амино] -3-фенилпропановая кислота. | |
| Другие имена | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| MeSH | N-формилметионин + лейцил-фенилаланин |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C21ЧАС31N3О5S | |
| Молярная масса | 437.56 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
N-Формилметионил-лейцил-фенилаланин (fMLF, fMLP или же N-формил-мет-лей-фен) является N-формилированный трипептид а иногда просто называют хемотаксический пептид это мощный полиморфноядерный лейкоцит (PMN) хемотаксический фактор а также макрофаг активатор.[2]
fMLF - это прототип N-формилированный олигопептид семейство хемотаксических факторов. Эти олигопептиды, как известно, являются или имитируют действие N-формилолигопептиды, которые (а) высвобождаются тканевыми бактериями, (б) привлекают и активируют циркулирующие лейкоциты крови путем связывания со специфическими G-белковые рецепторы на эти клетки, и (c) тем самым направляют воспалительный ответ к участкам бактериальной инвазии. fMLF участвует в врожденный иммунитет механизм защиты хозяина от патогены.
fMLF привел к первому открытию лейкоцитарного рецептора для хемотаксического фактора, определил три различных типа рецепторов fMLF, которые имеют комплементарные и / или противоположные эффекты на воспалительные реакции, а также многие другие активности, и помог определить механизмы сочетания стимула и ответа с помощью которые различные хемотаксические факторы и их рецепторы, связанные с G-белком, индуцируют клеточную функцию.
Открытие
В 1887 г. Эли Мечников заметил, что лейкоциты изолированные из крови различных животных привлекали определенные бактерии.[3] Вскоре было предложено, что это притяжение связано с растворимыми элементами, выделяемыми бактериями. [4] (см. Харрис[5] для обзора этой области до 1953 г.). Питер Уорд, Элмер Беккер, Генри Шоуэлл и его коллеги показали, что эти элементы были созданы различными растениями. грамположительные бактерии и грамотрицательные бактерии и были на низком уровне молекулярный вес, т.е. ниже 3600 Дальтон (единица) с.[6][7][8] Дальнейшие исследования Шиффманна и колледжей показали, что культуры выращивания кишечная палочка высвободил олигопептиды от 150 до 1500 дальтон, которые, по-видимому, имели свободный Карбоновая кислота группа, но не бесплатная Амин группа.[9]
Учитывая эти подсказки и знания о том, что бактерии транскрибируют (см. Транскрипция (генетика) ) белки, начинающиеся с N-формилметионин в то время как эукариотические клетки в основном инициируют синтез белка с помощью неформилированного метионина, Шиффманн, Коркоран и Валь предположили, а затем показали, что N-формил-метионин и ряд N-формил-метионил дипептиды и трипептиды стимулировали хемотаксис нейтрофилы выделен из перитонеального экссудата кролика, а также из макрофагов, выделенных из перитонеального экссудата морских свинок.[10] В дальнейших исследованиях различных N-формилированные олигопептиды, fMLF оказались наиболее эффективными в стимуляции хемотаксиса нейтрофилов кроликов.[7] fMLF и выборка других, менее эффективных, NЗатем было обнаружено, что -формилолигопептиды стимулируют широкий спектр функций нейтрофилов кроликов, таких как: временная аутоагрегация этих клеток в суспензии.[11] и столь же кратковременное падение циркулирующих нейтрофилов при введении в вены кролика (эти ответы являются результатом увеличения адгезии нейтрофилов друг к другу и / или эндотелию сосудов);[12] выпуск (см. дегрануляция ) внутриклеточных ферментов, связанных с гранулами, и других противомикробный цитотоксический молекулы; и производство и высвобождение цитотоксических активные формы кислорода Такие как Супероксид и пероксид водорода.[7][13] Все эти ответы являются частью врожденная иммунная система начальная линия защиты от бактериальных вторжений.
Последующие исследования показали, что гены митохондрий и органелл хлоропластов Эукариот клетки, в том числе и человека, которые, в отличие от ядерных генов, кодируют N-формил-метиониновые белки, высвобождение N-формил-метионилсодержащие пептиды с хемотаксической активностью, точно имитирующей хемотаксис fMLF[14] Эти образованные из органелл формилированные пептиды являются настоящими аналогами fMLF, которые действуют через рецепторы fMLF, рекрутируя циркулирующие лейкоциты крови и тем самым инициируя воспалительные реакции в местах повреждения клеток и разрушения тканей, не вызванных бактериями.[15] fMLF и другие N-формилированные олигопептиды оказались столь же активными в отношении нейтрофилов человека.[16][17] Высокая степень структурной специфичности широкого ряда формилированных пептидов в стимуляции этих ответов нейтрофилов, специфическое связывание N-формилированные олигопептиды к нейтрофилам со сродством, которое соответствует их стимулирующим свойствам,[18] способность т-карбобензоксифенилаланилметионин, связывающийся с нейтрофилами, но не стимулирующий его, и тем самым блокирует связывание нейтрофилов и стимулирует активность N-формилированных олигопептидов,[19][20] и способность формилированных олигопептидов десенсибилизировать (то есть делать невосприимчивыми) функциональные ответы нейтрофилов на самих себя, но не обладают способностью десенсибилизировать к ряду других хемотаксических стимулов или обладают меньшей способностью[21][22] предоставили убедительные доказательства того, что формилированные пептиды действуют на клетки через общую специализированную рецепторную систему, которая отличается от рецепторов других хемотаксических факторов.
Рецепторы
Приведенные выше исследования приводят к возможному клонирование человека Формилпептидный рецептор 1, а Рецептор, связанный с G-белком который связывает fMLF и другие формилированные олигопептиды, опосредуя их стимулирующее действие на нейтрофилы человека и кролика. Впоследствии Формилпептидный рецептор 2 и Формилпептидный рецептор 3 были также клонированы на основании сходства их аминокислотной последовательности с аминокислотной последовательностью рецептора формилпептида 1. Рецепторы формилпептида 2 и 3 имеют очень разные способности связываться и отвечать на формилированные олигопептиды, включая fMLF, по сравнению с рецептором формилпептида 1 и по сравнению друг с другом. и имеют очень разные функции, чем рецепторы формилпептида 1.[23]
Рекомендации
- ^ н-формилметионин, лейцил-фенилаланин, Cancerweb
- ^ Panaro MA, Mitolo V (август 1999 г.). «Сотовые ответы на вызов fMLF: мини-обзор». Иммунофармакология и иммунотоксикология. 21 (3): 397–419. Дои:10.3109/08923979909007117. PMID 10466071.
- ^ Мечников Э. (1887). "Sur la lutte des cellules de l'organisme contre l'invasion des microbes". Анна. Inst. Пастер. 1: 321.
- ^ Гравиц П. (1887 г.). "неизвестный". Virchows Adz. IIO. я. Cite использует общий заголовок (помощь)
- ^ Харрис Х (июль 1954 г.). «Роль хемотаксиса в воспалении». Физиологические обзоры. 34 (3): 529–62. Дои:10.1152 / Physrev.1954.34.3.529. PMID 13185754.
- ^ Ward PA, Lepow IH, Newman LJ (апрель 1968 г.). «Бактериальные факторы хемотаксии на полиморфноядерные лейкоциты». Американский журнал патологии. 52 (4): 725–36. ЧВК 2013377. PMID 4384494.
- ^ а б c Шоуэлл HJ, Фрир Р.Дж., Зигмонд С.Х., Шиффманн Э., Асуаникумар С., Коркоран Б., Беккер Э.Л. (май 1976 г.). «Отношения структура-активность синтетических пептидов как хемотаксических факторов и индукторов лизосомальной секреции нейтрофилов». Журнал экспериментальной медицины. 143 (5): 1154–69. Дои:10.1084 / jem.143.5.1154. ЧВК 2190180. PMID 1262785.
- ^ Becker EL, Showell HJ (июнь 1974 г.). «Способность хемотаксических факторов вызывать высвобождение лизосомальных ферментов. II. Механизм высвобождения». Журнал иммунологии. 112 (6): 2055–62. PMID 4825785.
- ^ Schiffmann E, Showell HV, Corcoran BA, Ward PA, Smith E, Becker EL (июнь 1975 г.). «Выделение и частичная характеристика хемотаксических факторов нейтрофилов от Escherichia coli». Журнал иммунологии. 114 (6): 1831–7. PMID 165239.
- ^ Шиффманн Э., Коркоран Б.А., Валь С.М. (март 1975 г.). «N-формилметионилпептиды как хемоаттрактанты для лейкоцитов». Труды Национальной академии наук Соединенных Штатов Америки. 72 (3): 1059–62. Дои:10.1073 / pnas.72.3.1059. ЧВК 432465. PMID 1093163.
- ^ O'Flaherty JT, Kreutzer DL, Ward PA (июль 1977 г.). «Агрегация нейтрофилов и набухание, вызванные хемотаксическими агентами». Журнал иммунологии. 119 (1): 232–9. PMID 874320.
- ^ O'Flaherty JT, Showell HJ, Ward PA (май 1977 г.). «Нейтропения, вызванная системным введением хемотаксических факторов». Журнал иммунологии. 118 (5): 1586–9. PMID 858915.
- ^ Беккер Э.Л., Сигман М., Оливер Дж. М. (апрель 1979 г.). «Производство супероксида, индуцированное в полиморфно-ядерных лейкоцитах кролика синтетическими хемотаксическими пептидами и A23187». Американский журнал патологии. 95 (1): 81–97. ЧВК 2042294. PMID 219701.
- ^ Carp H (январь 1982 г.). «Митохондриальные N-формилметиониловые белки как хемоаттрактанты нейтрофилов». Журнал экспериментальной медицины. 155 (1): 264–75. Дои:10.1084 / jem.155.1.264. ЧВК 2186576. PMID 6274994.
- ^ Дорвард Д.А., Лукас С.Д., Чепмен Г.Б., Хаслет С., Дхаливал К., Росси А.Г. (май 2015 г.). «Роль формилированных пептидов и рецептора формилпептида 1 в управлении функцией нейтрофилов во время острого воспаления». Американский журнал патологии. 185 (5): 1172–84. Дои:10.1016 / j.ajpath.2015.01.020. ЧВК 4419282. PMID 25791526.
- ^ O'Flaherty JT, Kreutzer DL, Ward PA (март 1978 г.). «Хемотаксический фактор влияет на агрегацию, набухание и адгезию чужеродных поверхностей лейкоцитов человека». Американский журнал патологии. 90 (3): 537–50. ЧВК 2018255. PMID 564610.
- ^ Lehmeyer JE, Snyderman R, Johnston RB (июль 1979 г.). «Стимуляция окислительного метаболизма нейтрофилов хемотаксическими пептидами: влияние концентрации ионов кальция и цитохалазина B и сравнение со стимуляцией форболмиристата ацетатом». Кровь. 54 (1): 35–45. Дои:10.1182 / кровь.V54.1.35.35. PMID 444673.
- ^ Aswanikumar S, Corcoran B, Schiffmann E, Day AR, Freer RJ, Showell HJ, Becker EL (январь 1977 г.). «Демонстрация рецептора на нейтрофилах кролика для хемотаксических пептидов». Сообщения о биохимических и биофизических исследованиях. 74 (2): 810–7. Дои:10.1016 / 0006-291x (77) 90375-8. PMID 836328.
- ^ Шиффманн, Э., Б. А. Коркоран и А. Асуаникумар. (1978). «Молекулярные события в ответ нейтрофилов на синтетические N-формилметиониновые хемотаксические пептиды». В Дж. А. Галлине; П. Г. Куи (ред.). Хемотаксис лейкоцитов: методология, физиология, клиническое значение. Нью-Йорк: Raven Press.CS1 maint: несколько имен: список авторов (связь)
- ^ O'Flaherty JT, Showell HJ, Kreutzer DL, Ward PA, Becker EL (апрель 1978 г.). «Ингибирование нейтрофильных реакций in vivo и in vitro на хемотаксические факторы конкурентным антагонистом». Журнал иммунологии. 120 (4): 1326–32. PMID 641351.
- ^ O'Flaherty JT, Kreutzer DL, Showell HS, Becker EL, Ward PA (декабрь 1978 г.). «Десенсибилизация реакции агрегации нейтрофилов на хемотаксические факторы». Американский журнал патологии. 93 (3): 693–706. ЧВК 2018345. PMID 717543.
- ^ O'Flaherty JT, Kreutzer DL, Showell HJ, Vitkauskas G, Becker EL, Ward PA (март 1979 г.). «Избирательная десенсибилизация нейтрофилов к хемотаксическим факторам». Журнал клеточной биологии. 80 (3): 564–72. Дои:10.1083 / jcb.80.3.564. ЧВК 2110355. PMID 457760.
- ^ Li Y, Ye D (июль 2013 г.). «Молекулярная биология рецепторов формилового пептида при заболеваниях человека». Журнал молекулярной медицины. 91 (7): 781–9. Дои:10.1007 / s00109-013-1005-5. PMID 23404331. S2CID 150459.
внешняя ссылка
- N-формилметионин, лейцил-фенилаланин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
