Болезнь Шагаса - Chagas disease
| Болезнь Шагаса | |
|---|---|
| Другие имена | Американский трипаносомоз |
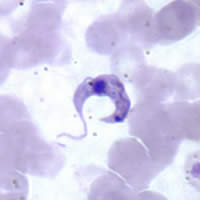 | |
| Микрофотография Гимза окрашенный Trypanosoma cruzi | |
| Произношение |
|
| Специальность | Инфекционное заболевание |
| Симптомы | Лихорадка, большие лимфатические узлы, головная боль[1] |
| Осложнения | Сердечная недостаточность, увеличенный пищевод, увеличенная толстая кишка[1] |
| Причины | Trypanosoma cruzi распространяться целовать жуков[1] |
| Диагностический метод | Поиск паразита, его ДНК или антитела в крови[2] |
| Профилактика | Устранение поцелуев и избегание их укусов[1] |
| Медикамент | Бензнидазол, нифуртимокс[1] |
| Частота | 6,2 миллиона (2017)[3] |
| Летальные исходы | 7,900 (2017)[4] |
Болезнь Шагаса, также известный как Американский трипаносомоз, это тропический паразитарная болезнь вызванный Trypanosoma cruzi.[1] Распространяется в основном насекомыми, известными как Triatominae, или «целовать жуков».[1] Симптомы меняются с течением инфекции. На ранней стадии симптомы обычно либо отсутствуют, либо легкие и могут включать жар, опухоль. лимфатический узел, головные боли или припухлость в месте укуса.[1] Через четыре-восемь недель у нелеченных людей наступает хроническая фаза заболевания, которая в большинстве случаев не вызывает дальнейших симптомов.[2][5] У 45% людей с хронической инфекцией развивается сердечное заболевание 10–30 лет после первоначального заболевания, которое может привести к сердечная недостаточность.[2] Пищеварительные осложнения, включая увеличенный пищевод или увеличенная толстая кишка, может также возникнуть у 21% людей, и до 10% людей могут испытывать повреждение нервов.[2]
T. cruzi обычно передается людям и другим млекопитающим через укусы поцелуев.[6] Заболевание также может передаваться через переливание крови, трансплантация органов, употребление пищи, зараженной паразитами, и вертикальная передача (от матери к ребенку).[1] Диагностика раннего заболевания заключается в обнаружении паразита в крови с помощью микроскопа или обнаружении его ДНК к полимеразной цепной реакции.[5] Хроническое заболевание диагностируется путем обнаружения антитела за T. cruzi в крови.[7] Поражает более 150 видов животных.[8]
Профилактика направлена на устранение целующихся насекомых и избежание их укусов.[1] Это может включать использование инсектициды или же надкроватные сетки.[9] Другие профилактические меры включают скрининг крови, используемой для переливания.[1] По состоянию на 2019 год[Обновить], вакцина не разработана.[1] Ранние инфекции поддаются лечению с помощью лекарств. бензнидазол или же нифуртимокс, которые обычно излечивают болезнь, если их вводят вскоре после заражения человека, но становятся менее эффективными, чем дольше человек болел болезнью Шагаса.[1] При использовании при хронических заболеваниях лекарства могут отсрочить или предотвратить развитие симптомов терминальной стадии.[1] Бензнидазол и нифуртимокс часто вызывают побочные эффекты, включая кожные заболевания, раздражение пищеварительной системы и неврологические симптомы, что может привести к прекращению лечения.[1][2] По состоянию на 2019 год[Обновить], новые лекарства от болезни Шагаса находятся в стадии разработки, а экспериментальные вакцины изучаются на животных моделях.[10][11]
По оценкам, по состоянию на 2017 год 6,2 миллиона человек, в основном в Мексике, Центральной Америке и Южной Америке, страдали болезнью Шагаса.[1][3] в результате, по оценкам, погибло 7900 человек.[4] Большинство людей с болезнью бедны,[12] и большинство из них не осознают, что инфицированы.[13] Крупномасштабные перемещения населения увеличили районы, где обнаружена болезнь Шагаса, в том числе многие европейские страны и Соединенные Штаты.[1] Заболевание впервые было описано в 1909 году бразильским врачом. Карлос Шагас, в честь кого назван.[1] Болезнь Шагаса классифицируется как забытая тропическая болезнь.[14]
Признаки и симптомы

Болезнь Шагаса протекает в две стадии: острый стадия, которая развивается через одну-две недели после укуса насекомого, и хронический этап, который развивается на протяжении многих лет.[2][5][15] Острая стадия часто протекает без симптомов.[2] При наличии симптомы обычно незначительны и не специфичны для какого-либо конкретного заболевания.[5] Признаки и симптомы включают жар, недомогание, головная боль и увеличение печени, селезенка, и лимфатический узел.[1][2][5] В редких случаях у людей появляется опухший узел на месте инфекции, который называется «признаком Романа», если он находится на веке, или «чагомой», если он находится в другом месте кожи.[5][16] В редких случаях (менее 1–5%) у инфицированных людей развивается тяжелое острое заболевание, которое может вызывать опасные для жизни скопление жидкости вокруг сердца, или же воспаление из сердце или же мозг и окружающие ткани.[2] Острая фаза обычно длится от четырех до восьми недель и проходит без лечения.[2]
Если их не лечить противопаразитарные препараты, люди остаются хронически инфицированными T. cruzi после выздоровления от острой фазы.[2] Большинство хронических инфекций протекают бессимптомно, что называется неопределенный хроническая болезнь Шагаса.[2] Однако за десятилетия хронической болезни Шагаса у 30-40% людей развивается дисфункция органов (определенный хроническая болезнь Шагаса), которая чаще всего поражает сердце или же пищеварительная система.[2][5]
Наиболее частым проявлением является сердечное заболевание, который встречается у 14–45% людей с хронической болезнью Шагаса.[2] Люди с болезнью сердца Шагаса часто испытывают учащенное сердцебиение и иногда обморок из-за нерегулярной работы сердца.[17] К ЭКГ, у людей с болезнью сердца Шагаса чаще всего аритмии.[17] По мере прогрессирования болезни сердце желудочки увеличиваться (дилатационная кардиомиопатия ), что снижает его способность перекачивать кровь.[17] Во многих случаях первым признаком болезни сердца Шагаса является: сердечная недостаточность, тромбоэмболия, или боль в груди, связанная с аномалиями в микрососудистая сеть.[17]
Также при хронической болезни Шагаса часто встречается поражение пищеварительной системы, особенно увеличение пищевод или же двоеточие, которым страдают 10–21% людей.[2] Те, у кого увеличенный пищевод часто испытывают боль (одинофагия ) или проблемы с глотанием (дисфагия ), кислотный рефлюкс, кашель и потеря веса.[2] Лица с увеличенная толстая кишка часто испытывают запор, что может привести к серьезным закупорка кишечника или его кровоснабжение.[2] До 10% хронически инфицированных людей развиваются повреждение нерва это может привести к онемению и изменению рефлексов или движений.[2] Хотя хроническое заболевание обычно развивается в течение десятилетий, у некоторых людей с болезнью Шагаса (менее 10%) развивается поражение сердца сразу после острого заболевания.[17]
Признаки и симптомы у людей, инфицированных T. cruzi через менее распространенные маршруты. У людей, инфицированных в результате употребления паразитов, в течение трех недель после употребления обычно развивается тяжелое заболевание с симптомами, включая жар, рвота, одышка, кашель, и боль в груди, брюшная полость, и мышцы.[2] Те зараженные врожденный обычно имеют несколько симптомов или вообще не имеют, но могут иметь легкие неспецифические симптомы или серьезные симптомы, такие как желтуха, респираторный дистресс, и проблемы с сердцем.[2] Люди, инфицированные в результате трансплантации органов или переливание крови как правило, имеют симптомы, аналогичные симптомам трансмиссивных болезней, но симптомы могут не проявляться в течение от недели до пяти месяцев.[2] Хронически инфицированные люди, у которых наблюдается подавление иммунитета из-за ВИЧ-инфекции, могут страдать особенно тяжелым и отчетливым заболеванием, наиболее часто характеризующимся воспалением в головном мозге и окружающей ткани или абсцессы головного мозга.[5] Симптомы сильно различаются в зависимости от размера и расположения абсцессов головного мозга, но обычно включают лихорадку, головные боли, судороги, потерю чувствительности или другие неврологические проблемы которые указывают на определенные участки повреждения нервной системы.[18] Иногда эти люди также испытывают острое воспаление сердца, поражения кожи и заболевания желудка, кишечника или брюшина.[5]
Причина
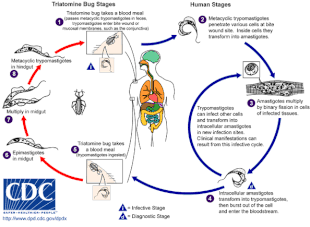
Болезнь Шагаса вызывается инфицированием простейшие паразит T. cruzi, который обычно попадает в организм человека при укусе триатомовых клопов, также называемых «целующимися клопами».[5] В месте укуса подвижный T. cruzi формы, называемые трипомастиготами, проникают в различные клетки-хозяева.[6] Внутри клетки-хозяина паразит трансформируется в репликативную форму, называемую амастиготой, которая проходит несколько циклов репликации.[6] Реплицированные амастиготы снова превращаются в трипомастиготы, которые разрывают хозяйскую клетку и попадают в кровоток.[2] Затем трипомастиготы распространяются по всему телу в различные ткани, где они проникают в клетки и размножаются.[2] В течение многих лет циклы репликации паразитов и иммунного ответа могут серьезно повредить эти ткани, особенно сердце и пищеварительный тракт.[2]
Передача инфекции

T. cruzi возможно переданный различными триатомными ошибками в родах Триатома, Панстронгил, и Родниус.[2] Главная векторов для заражения человека - это виды триатомовых клопов, населяющих человеческие жилища, а именно Triatoma infestans, Родниус проликсус, Triatoma dimidiata и Panstrongylus megistus.[19] Эти насекомые известны под несколькими местными названиями, в том числе винчука в Аргентине, Боливии, Чили и Парагвае, Барбейро (в парикмахер ) в Бразилии, пито в Колумбии, чинч в Центральной Америке и чипо в Венесуэле.[20] Жуки, как правило, питаются ночью, предпочитая влажные поверхности возле глаз или рта.[15][19] Триатоминовый клоп может заразиться T. cruzi когда он питается зараженным хозяином.[15] T. cruzi воспроизводится в кишечном тракте насекомого и выделяется с фекалиями.[15] Когда зараженный триатомин питается, он протыкает кожу и попадает в кровяная мука, одновременно испражняйтесь, чтобы освободить место для новой еды.[15] Укус обычно безболезненный, но вызывает зуд.[15] Почесывание укуса вводит T. cruzi-наложенный кал в рану от укуса, инициируя инфекцию.[15]
В дополнение к классическому переносчику, болезнь Шагаса может передаваться через пищу или питье, зараженные насекомыми-триатомами или их фекалиями.[21] Поскольку нагревание или сушка убивают паразитов, напитки и особенно фруктовые соки являются наиболее частым источником инфекции.[21] Этот путь передачи был причастен к нескольким вспышкам, где он приводил к необычно серьезным симптомам, вероятно, из-за инфекции с более высокой нагрузкой паразитов, чем от укуса триатомового жука.[7][21]
T. cruzi также может передаваться независимо от триатоминового клопа во время переливания крови, после трансплантации органов или через плаценту во время беременности.[2] Переливание крови инфицированного донора заражает реципиента в 10–25% случаев.[2] Чтобы предотвратить это, сдача крови проверяется на T. cruzi во многих странах с эндемической болезнью Шагаса, а также в США.[7] Точно так же трансплантация твердых органов от инфицированного донора может передавать T. cruzi получателю.[2] Это особенно актуально для трансплантата сердца, который передает T. cruzi В 75–100% случаев и меньше при трансплантации печени (0–29%) или почки (0–19%).[2] Зараженная мать также может передать T. cruzi ребенку через плаценту; это происходит до 15% рождений инфицированными матерями.[22] По состоянию на 2019 год 22,5% новых случаев инфицирования произошли в результате врожденной передачи.[23]
Патофизиология

В острой фазе болезни признаки и симптомы вызваны непосредственно репликацией T. cruzi и иммунная система ответ на это.[2] На этом этапе T. cruzi может быть обнаружен в различных тканях по всему телу и циркулирует в крови.[2] В течение первых недель заражения размножение паразитов находится под контролем за счет производства антитела и активация хоста воспалительная реакция, особенно клетки, которые нацелены внутриклеточные патогены Такие как NK-клетки и макрофаги, которую вел молекулы, сигнализирующие о воспалении подобно TNF-α и IFN-γ.[2]
Во время хронической болезни Шагаса долговременное повреждение органов развивается в течение многих лет из-за продолжающегося размножения паразита и повреждения иммунной системы. В начале болезни T. cruzi часто встречается в поперечно-полосатые мышечные волокна сердца.[24] По мере прогрессирования болезни сердце обычно увеличивается в размерах, при этом значительные участки волокон сердечной мышцы замещаются рубцовая ткань и толстый.[24] Области активного воспаления разбросаны по всему сердцу, и в каждой из них находятся воспалительные иммунные клетки, обычно макрофаги и Т-клетки.[24] На поздних стадиях болезни паразиты редко обнаруживаются в сердце и могут присутствовать только в очень малых количествах.[24]
В сердце, толстой кишке и пищеводе хронические заболевания также приводят к массивным потеря нервных окончаний.[17] В области сердца это может способствовать возникновению аритмий и других сердечных нарушений.[17] В толстой кишке и пищеводе потеря контроля над нервной системой является основной причиной дисфункции органов.[17] Потеря нервов нарушает движение пищи по пищеварительному тракту, что может привести к закупорке пищевода или толстой кишки и ограничению их кровоснабжения.[17]
Диагностика

Наличие T. cruzi является диагностическим признаком болезни Шагаса. В острой фазе инфекции его можно обнаружить по микроскопический экспертиза свежих антикоагулированный кровь, или ее охристая шерсть, для подвижных паразитов; или приготовлением тонких и толстых мазки крови запятнанный Гимза, для прямой визуализации паразитов.[5][7] При исследовании мазка крови паразиты выявляются в 34–85% случаев. Такие методы, как центрифугирование микрогематокрита можно использовать для концентрирования крови, что делает тест более чувствительный.[2] При микроскопическом исследовании T. cruzi трипомастиготы имеют тонкое тело, часто в форме буквы S или U, с жгутик связаны с телом волнообразной мембраной.[25]
В качестве альтернативы, T. cruzi ДНК можно обнаружить полимеразной цепной реакции (ПЦР). При острой и врожденной болезни Шагаса ПЦР более чувствительна, чем микроскопия,[23] и он более надежен, чем тесты на основе антител для диагностики врожденных заболеваний, поскольку на него не влияет передача антител против T. cruzi от матери к ребенку (пассивный иммунитет ).[26] ПЦР также используется для мониторинга T. cruzi уровни у реципиентов трансплантата и людей с ослабленным иммунитетом, что позволяет выявить инфекцию или реактивацию на ранней стадии.[2][5][23]
Во время хронической фазы микроскопическая диагностика ненадежна, а ПЦР менее чувствительна из-за низкого уровня паразитов в крови.[2] Хроническая болезнь Шагаса обычно диагностируется с помощью серологический тесты, обнаруживающие иммуноглобулин G антитела против T. cruzi в крови человека.[7] Наиболее распространенные методики тестирования: ELISA, косвенный иммунофлуоресценция и косвенные гемагглютинация.[27] Для подтверждения диагноза необходимы два положительных результата серологии с использованием разных методов тестирования.[5] Если результаты теста неубедительны, дополнительные методы тестирования, такие как Вестерн-блоттинг может быть использован.[2] T. cruzi антигены также могут быть обнаружены в образцах тканей с использованием иммуногистохимия техники.[7]
Разные экспресс-тесты для болезни Шагаса имеются. Эти тесты легко переносятся и могут выполняться людьми без специальной подготовки.[28] Они полезны для скрининг большое количество людей и людей, проходящих тестирование, которые не могут получить доступ к медицинским учреждениям, но их чувствительность относительно низкая,[2] и рекомендуется использовать второй метод для подтверждения положительного результата.[28][29]
T. cruzi могут быть изолированы от образцов через посев крови или же ксенодиагностика, или путем заражения животных кровью человека. В методе посева крови человека красные кровяные тельца отделены от плазма и добавлен в специализированный среда роста для поощрения размножения паразита. На получение результата может уйти до полугода. Ксенодиагностика включает скармливание крови человека насекомым-триатомам с последующим исследованием их фекалий на наличие паразитов через 30-60 дней.[28] Эти методы обычно не используются, поскольку они медленные и имеют низкую чувствительность.[27][28]
Профилактика

Усилия по профилактике болезни Шагаса в основном сосредоточены на векторное управление чтобы ограничить воздействие триатомовых ошибок. Программы опрыскивания инсектицидами были основой борьбы с переносчиками инфекции, заключающейся в опрыскивании домов и прилегающих территорий остаточными инсектицидами.[30] Первоначально это было сделано с помощью хлорорганические соединения, органофосфат, и карбамат инсектициды, которые были вытеснены в 1980-х годах пиретроиды.[30] Эти программы резко сократили передачу в Бразилии и Чили,[15] и устранены основные переносчики из определенных регионов: Triatoma infestans из Бразилии, Чили, Уругвая и некоторых частей Перу и Парагвая, а также Родниус проликсус из Центральной Америки.[17] Борьбе с переносчиками в некоторых регионах препятствует развитие устойчивость к инсектицидам среди триатомовых клопов.[30] В ответ программы борьбы с переносчиками инфекции внедрили альтернативные инсектициды (например, фенитротион и бендиокарб в Аргентине и Боливии), обработка домашних животных (которые также питаются клопами-триатомами) пестицидами, красками, пропитанными пестицидами, и другими экспериментальными подходами.[30] В районах с триатомными клопами передача T. cruzi можно предотвратить, если спать под надкроватные сетки и путем улучшения жилищных условий, которые не позволяют клопам-триатомам заселять дома.[15]
Переливание крови ранее был вторым по распространенности способом передачи болезни Шагаса.[31] T. cruzi может выжить в охлажденной хранимой крови и может пережить замораживание и оттаивание, позволяя ему сохраняться в цельной крови, упакованные эритроциты, гранулоциты, криопреципитат, и тромбоциты.[31] Разработка и внедрение банк крови скрининговые тесты резко снизили риск заражения при переливании крови.[31] Почти все сдача крови в странах Латинской Америки проходят скрининг Шагаса.[31] Широко распространенный скрининг также распространен в неэндемичных странах со значительной популяцией иммигрантов из эндемичных районов, включая Соединенное Королевство (введено в 1999 г.), Испанию (2005 г.), США (2007 г.), Францию и Швецию (2009 г.), Швейцарию (2012 г.). ) и Бельгия (2013).[32] Кровь проверяется с помощью серологические тесты обычно ELISA, обнаружить антитела против T. cruzi белки.[31]
Другие способы передачи также стали объектом программ профилактики болезни Шагаса. Лечение T. cruzi-инфицированные матери во время беременности снижают риск врожденный передача инфекции.[22] С этой целью многие страны Латинской Америки ввели регулярный скрининг беременных женщин и младенцев на T. cruzi инфекции, и Всемирная организация здравоохранения рекомендует проводить скрининг всех детей, рожденных от инфицированных матерей, чтобы предотвратить перерастание врожденной инфекции в хроническое заболевание.[1][33] Так же, как и при переливании крови, многие страны с эндемической болезнью Шагаса проверяют органы на предмет трансплантации с помощью серологических тестов.[2]
Вакцины против болезни Шагаса не существует.[1] Несколько экспериментальных вакцин были протестированы на животных, инфицированных T. cruzi и смогли уменьшить количество паразитов в крови и сердце,[34] но ни одна вакцина-кандидат не прошла клинические испытания у людей по состоянию на 2016 год.[35]
Управление
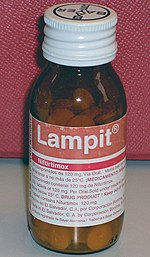
Болезнь Шагаса лечится с помощью противопаразитарные препараты устранить T. cruzi из организма и симптоматическое лечение для устранения последствий инфекции.[7] По состоянию на 2018 год бензнидазол и нифуртимокс были противопаразитарными препаратами выбора для лечения болезни Шагаса,[2] хотя бензнидазол - единственный препарат, доступный в большинстве стран Латинской Америки.[36] Для любого препарата лечение обычно состоит из двух-трех пероральных доз в день в течение 60-90 дней.[2] Противопаразитарное лечение наиболее эффективно на ранней стадии инфекции: оно устраняет T. cruzi от 50–80% людей в острой фазе и только у 20–60% людей в хронической фазе.[7] Лечение хронических заболеваний у детей более эффективно, чем у взрослых, а показатель излечения от врожденных заболеваний приближается к 100%, если лечить их в первый год жизни.[2] Противопаразитарное лечение также может замедлить прогрессирование заболевания и снизить вероятность врожденной передачи.[1] Устранение T. cruzi не лечит сердечные и желудочно-кишечные повреждения, вызванные хронической болезнью Шагаса, поэтому эти состояния необходимо лечить отдельно.[7] Противопаразитарное лечение не рекомендуется людям, у которых уже развилась дилатационная кардиомиопатия.[17]
Бензнидазол обычно считается лечение первой линии потому что он мягче побочные эффекты чем нифуртимокс, и его эффективность изучена лучше.[2][23] И бензнидазол, и нифуртимокс имеют общие побочные эффекты, которые могут привести к прекращению лечения. Наиболее частыми побочными эффектами бензнидазола являются кожная сыпь, проблемы с пищеварением, снижение аппетита, слабость, головная боль и проблемы со сном. Эти побочные эффекты иногда можно лечить с помощью антигистаминные препараты или же кортикостероиды, и обычно меняются, когда лечение прекращается.[2] Однако прием бензидазола прекращается почти в 29% случаев.[2] Нифуртимокс имеет более частые побочные эффекты, от которых страдают до 97,5% лиц, принимающих препарат.[2] Наиболее частыми побочными эффектами являются потеря аппетита, потеря веса, тошнота и рвота, а также различные неврологические расстройства включая изменения настроения, бессонницу, парестезия и периферическая невропатия.[2] В 75% случаев лечение прекращают.[2][23] Оба препарата противопоказаны к применению беременным женщинам и людям с печень или же почечная недостаточность.[1] По состоянию на 2019 год сообщалось о резистентности к этим препаратам.[36]
Осложнения
В хронической стадии лечение предполагает устранение клинических проявлений болезни. Лечение кардиомиопатии Шагаса аналогично лечению других форм сердечных заболеваний.[2] Бета-блокаторы и Ингибиторы АПФ могут быть назначены, но некоторые люди с болезнью Шагаса могут быть не в состоянии принимать стандартную дозу этих препаратов, потому что у них низкое кровяное давление или низкая частота пульса.[2][17] Чтобы контролировать нерегулярное сердцебиение, людям могут назначать антиаритмические препараты Такие как амиодарон, или иметь кардиостимулятор имплантирован.[5] Разжижители крови может использоваться для предотвращения тромбоэмболии и инсульта.[17] Хроническая болезнь сердца, вызванная Шагасом, является частой причиной трансплантация сердца хирургия.[15] Поскольку реципиенты трансплантата принимают иммунодепрессанты предотвращать отторжение органа, они контролируются с помощью ПЦР для выявления реактивации болезни. Люди с болезнью Шагаса, перенесшие трансплантацию сердца, имеют более высокие показатели выживаемости, чем средний реципиент трансплантата сердца.[17]
Легкие желудочно-кишечные заболевания можно лечить симптоматически, например, с помощью слабительные от запора или принимая прокинетический наркотик как метоклопрамид перед едой, чтобы облегчить симптомы со стороны пищевода.[5][37] Операция по рассечению мышц нижнего сфинктера пищевода (кардиомиотомия ) показан в более тяжелых случаях заболевания пищевода,[37] и хирургическое удаление пораженной части органа может потребоваться для расширенного мегаколона и мегаэзофагуса.[5][27]
Эпидемиология


По оценкам, в 2017 году около 6,2 миллиона человек во всем мире болели болезнью Шагаса, примерно 162 000 новых случаев инфицирования и 7900 смертей ежегодно.[3][4] Это привело к ежегодному глобальному экономическому бремени, которое оценивается в 7,2 миллиарда долларов США, 86% которого ложится на эндемичные страны.[32][40] Болезнь Шагаса привела к гибели более 800000 человек. годы жизни с поправкой на инвалидность каждый год.[2]
Шагас является эндемиком 21 страны континентальной Латинской Америки: Аргентины, Белиза, Боливии, Бразилии, Чили, Колумбии, Коста-Рики, Эквадора, Сальвадора, Французской Гвианы, Гватемалы, Гайаны, Гондураса, Мексики, Никарагуа, Панамы, Парагвая, Перу, Суринам, Уругвай и Венесуэла.[1][2] Эндемичный ареал колеблется от юга Соединенных Штатов до севера Чили и Аргентины, причем Боливия (6,1%), Аргентина (3,6%) и Парагвай (2,1%) демонстрируют самую высокую распространенность болезни.[2] В эндемичных районах, в основном благодаря усилиям по борьбе с переносчиками болезней и скринингу донорской крови, ежегодные случаи инфицирования и смертности снизились на 67% и более чем 73% соответственно по сравнению с пиковыми значениями в 1980–2010 годах.[2][41] Передача через насекомых-переносчиков и переливание крови полностью прекращены в Уругвае (1997 г.), Чили (1999 г.) и Бразилии (2006 г.).[41] а в Аргентине передача инфекции была остановлена в 13 из 19 эндемичных провинций.[42] Во время венесуэльского гуманитарный кризис, векторная передача началась в районах, где она ранее была прервана, и болезнь Шагаса серологическая распространенность ставки увеличились.[43] Скорость передачи также выросла в Гран Чако области из-за устойчивости к инсектицидам и в Бассейн Амазонки из-за устной передачи.[2]
В то время как частота передачи болезни Шагаса, передаваемой переносчиками, снизилась на большей части территории Латинской Америки, частота заболеваний, передаваемых через рот, выросла, возможно, из-за растущей урбанизации и обезлесения, в результате чего люди стали ближе контактировать с триатомами и изменили распространение видов триатомов.[21][44][45] Болезнь Шагаса, передаваемая через рот, вызывает особую озабоченность в Венесуэле, где в период с 2007 по 2018 год было зарегистрировано 16 вспышек.[43]
Шагас существует в двух разных экологических зонах: Южный конус регионе, главный переносчик обитает в жилых домах и вокруг них. В Центральной Америке и Мексике основные виды переносчиков обитают как внутри жилищ, так и в ненаселенных районах. В обеих зонах Шагас встречается почти исключительно в сельской местности, где T. cruzi также циркулирует у диких и домашних животных.[46] T. cruzi обычно поражает более 100 видов млекопитающих в Латинской Америке, включая опоссумы, броненосцы, мартышки, летучие мыши, и различные грызуны, все из которых могут быть инфицированы переносчиками или перорально при употреблении в пищу клопов триатомина и других инфицированных животных.[47]
Неэндемичные страны
Хотя болезнь Шагаса традиционно считается заболеванием сельских жителей Латинской Америки, международная миграция разбросала людей, страдающих этим заболеванием, во многие неэндемичные страны, в первую очередь в Северной Америке и Европе.[1][32] По состоянию на 2020 год в США проживает около 300000 инфицированных.[48] от 30 000 до 40 000 из них страдают кардиомиопатией Шагаса.[17] Подавляющее большинство инфекций Шагаса в Соединенных Штатах возникает у иммигрантов из Латинской Америки,[17][23] но возможна местная передача. Одиннадцать видов триатомов являются местными для Соединенных Штатов, и в некоторых южных штатах наблюдаются устойчивые циклы передачи болезней между насекомыми-переносчиками и животными-резервуарами.[2][23] К ним относятся вудры, опоссумы, еноты, броненосцы и скунсы.[49] Однако местная инфекция встречается очень редко: с 1955 по 2015 год было зарегистрировано всего 28 случаев.[2][48] По состоянию на 2013 год стоимость лечения в США оценивалась в 900 миллионов долларов США в год (глобальная стоимость - 7 миллиардов долларов США), включая госпитализацию и медицинские устройства, такие как кардиостимуляторы.[40]
Болезнь Шагаса поражает примерно от 68000 до 123000 человек в Европе по состоянию на 2019 год.[50] Испания, где высок уровень иммиграции из Латинской Америки, имеет самый высокий уровень распространенности этого заболевания. По оценкам, от 50 000 до 70 000 испанцев живут с этим заболеванием, что составляет 75% случаев заболевания в Европе.[51] Распространенность Шагаса широко варьируется в европейских странах из-за различных моделей иммиграции.[50] Италия занимает второе место по распространенности, за ней следуют Нидерланды, Великобритания и Германия.[51]
История

T. cruzi вероятно, распространился среди южноамериканских млекопитающих задолго до прибытия людей на континент.[52] T. cruzi был обнаружен в древних человеческих останках по всей Южной Америке, начиная с 9000-летнего возраста. Чинчорро мумия в Пустыня Атакама, останкам разного возраста в Минас-Жерайс, 1100-летней мумии на севере до Пустыня Чиуауа недалеко от Рио-Гранде.[52] Многие ранние письменные источники описывают симптомы, соответствующие болезни Шагаса, причем ранние описания болезни иногда приписываются Мигель Диас Пимента (1707), Луис Гомеш Феррейра (1735), и Теодоро Дж. Х. Ланггаард (1842).[52]
Формальное описание болезни Шагаса было сделано Карлос Шагас в 1909 г. после обследования двухлетней девочки с лихорадкой, увеличенными лимфатическими узлами, увеличенными селезенкой и печенью.[52] Изучив ее кровь, Шагас увидел трипаносомы, идентичные тем, которые он недавно идентифицировал из задняя кишка триатомных ошибок и названных Trypanosoma cruzi в честь своего наставника, бразильского врача Освальдо Крус.[52] Он отправил зараженных триатомовых жуков Крузу в Рио де Жанейро, который показал, что укус зараженного триатомина может передавать T. cruzi к мартышки обезьяны также.[52] Всего за два года, 1908 и 1909, Шагас опубликовал описания болезни, организма, который ее вызвал, и насекомых-переносчиков инфекции, необходимых для заражения.[53][54][55] Практически сразу после этого, по предложению Мигель Коуту, затем профессор Faculdade de Medicina do Рио-де-Жанейроболезнь получила широкое название «болезнь Шагаса».[53] Открытие Шагаса принесло ему национальную и международную известность, но, подчеркнув неадекватность реакции бразильского правительства на болезнь, Шагас привлек критику к себе и к болезни, носящей его имя, подавляя исследования по его открытию и, вероятно, расстраивая его номинацию на премию. Нобелевская премия 1921 года.[53][56]
В 1930-е гг. Сальвадор Мацца возродили исследования болезни Шагаса, описав более тысячи случаев в Аргентине. Провинция Чако.[52] В Аргентине болезнь известна как Mal de Chagas-Mazza в его честь.[57] Серологические тесты на болезнь Шагаса были введены в 1940-х годах, продемонстрировав, что заражение T. cruzi был широко распространен в Латинской Америке.[52] Это, в сочетании с успехами в ликвидации переносчиков малярии с помощью инсектицидов, стимулировало создание кампаний общественного здравоохранения, направленных на обработку домов инсектицидами для искоренения триатомовых клопов.[30][52] В 1950-х годах было обнаружено, что лечение крови кристально-фиолетовый может искоренить паразита, что привело к его широкому использованию в программах скрининга переливания крови в Латинской Америке.[52] Крупномасштабные программы контроля начали формироваться в 1960-х годах, сначала в Сан-Паулу, затем в различных местах в Аргентине, затем в программах национального уровня по всей Латинской Америке.[58] Эти программы получили значительный импульс в 1980-х годах с появлением инсектицидов из пиретроидов, которые не оставляли пятен или запаха после применения, были более длительными и более экономичными.[52][58] Региональные органы, занимающиеся борьбой с болезнью Шагаса, возникли благодаря поддержке Панамериканская организация здравоохранения, с Инициативой Южного конуса по ликвидации болезни Шагаса, запущенной в 1991 г., за которой последовали Инициатива стран Андского региона (1997 г.), Инициатива стран Центральной Америки (1997 г.) и Инициатива стран Амазонки (2004 г.) .[30]
Исследование
Лечение
Фексинидазол антипаразитарный препарат, одобренный для лечения африканского трипаносомоза, показал активность против болезни Шагаса на животных моделях. По состоянию на 2019 год он проходит фаза II клинических испытаний при хронической болезни Шагаса в Испании.[36][59] Другие кандидаты в препараты включают: GNF6702, а ингибитор протеасомы который эффективен против болезни Шагаса у мышей и проходит предварительные исследования токсичности, и AN4169, который дал многообещающие результаты на моделях животных.[11][60]
Ряд экспериментальных вакцин был протестирован на животных. В некоторых подходах использовалась инокуляция мертвыми или ослабленный T. cruzi паразиты или непатогенные организмы, которые имеют общие антигены с T. cruzi, Такие как Трипаносома рангели или же Phytomonas serpens. ДНК-вакцинация также был исследован. По состоянию на 2019 год исследования вакцин в основном ограничивались моделями мелких животных, и необходимы дальнейшие испытания на крупных животных.[10]
Диагностические тесты
По состоянию на 2018 год стандартные диагностические тесты на болезнь Шагаса были ограничены в их способности измерять реакцию на противопаразитарное лечение. Например, серологические тесты могут оставаться положительными в течение многих лет после T. cruzi выводится из организма, и ПЦР может дать ложноотрицательные результаты при паразитемия низкий. Различный потенциал биомаркеры реакции на лечение изучаются, например иммуноанализ против конкретных T. cruzi антигены, проточной цитометрии тестирование для выявления антител против разных стадий жизни T. cruzi, и маркеры физиологических изменений, вызванных паразитом, таких как изменения в коагуляция и липидный обмен.[17]
Еще одна область исследований - использование биомаркеров для прогнозирования прогрессирования хронической болезни Шагаса. Уровни в крови фактор некроза опухоли альфа, мозг и предсердный натрийуретический пептид, и ангиотензинпревращающий фермент 2, маркеры повреждения сердца и воспаления, коррелируют с тяжестью кардиомиопатии Шагаса. Эндотелин-1 был изучен как прогностический маркер на животных моделях.[61]
T. cruzi выделять острофазовый антиген (SAPA), который можно обнаружить в крови с помощью ELISA или вестерн-блоттинга,[22] использовался как индикатор ранней острой и врожденной инфекции.[61] Новый тест для T. cruzi антигены в моче были разработаны для диагностики врожденных заболеваний.[22]
Смотрите также
- Инициатива по лекарствам от забытых болезней
- Шагас: Кампания пора лечить
- Ассоциация содействия независимому контролю заболеваний в развивающихся странах
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у «Болезнь Шагаса (американский трипаносомоз)». Всемирная организация здоровья. 17 апреля 2019 г. Архивировано с оригинал 20 января 2020 г.. Получено 9 марта 2020.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь ан ао ap водный ар в качестве в au средний ау топор ай az ба bb до н.э bd Перес-Молина JA, Молина I (2018). «Болезнь Шагаса». Ланцет. 391 (10115): 82–94. Дои:10.1016 / S0140-6736 (17) 31612-4. ISSN 0140-6736. PMID 28673423. S2CID 4514617.
- ^ а б c Соавторы исследования ГББ, 2017 г., по заболеваемости и распространенности заболеваний и травм (ноябрь 2018 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и годы, прожитые с инвалидностью для 354 заболеваний и травм в 195 странах и территориях, 1990–2017 гг .: систематический анализ для исследования глобального бремени болезней, 2017 г.». Ланцет. 392 (10159): 1789–1858. Дои:10.1016 / S0140-6736 (18) 32279-7. ЧВК 6227754. PMID 30496104.
- ^ а б c GBD 2017 Причины смерти соавторов (ноябрь 2018 г.). «Глобальная, региональная и национальная возрастная и национальная смертность от 282 причин смерти в 195 странах и территориях, 1980–2017 годы: систематический анализ для исследования глобального бремени болезней, 2017 год». Ланцет. 392 (10159): 1736–88. Дои:10.1016 / S0140-6736 (18) 32203-7. ЧВК 6227606. PMID 30496103.
- ^ а б c d е ж грамм час я j k л м п о п Берн С. (июль 2015 г.). «Болезнь Шагаса». N. Engl. J. Med. (Рассмотрение). 373 (5): 456–66. Дои:10.1056 / NEJMra1410150. PMID 26222561.
- ^ а б c «DPDx - трипаносомоз, американский. Информационный бюллетень». Центры по контролю за заболеваниями (CDC). 30 апреля 2019. В архиве из оригинала 5 сентября 2019 г.. Получено 10 марта 2020.
- ^ а б c d е ж грамм час я Guarner J (май 2019 г.). «Болезнь Шагаса как пример возрождающегося паразита». Семинары по диагностической патологии. 36 (3): 164–9. Дои:10.1053 / j.semdp.2019.04.008. PMID 31006555.
- ^ Расси А., Расси А., Марин-Нето Дж. А. (апрель 2010 г.). «Болезнь Шагаса». Ланцет. 375 (9723): 1388–402. Дои:10.1016 / S0140-6736 (10) 60061-X. PMID 20399979. S2CID 5068417.
- ^ «Профилактика болезни Шагаса». Всемирная организация здоровья. В архиве из оригинала 11 февраля 2018 г.. Получено 24 февраля 2018.
- ^ а б Риос Л.Е., Васкес-Чагоян Дж.С., Пачеко А.О., депутат Заго, Гарг, Нью-Джерси (2019). «Усилия по разработке иммунитета и вакцины против Trypanosoma cruzi». Acta Tropica. 200: 105168. Дои:10.1016 / j.actatropica.2019.105168. ISSN 0001-706X. ЧВК 7409534. PMID 31513763.
- ^ а б Vermelho AB, Rodrigues GC, Supuran CT (2019). «Почему не было большего прогресса в открытии новых лекарств от болезни Шагаса?». Мнение эксперта об открытии лекарств. 15 (2): 145–158. Дои:10.1080/17460441.2020.1681394. ISSN 1746-0441. PMID 31670987. S2CID 207815975.
- ^ Расси-младший А., Расси А., Маркондес де Резенде Дж. (Июнь 2012 г.). «Американский трипаносомоз (болезнь Шагаса)». Клиники инфекционных болезней Северной Америки. 26 (2): 275–91. Дои:10.1016 / j.idc.2012.03.002. PMID 22632639.
- ^ Capinera JL, изд. (2008). Энциклопедия энтомологии (2-е изд.). Дордрехт: Спрингер. п.824. ISBN 9781402062421.
- ^ «Забытые тропические болезни». cdc.gov. 6 июня 2011 г. В архиве из оригинала 4 декабря 2014 г.. Получено 28 ноября 2014.
- ^ а б c d е ж грамм час я j k Деспомье Д.Д., Гриффин Д.О., Гвадз Р.В., Хотез П.Дж., Книрш, Калифорния (2019). «Американский трипаносомоз». Паразитарные болезни (7-е изд.). Нью-Йорк: Паразиты без границ. стр. 71–84. Получено 26 марта 2020.
- ^ "Болезнь Шагаса - Подробный информационный бюллетень". www.cdc.gov. CDC-Центры по контролю и профилактике заболеваний. В архиве с оригинала 16 августа 2019 г.. Получено 15 апреля 2020.
- ^ а б c d е ж грамм час я j k л м п о п q Нуньес М.С., Битон А, Аквателла Х и др. (Сентябрь 2018 г.). «Кардиомиопатия Шагаса: обновление современных клинических знаний и методов лечения: научное заявление Американской кардиологической ассоциации». Тираж (Рассмотрение). 138 (12): e169 – e209. Дои:10.1161 / CIR.0000000000000599. PMID 30354432.
- ^ Echeverria LE, Morillo CA (февраль 2019 г.). «Американский трипаносомоз (болезнь Шагаса)». Клиники инфекционных болезней Северной Америки. 33 (1): 119–134. Дои:10.1016 / j.idc.2018.10.015. PMID 30712757.
- ^ а б c Альба Сото CD, Гонсалес Каппа С.М. (9 сентября 2019 г.). "Trypanosoma cruzi Путешествие от насекомых-переносчиков к клетке-хозяину ". В Marcelo Altcheh J, Freilij H (eds.). Болезнь Шагаса: клинический подход. Достижения Биркхойзера в области инфекционных болезней. Швейцария: Springer Nature. С. 25–59. Дои:10.1007/978-3-030-00054-7_2. ISBN 978-3-030-00054-7. ISSN 2504-3811.
- ^ Модлин И., Холмс PH, Майлз М.А., ред. (2004). Трипаносомозы. Уоллингфорд: CAB International. п.184. ISBN 9780851990347.
- ^ а б c d Робертсон Л.Дж., Девесшаувер Б., де Нойя Б.А., Гозалес О.Н., Тогерсон ПР (июнь 2016 г.). "Trypanosoma cruzi: время для международного признания в качестве паразита пищевого происхождения". PLOS забытые тропические болезни. 10 (6): e0004656. Дои:10.1371 / journal.pntd.0004656. ЧВК 4890754. PMID 27253136.
- ^ а б c d Посланник Лос-Анджелес, Берн С. (2018). «Врожденная болезнь Шагаса: современная диагностика, ограничения и перспективы на будущее» (PDF). Современное мнение об инфекционных заболеваниях. 31 (5): 415–21. Дои:10.1097 / QCO.0000000000000478. PMID 30095485. S2CID 51955023.
- ^ а б c d е ж грамм Берн К., Посланник Лос-Анджелеса, Уитмен Дж. Д., Магуайр Дж. Х. (2019). «Болезнь Шагаса в США: подход общественного здравоохранения». Обзоры клинической микробиологии (Рассмотрение). 33 (1). Дои:10.1128 / CMR.00023-19. ISSN 0893-8512. ЧВК 6927308. PMID 31776135.
- ^ а б c d Бонни К.М., Luthringer DJ, Kim SA, Garg NJ, Engman DM (январь 2019). «Патология и патогенез болезни сердца Шагаса». Анну Рев Патол (Рассмотрение). 14: 421–47. Дои:10.1146 / annurev-pathol-020117-043711. ЧВК 7373119. PMID 30355152.
- ^ Bain BJ (20 января 2015 г.). Клетки крови: практическое руководство. Джон Вили и сыновья. С. 165–7. ISBN 978-1-118-81733-9.
- ^ Schijman AG (август 2018 г.). «Молекулярная диагностика Trypanosoma cruzi». Acta Tropica. 184: 59–66. Дои:10.1016 / j.actatropica.2018.02.019. HDL:11336/79861. PMID 29476727.
- ^ а б c Кирхгоф О.В. (26 апреля 2019 г.). «Болезнь Шагаса (американский трипаносомоз)». eMedicine. В архиве из оригинала 12 марта 2020 г.. Получено 8 апреля 2020.
- ^ а б c d Luquetti AO, Schijman AG (9 сентября 2019 г.). «Диагностика болезни Шагаса». В Marcelo Altcheh J, Freilij H (ред.). Болезнь Шагаса: клинический подход. Достижения Биркхойзера в области инфекционных болезней. Швейцария: Springer Nature. С. 141–58. Дои:10.1007/978-3-030-00054-7_7. ISBN 978-3-030-00054-7. ISSN 2504-3811.
- ^ Angheben A, Buonfrate D, Cruciani M и др. (Май 2019). «Экспресс-иммунохроматографические тесты для диагностики хронической болезни Шагаса в группах риска: систематический обзор и метаанализ». PLOS забытые тропические болезни. 13 (5): e0007271. Дои:10.1371 / journal.pntd.0007271. ЧВК 6561601. PMID 31150377.
- ^ а б c d е ж Mougabure-Cueto G, Picollo MI (сентябрь 2015 г.). «Устойчивость к инсектицидам в переносчиках болезни Шагаса: эволюция, механизмы и управление». Acta Tropica. 149: 70–85. Дои:10.1016 / j.actatropica.2015.05.014. PMID 26003952.
- ^ а б c d е Angheben A, Boix L, Buonfrate D и др. (Октябрь 2015 г.). «Болезнь Шагаса и трансфузионная медицина: взгляд из неэндемичных стран». Переливание крови. 13 (4): 540–50. Дои:10.2450/2015.0040-15. ЧВК 4624528. PMID 26513769.
- ^ а б c Лидани KCF, Андраде Ф.А., Бавиа Л. и др. (Июль 2019). «Болезнь Шагаса: от открытия до мировой проблемы здравоохранения». Границы общественного здравоохранения. 7: 166. Дои:10.3389 / fpubh.2019.00166. ЧВК 6614205. PMID 31312626.
- ^ Бонни К.М. (март 2014 г.). «Болезнь Шагаса в 21 веке: успех общественного здравоохранения или возникающая угроза». Паразит. 21 (11): 11. Дои:10.1051 / паразит / 2014012. ЧВК 3952655. PMID 24626257.
- ^ Dumonteil E, Herrera C, Buekens P (январь 2019 г.). «Терапевтическая вакцина против болезни Шагаса до зачатия: новое показание, которое может снизить врожденную передачу и ускорить разработку вакцины». PLOS Negelated тропические болезни. 13 (1): e0006985. Дои:10.1371 / journal.pntd.0006985. ЧВК 6354953. PMID 30703092.
- ^ Бомье CM, Гиллеспи PM, Стрих У. и др. (Июнь 2016). «Статус исследования вакцины и разработки вакцин против болезни Шагаса». Вакцина. 34 (26): 2996–3000. Дои:10.1016 / j.vaccine.2016.03.074. PMID 27026146.
- ^ а б c Рибейро В., Диас Н., Пайва Т. и др. (Декабрь 2019 г.). «Современные тенденции в фармакологическом лечении болезни Шагаса». Int J Parasitol Drugs Drug Resist (Рассмотрение). 12: 7–17. Дои:10.1016 / j.ijpddr.2019.11.004. ЧВК 6928327. PMID 31862616.
- ^ а б де Оливейра Э.С., да Силвейра А.Б.М., Лукетти АО (9 сентября 2019 г.). «Желудочно-кишечная болезнь Шагаса». В Marcelo Altcheh J, Freilij H (ред.). Болезнь Шагаса: клинический подход. Достижения Биркхойзера в области инфекционных болезней. Швейцария: Springer Nature. С. 243–62. Дои:10.1007/978-3-030-00054-7_12. ISBN 978-3-030-00054-7. ISSN 2504-3811.
- ^ Лю Цюй, Чжоу XN (декабрь 2015 г.). «Предотвращение передачи американского трипаносомоза и его распространения в неэндемичных странах». Инфекционные болезни бедности. 4: 60. Дои:10.1186 / s40249-015-0092-7. ЧВК 4693433. PMID 26715535.
- ^ Всемирная организация здоровья. «Оценка бремени болезней и смертности». Архивировано из оригинал 10 февраля 2020 г.. Получено 27 апреля 2020.
- ^ а б Ли Б., Бэкон К.М., Боттацци М.Э., Хотез П.Дж. (апрель 2013 г.). «Глобальное экономическое бремя болезни Шагаса: компьютерная имитационная модель». Ланцетные инфекционные болезни. 13 (4): 342–8. Дои:10.1016 / S1473-3099 (13) 70002-1. ЧВК 3763184. PMID 23395248.
- ^ а б Монкайо А, Сильверия AC (2017). «Текущие эпидемиологические тенденции болезни Шагаса в Латинской Америке и будущие проблемы: эпидемиология, эпиднадзор и политика в области здравоохранения». Американский трипаносомоз - болезнь Шагаса (2-е изд.). Эльзевир. С. 59–88. Дои:10.1016 / B978-0-12-801029-7.00004-6.
- ^ «Инициатива Южного конуса: обновленная информация». Специальная программа исследований и обучения тропических болезней (TDR) (Пресс-релиз). ВОЗ. 2004. Архивировано с оригинал 22 сентября 2009 г.. Получено 29 августа 2008.
- ^ а б Grillet ME, Hernández-Villena JV, Llewellyn MS, et al. (Май 2019). «Гуманитарный кризис Венесуэлы, возрождение трансмиссивных болезней и последствия для распространения в регионе» (PDF). Ланцет Инфекция Дис (Рассмотрение). 19 (5): e149 – e161. Дои:10.1016 / S1473-3099 (18) 30757-6. PMID 30799251.
- ^ Аларкон де Нойя Б., Нойя Гонсалес О. (9 сентября 2019 г.). «Перорально передающаяся болезнь Шагаса: биология, эпидемиология и клинические аспекты инфекции пищевого происхождения». В Marcelo Altcheh J, Freilij H (ред.). Болезнь Шагаса: клинический подход. Достижения Биркхойзера в области инфекционных болезней. Швейцария: Springer Nature. стр.225–241. Дои:10.1007/978-3-030-00054-7_11. ISBN 978-3-030-00054-7. ISSN 2504-3811.
- ^ Hotez PJ, Basáñez MG, Acosta-Serrano A, Grillet ME (2017). "Венесуэла и ее рост числа запущенных трансмиссивных болезней". PLOS забытые тропические болезни. 11 (6): e0005423. Дои:10.1371 / journal.pntd.0005423. ISSN 1935-2735. ЧВК 5490936. PMID 28662038.
- ^ Морель С.М., Лаздинс Дж. (Октябрь 2003 г.). «Болезнь Шагаса». Нат Рев Микробиол. 1 (1): 14–5. Дои:10.1038 / nrmicro735. PMID 15040175. S2CID 29869370.
- ^ Янсен AM, Роке ALR (2010). «11 - Водоемы домашних и диких млекопитающих». В Telleria J, Tibayrenc M (ред.). Американский трипаносомоз. Эльзевир. С. 249–276. Дои:10.1016 / B978-0-12-384876-5.00011-3. ISBN 978-0-123-84876-5.
- ^ а б Турабелидзе Г., Васудеван А., Рохас-Морено С. и др. (2020). «Автохтонная болезнь Шагаса - Миссури, 2018 г.». MMWR. Еженедельный отчет о заболеваемости и смертности. 69 (7): 193–195. Дои:10,15585 / ммwr.mm6907a4. ISSN 0149-2195. ЧВК 7043387. PMID 32078594.
- ^ Монтгомери С.П., Старр М.К., Кэнти П.Т., Эдвардс М.С., Мейманди СК (2014). «Забытые паразитарные инфекции в Соединенных Штатах: болезнь Шагаса». Am J Trop Med Hyg. 90 (5): 814–818. Дои:10.4269 / ajtmh.13-0726. ЧВК 4015570. PMID 24808250.
- ^ а б Алонсо-Падилья Дж., Пиназо М.Дж., Гаскон Дж. (9 сентября 2019 г.). «Болезнь Шагаса в Европе». В Marcelo Altcheh J, Freilij H (ред.). Болезнь Шагаса: клинический подход. Достижения Биркхойзера в области инфекционных болезней. Швейцария: Springer Nature. С. 111–123. Дои:10.1007/978-3-030-00054-7_5. ISBN 978-3-030-00054-7. ISSN 2504-3811.
- ^ а б Веласко М., Химено-Фелиу Л.А., Молина И. и др. (Февраль 2020 г.). «Скрининг на инфекцию Trypanosoma cruzi у иммигрантов и беженцев: систематический обзор и рекомендации Испанского общества инфекционных болезней и клинической микробиологии». Euro Surveill. (Рассмотрение). 25 (8). Дои:10.2807 / 1560-7917.ES.2020.25.8.1900393. ЧВК 7055039. PMID 32127121.
- ^ а б c d е ж грамм час я j k Стевердинг Д. (июль 2014 г.). «История болезни Шагаса». Паразиты и векторы. 7: 317. Дои:10.1186/1756-3305-7-317. ЧВК 4105117. PMID 25011546.
- ^ а б c Kropf SP, SA MR (июль 2009 г.). "Открытие Trypanosoma cruzi и болезнь Шагаса (1908–1909): тропическая медицина в Бразилии » (PDF). Hist Cienc Saude Manguinhos. 16 (Дополнение 1): 13–34. Дои:10.1590 / с0104-59702009000500002. PMID 20027916. S2CID 36106351.
- ^ Шагас С (1909). «Neue Trypanosomen». Vorläufige Mitteilung Arch Schiff Tropenhyg. 13: 120–2.
- ^ Шагас С (1909). "Nova tripanozomiase humana: Estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. Gen., N. Sp., Ajente etiolojico de nova entidade morbida do homem [Новый человеческий трипаносомоз. Исследования морфологии и жизненного цикла Schizotripanum cruzi, этиологический агент новой болезненной сущности человека] ". Mem Inst Oswaldo Cruz. 1 (2): 159–218. Дои:10.1590 / S0074-02761909000200008. ISSN 0074-0276. (на португальском языке с полным переводом на немецкий как «Ueber eine neue Trypanosomiasis des Menschen».)
- ^ Бестетти РБ, Мартинс CA, Кардиналли-Нето А (май 2009 г.). «Правосудие там, где справедливость: посмертная Нобелевская премия Карлосу Шагасу (1879–1934), первооткрывателю американского трипаносомоза (болезни Шагаса)». Международный журнал кардиологии. 134 (1): 9–16. Дои:10.1016 / j.ijcard.2008.12.197. PMID 19185367.
- ^ "Энфермедад де Шагас - Мацца" (на испанском). Asociación Lucha Contra el Mal de Chagas. Архивировано из оригинал 16 сентября 2011 г.. Получено 15 сентября 2011.
- ^ а б Dias JCP (сентябрь 2015 г.). «Эволюция программ скрининга на болезнь Шагаса и программ борьбы». Глобальное сердце. 10 (3): 193–202. Дои:10.1016 / j.gheart.2015.06.003. PMID 26407516.
- ^ Дикс Э.Д. (2019). «Фексинидазол: первое глобальное одобрение». Наркотики (Рассмотрение). 79 (2): 215–220. Дои:10.1007 / s40265-019-1051-6. ISSN 0012-6667. PMID 30635838. S2CID 57772417.
- ^ Кратц JM (2019). «Открытие лекарств от болезни Шагаса: точка зрения». Acta Tropica (Рассмотрение). 198: 105107. Дои:10.1016 / j.actatropica.2019.105107. ISSN 0001-706X. PMID 31351074.
- ^ а б Балуз V, Агуэро Ф, Бускалья, Калифорния (2017). «Приложения для диагностики болезни Шагаса: современные знания и будущие шаги». Adv. Паразитол. (Рассмотрение). 97: 1–45. Дои:10.1016 / bs.apar.2016.10.001. ЧВК 5363286. PMID 28325368.
внешняя ссылка
- Болезнь Шагаса в Керли
- Информация о Шагасе в США Центры по контролю за заболеваниями
- Информация о Шагасе от Инициатива «Лекарства от забытых болезней»
- Информация о болезни Шагаса для путешественников от Международной ассоциации медицинской помощи путешественникам
| Классификация | |
|---|---|
| Внешние ресурсы |
