Стереоселективность - Stereoselectivity
В химия, стереоселективность[1] является собственностью химическая реакция в котором сингл реагент образует неравную смесь стереоизомеры во время не-стереоспецифический создание нового стереоцентр или во время нестереоспецифической трансформации уже существующей.[2] Селективность возникает из-за различий в стерические эффекты и электронные эффекты в механистические пути приводя к различным продуктам. Степень стереоселективности может варьироваться, но она никогда не может быть полной, поскольку разница в энергии активации между двумя путями конечна. Оба продукта по крайней мере возможны и отличаются лишь количеством. Однако в благоприятных случаях минорный стереоизомер может быть не обнаружен используемыми аналитическими методами.
An энантиоселективный реакция та, в которой энантиомер образуется предпочтительнее, чем другой, в реакции, которая создает оптически активный продукт из ахирального исходного материала с использованием либо хирального катализатора, либо фермент или хиральный реагент. Степень селективности измеряется энантиомерный избыток. Важный вариант - кинетическое разрешение, в котором ранее существовавший хиральный центр вступает в реакцию с хиральным катализатором, ферментом или хиральным реагентом, так что один энантиомер реагирует быстрее, чем другой, и оставляет после себя менее реакционноспособный энантиомер, или в котором ранее существовавший хиральный центр влияет на реакционная способность реакционного центра в другом месте той же молекулы.
А диастереоселективный реакция та, в которой диастереомер образуется предпочтительнее другого (или в котором в смеси продуктов преобладает подмножество всех возможных диастереомеров), устанавливая предпочтительную относительную стереохимию. В этом случае одновременно образуются два или более хиральных центра, что благоприятствует одной относительной стереохимии,[3] или уже существующий хиральный центр (который не обязательно должен быть оптически чистым) искажает стереохимический результат во время создания другого. Степень относительной селективности измеряется диастереомерный избыток.
Стереоконвергенция можно рассматривать как противоположность стереоспецифичности, когда реакция двух разных стереоизомеров дает один стереоизомер продукта.
Качество стереоселективности связано исключительно с продуктами и их стереохимией. Из ряда возможных стереоизомерных продуктов реакция выбирает один или два, которые должны образоваться.
Примеры
Примером скромной стереоселективности является дегидрогалогенирование 2-йод-бутана с выходом 60% транс-2-бутен и 20% СНГ-2-бутен.[4] Поскольку алкен геометрические изомеры также классифицируются как диастереомеры, эту реакцию также можно было бы назвать диастереоселективной.
Добавление муравьиная кислота к норборнен также стереоспецифичен, потому что экзо-изомер образуется исключительно без каких-либо эндо-изомеров:[5]
Правило Крэма предсказывает основной диастереомер в результате диастереоселективного нуклеофильного присоединения к карбонильной группе рядом с хиральным центром. Хиральный центр не обязательно должен быть оптически чистым, поскольку относительная стереохимия будет одинаковой для обоих энантиомеров. В приведенном ниже примере (S) -альдегид реагирует с тиазолом с образованием (S, S) диастереомера, но только небольшого количества (S, R) диастереомера:[6]
В Эпоксидирование по методу Sharpless является примером энантиоселективного процесса, в котором ахиральный аллиловый спирт субстрат превращается в оптически активный эпоксидный спирт. В случае хиральных аллиловых спиртов происходит кинетическое разрешение. Другой пример Асимметричное дигидроксилирование по Шарплесу. В приведенном ниже примере ахиральный алкен дает только один из 4 возможных стереоизомеров.[7]
С стереогенный в центре рядом с карбокатионом, замена может быть стереоселективной в интер- [8] и внутримолекулярный [9][10] реакции. В реакции, изображенной ниже, нуклеофил (фуран) может приближаться к карбокатиону, образующемуся с наименее защищенной стороны от объемного трет-бутил группа, приводящая к высокой диастереоселективности лица:
Стереоселективный биосинтез
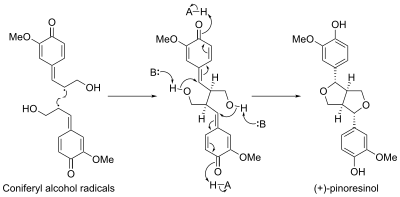
Пинорезинол в биосинтезе участвует белок, называемый дириджентный белок. Первый дириджентный белок был обнаружен в Форзиция промежуточная. Было обнаружено, что этот белок направляет стереоселективный биосинтез (+) -пинорезинол из конифериловый спирт мономеры.[11] Недавно был проведен второй энантиокомплементарный дириджентный белок был идентифицирован в Arabidopsis thaliana, который направляет энантиоселективный синтез (-) - пинорезинола.[12]
Смотрите также
Примечания и ссылки
- ^ (а) «Контроль перекрытия карбанионоидных реакций. I. Стереоселективность при щелочном эпоксидировании», Zimmerman, H.E .; Певица, Л .; Thyagarajan, B. S. J. Am. Chem. Soc., 1959, 81, 108-116. (b) Элиэль, Э., «Стереохимия соединения углерода», McGraw-Hill, 1962, стр. 434-436.
- ^ Например, SN1 реакция разрушает существующий стереоцентр, а затем создает новый.
- ^ Или получается меньше, чем все возможные относительные стереохимии.
- ^ Влияние силы и размера основания на реакции элиминирования, стимулированные основанием. Ричард А. Барч, Джеральд М. Прусс, Брюс А. Бушоу, Карл Э. Вигерс Варенье. Chem. Soc.; 1973; 95(10); 3405-3407. Дои:10.1021 / ja00791a067
- ^ Органический синтез Coll. Vol. 5, стр.852 (1973); Vol. 42, стр.79 (1962). Связь
- ^ Organic Syntheses, Coll. Vol. 10, с.140 (2004); Vol. 77, стр.78 (2000). Связь
- ^ Organic Syntheses, Coll. Vol. 10, стр. 603 (2004); Vol. 79, стр.93 (2002).Связь
- ^ Реакции диастереоселективной циклизации Фриделя-Крафтса 2-замещенных 1-фенил-1,2,3,4-тетрагидронафталинов Фридрих Мюльтау, Thorsten Bach Synthesis 2005: 3428-3436 Дои:10.1055 / с-2005-918482
- ^ Высокая лицевая диастереоселективность во внутри- и межмолекулярных реакциях хиральных бензильных катионов Фридрих Мюльтау, Оливер Шустер и Торстен Бах Варенье. Chem. Soc., 2005, 127 (26), стр. 9348–9349 Дои:10.1021 / ja050626v
- ^ Стереоселективные реакции со стабилизированными карбокатионами Пьер Джорджио Коцци и Фидес Бенфатти Энгью. Chem. Int. Эд. 2009, 48 Дои:10.1002 / anie.200905235
- ^ Davin LB, Wang HB, Crowell AL, et al. (1997). «Стереоселективное бимолекулярное феноксирадикальное связывание вспомогательным (диригентным) белком без активного центра». Наука. 275 (5298): 362–6. Дои:10.1126 / science.275.5298.362. PMID 8994027.
- ^ Пикель Б., Константин М.А., Пфаннштейн Дж., Конрад Дж., Бейфус Ю., Шаффер А. (март 2007 г.). «Энантиокомплементарный диригентный белок для энантиоселективного окислительного связывания фенолов, катализируемого лакказой». Angewandte Chemie. 53 (4): 273–284. Дои:10.1007 / с10086-007-0892-х.





