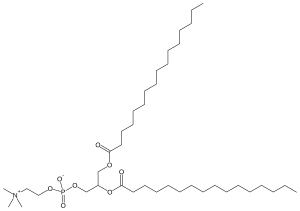
Дипальмитоилфосфатидилхолин - Dipalmitoylphosphatidylcholine
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.018.322 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C40ЧАС80NО8п | |
| Молярная масса | 734.053 г · моль−1 |
| Поверхностное натяжение: | |
| 4,6 ± 0,5 х 10−10 M[1] | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Дипальмитоилфосфатидилхолин (DPPC) это фосфолипид (и лецитин ) состоящий из двух C16 пальмитиновая кислота группы, прикрепленные к фосфатидилхолин головная группа.
Он является основным компонентом легочных сурфактантов, которые снижают работу дыхания и предотвращают коллапс альвеол во время дыхания. Он также играет важную роль в изучении липосом и бислоев человека.
Сурфактант легких
Сурфактант легких (LS) представляет собой поверхностно-активный материал, производимый большинством дышащих воздухом животных с целью снижения поверхностного натяжения слоя воды, в котором происходит газообмен в легких, учитывая, что движения при вдохе и выдохе могут вызвать повреждение, если недостаточно энергии для поддержания структурной целостности альвеол.
Монослой, образованный LS на границе раздела, состоит в основном из фосфолипидов (80%), а также белков (12%) и нейтральных липидов (8%). Среди фосфолипидов наиболее распространенным является фосфатидилхолин (PC, или лецитин) (70–85%), который, в свою очередь, составляет основу пула подобных диацилфатидилхолинов, из которых 50% составляет дипальмитоилфосфатидилхолин или DPPC.[2]
Хотя сам DPPC уже обладает способностью снижать поверхностное натяжение альвеолярной жидкости, белки и другие липиды в поверхностно-активном веществе дополнительно способствуют адсорбции кислорода на границе раздела воздух-жидкость.
DPPC представляет собой вариант фосфатидилхолина. Его структура включает в себя как гидрофильную «головку», так и гидрофобные «хвосты», и именно такое расположение позволяет снизить поверхностное натяжение водного слоя. Холиновый радикал составляет полярную гидрофильную головку; он ориентирован и распространяется в альвеолярную жидкость. Пальмитиновая кислота (C16) цепи образуют неполярные гидрофобные хвосты; они ориентированы на внешнюю сторону.
Биосинтез
Синтез фосфолипидов, содержащихся в легочном сурфактанте, происходит в эндоплазматическом ретикулуме пневмоцитов II типа. Легочный сурфактант содержит как белковые, так и липидные компоненты. В частности, было обнаружено, что фосфатидилхолин (PC) является наиболее распространенным фосфолипидом (70–85%), и что PC в основном присутствует в виде дипальмитоилфосфатидилхолина (DPPC).
De novo Синтез фосфатидилхолина в легких происходит главным образом из цитидиндифосфат-холина (ЦДФ-холина). Превращение ЦДФ-холина в фосфатидилхолин осуществляется холинфосфатцитидилтрансферазой. При определенных условиях ферменты холинкиназа, глицерин-3-фосфатацилтрансфераза и фосфатидатфосфатаза могут играть регулирующую роль.
Из общего количества DPPC в легочном сурфактанте 45% приходится на de novo биосинтез. Остальное образуется механизмами трансацилирования, которые обменивают пальмитоильные группы на ненасыщенные ацильные цепи других родственных диацилфосфатидилхолинов.[3] Удаление ацильных цепей из этих родственных соединений дает лизофосфатидилхолин; Реацилирование пальмитоил-КоА затем облегчается лизофосфатидилхолинацилтрансферазой с образованием DPPC.
Характеристики

Температура
Этот фосфолипид находится в твердой / гелевой фазе при 37 ° C (при эффективной температуре человеческого тела). Его температура плавления составляет около 41,3 ° C. Следовательно, когда температура выше 41 ° C, DPPC больше не находится в гелевой фазе, а в жидкой.[4]
Было продемонстрировано, что при контакте с поверхностями из диоксида кремния бислои DPPC имеют разные свойства в зависимости от температуры.
Толщина слоя остается неизменной при 25 ° C и 39 ° C. Однако при дальнейшем повышении температуры до 55 ° C двухслойная структура DPPC значительно изменяется, что вызывает уменьшение толщины слоя. Причина этой особенности заключается в том, что фактически при 55 ° C DPPC находится в неупорядоченном жидком состоянии, тогда как при более низкой температуре он находится в более упорядоченном гелевом состоянии.
Температура также влияет на шероховатость слоя, которая начинает незначительно изменяться при понижении температуры до 25 ° C.
Наконец, несущая способность двойного слоя выше, когда температура превышает температуру фазового перехода (из-за его повышенной текучести). Когда эта молекула находится в жидком состоянии, где текучесть намного выше, считается, что бислой также развивает способность к самовосстановлению.[5]
Амфипатическое поведение

DPPC - это амфипатический липид. Эта характеристика обусловлена его гидрофильной головкой, состоящей из полярной фосфатидилхолиновой группы, и ее гидрофобными хвостами, образованными двумя неполярными пальмитиновыми кислотами (C16) цепи. Эта особенность позволяет DPPC легко и спонтанно образовывать мицеллы, монослои, бислои и липосомы при контакте с полярным растворителем.
Поверхностно-активное вещество
DPPC является основным фосфолипидом легочного сурфактанта, и он является поверхностно-активным из-за его амфипатического поведения и адсорбция емкость.[6] Однако адсорбция не является оптимальной при температуре человеческого тела для одного DPPC, поскольку при 37 ° C он находится в гелеобразной фазе. Наличие некоторых ненасыщенных фосфолипидов (таких как диолеоилфосфатидилхолин [DOPC] или фосфатидилглицерин ) и холестерин увеличивает текучесть поверхностно-активного вещества, поэтому оно может более эффективно адсорбировать кислород.[7] Когда эта смесь контактирует с водой, например, она накапливается на границе раздела вода-воздух и образует тонкую поверхностную пленку поверхностно-активного вещества. Полярные головы молекул, составляющих ПАВ, притягиваются полярными молекулами жидкости (в данном случае H2О молекулы), вызывая значительное уменьшение поверхностного натяжения воды.
Текущее использование
Исследования используют
DPPC обычно используется для исследовательских целей, таких как создание липосом и бислоев, которые используются в более крупных исследованиях. В Техника Ленгмюра – Блоджетт позволяет синтез липосомальных бислоев DPPC. В настоящее время эти липосомы используются для изучения свойств этого фосфатидилхолина и его использования в качестве механизма доставки лекарств в организм человека.
Более того, поскольку динамика слияния везикул для липидов в гелевой фазе отличается от жидкой фазы, это позволяет ученым использовать DPPC вместе с DOPC в Атомно-силовая микроскопия и атомно-силовая спектроскопия.[8][9]
Фармацевтическое использование
Дипальмитоилфосфатидилхолин (DPPC) обычно используется для приготовления некоторых лекарств, используемых для лечения респираторного дистресс-синдрома (RDS) у новорожденных. Современные синтетические поверхностно-активные вещества представляют собой комбинации DPPC вместе с другими фосфолипидами,[10] нейтральные липиды и липопротеины.
Лечение недоношенных детей с РДС с использованием сурфактантов было первоначально разработано в 1960-х годах, и недавние исследования продемонстрировали улучшение клинических результатов.[11] Первым лечением некоторых новорожденных с РДС были поверхностно-активные фосфолипиды, в частности DPPC, с помощью аэрозоля (Robillard, 1964).[требуется полная цитата ] Однако это лечение оказалось неэффективным, поскольку введение одного только DPPC не дало никаких положительных эффектов. Впоследствии были проведены различные исследования, чтобы попытаться найти более эффективные препараты для лечения этого заболевания.
Легочные сурфактанты можно разделить на три типа:[12]
Безбелковые синтетические поверхностно-активные вещества первого поколения содержали только DPPC. Самый известный из них колфосерил пальмитат.[12]
Поверхностно-активные вещества второго поколения были природного (животного) происхождения и были получены из легких крупного рогатого скота или свиней. Поверхностно-активные вещества, экстрагированные из легких крупного рогатого скота, были Infasurf и Альвофакт, экстракты легких свиней включены Куросурф, и те, которые сделаны из модифицированных экстрактов легких крупного рогатого скота, включали Сурванта или Бераксурф (Beractant ). В отличие от новорожденных с РДС, которым вводили препараты первого поколения, тем, кто лечился этими сурфактантами второго поколения, требовалось меньше кислорода и вентиляции в течение 72 часов после введения препарата.
Третье поколение поверхностно-активных веществ включает синтетические пептиды или рекомбинантные белки. В них используется смесь различных компонентов. DPPC - это агент, используемый для уменьшения поверхностного натяжения, а остальные компоненты способствуют увеличению адсорбции кислорода. Наиболее известны Venicute и Surfaxin.[12] Эти препараты все еще находятся в стадии разработки, поэтому пока нет доказательств того, обладают ли они преимуществами по сравнению с препаратами второго поколения.
DPPC также используется для формирования липосомы которые используются как компоненты доставки лекарств системы.[13]
Расстройство дисфункции сурфактанта - это заболевание, которое поражает новорожденных детей, у которых легочного сурфактанта недостаточно для адекватного дыхания, что приводит к респираторному дистресс-синдрому (RDS).[14]
Несмотря на то, что DPPC является одним из основных компонентов сурфактанта легких, большинство генетических ошибок, которые связаны с нарушением дисфункции сурфактанта, не связаны с DPPC. Скорее, основными причинами этого заболевания являются различия в производстве сурфактантные белки B и C из-за генетических аномалий.
Однако существует генетическое заболевание, связанное с DPPC, которое вызывает дефицит продукции Белок ABCA1. Этот белок имеет решающее значение для транспорта фосфолипидов - и, следовательно, DPPC - к пластинчатые тела альвеолярных клеток, где DPPC взаимодействует с белками сурфактанта с образованием легочного сурфактанта.[15]
Текущие исследования не могут найти корреляция между процентным содержанием DPPC в легочном сурфактанте и возрастом беременности, хотя была обнаружена доказанная взаимосвязь между процентным содержанием DPPC и POPC (пальмитоил-олеоилфосфатидилхолин) у детей с респираторный дистресс-синдром по сравнению с младенцами без этого состояния. Эти связи предполагают, что конкретный состав сурфактанта приведет к респираторному дистресс-синдрому, независимо от срока беременности.
Корреляция между процентом DPPC и респираторным дистресс-синдромом является причиной того, что DPPC используется для изготовления лекарств для лечения новорожденных с этим заболеванием.[16]
Кроме того, было показано, что DPPC связан с инфицированием поляризованных клеток конкретным видом человека. аденовирус (HAdV-C2). Некоторые исследования показали, что ненасыщенный DPPC усиливает инфекцию Клетки A59 с HAdV-C2 (возможно, разрешив проникновение вируса через апикальную сторону поляризованных клеток).[17]
Рекомендации
- ^ Смит, Росс; Танфорд, Чарльз (июнь 1972 г.). «Критическая концентрация мицелл l-α-дипальмитоилфосфатидилхолина в воде и растворах вода / метанол». Журнал молекулярной биологии. 67 (1): 75–83. Дои:10.1016/0022-2836(72)90387-7. PMID 5042465.
- ^ Стахович-Куснеж, Анна; Зайдлер, Томаш; Рогальская, Ева; Корховец, Яцек; Корховец, Беата (01.02.2020). «Монослой легочного сурфактанта - хороший естественный барьер против дибензо-п-диоксинов». Атмосфера. 240: 124850. Дои:10.1016 / j.chemosphere.2019.124850. ISSN 0045-6535. PMID 31561163.
- ^ Фернандес Руано, Д. Мигель Луис (2000). Характеристика легочного сурфактанта: Estudio de la estructura y función de la proteína A (SP-A) (PDF). Мадрид: Мадридский университет Комплутенсе. С. 10–11.
- ^ «Дипальмитоилфосфатидилхолин - обзор | Темы ScienceDirect». www.sciencedirect.com. Получено 2019-10-25.
- ^ Ван, Мин; Зандер, Томас; Лю, Сяоянь; Лю, Чао; Радж, Аканкша; Флориан Виланд, Д. С .; Гарамус, Васил М .; Willumeit-Römer, Regine; Клаэссон, Пер Мартин; Дединайте, Андра (01.05.2015). «Влияние температуры на нанесенные бислои дипальмитоилфосфатидилхолина (DPPC): структура и смазывающие свойства». Журнал коллоидной и интерфейсной науки. 445: 84–92. Bibcode:2015JCIS..445 ... 84 Вт. Дои:10.1016 / j.jcis.2014.12.042. ISSN 0021-9797. PMID 25596372.
- ^ Бай, Сюань; Сюй, Лу; Тан, Дженни Ю.; Zuo, Yi Y .; Ху, Гоцин (01.10.2019). «Адсорбция фосфолипидов на поверхности воздух – вода». Биофизический журнал. 117 (7): 1224–1233. Bibcode:2019BpJ ... 117.1224B. Дои:10.1016 / j.bpj.2019.08.022. ISSN 1542-0086. ЧВК 6818144. PMID 31519299.
- ^ Джексон, Дж. Крейг (2012-01-01), Глисон, Кристин А.; Деваскар, Шерин У. (ред.), "Глава 46 - Респираторный дистресс у недоношенного ребенка", Болезни Эйвери новорожденных (девятое издание), W.B. Сондерс, стр. 633–646, ISBN 9781437701340, получено 2019-10-25
- ^ Panzuela, S .; Tieleman, D. P .; Mederos, L .; Веласко, Э. (22.10.2019). «Молекулярный порядок в липидных монослоях: атомистическое моделирование». Langmuir. 35 (42): 13782–13790. arXiv:1903.06659. Bibcode:2019arXiv190306659P. Дои:10.1021 / acs.langmuir.9b02635. ISSN 0743-7463. PMID 31553617. S2CID 119061661.
- ^ Аттвуд, Саймон Дж .; Чой, Ёнджик; Леоненко, Зоя (06.02.2013). «Подготовка планарных липидных бислоев, поддерживаемых DOPC и DPPC, для атомно-силовой микроскопии и атомно-силовой спектроскопии». Международный журнал молекулярных наук. 14 (2): 3514–3539. Дои:10.3390 / ijms14023514. ISSN 1422-0067. ЧВК 3588056. PMID 23389046.
- ^ Афенштадт, К. (2010). «Нейтральные липиды в дрожжах: синтез, хранение и разложение». Справочник по углеводородной и липидной микробиологии. С. 471–480. Дои:10.1007/978-3-540-77587-4_35. ISBN 978-3-540-77584-3.
- ^ Солл, Роджер; Озек, Эрен (20 января 2010 г.). «Профилактическое синтетическое поверхностно-активное вещество, не содержащее протеинов, для предотвращения заболеваемости и смертности недоношенных детей». Кокрановская база данных систематических обзоров (1): CD001079. Дои:10.1002 / 14651858.CD001079.pub2. ISSN 1469-493X. ЧВК 7059181. PMID 20091513.
- ^ а б c Chattás, Lic. Гильермина (октябрь 2013 г.). "Administración de surfactante exógeno" (PDF). Revista Enfermería Neonatal. №16: 10–17 - через Fundasamin.
- ^ Ли, Цзин; Ван, Сюлин; Чжан, Тин; Ван, Чунлинг; Хуан, Чжэньцзюнь; Ло, Сян; Дэн, Ихуэй (2015). «Обзор фосфолипидов и их основных применений в системах доставки лекарств». Азиатский журнал фармацевтических наук. 10 (2): 81–98. Дои:10.1016 / j.ajps.2014.09.004.
- ^ Справка, Дом генетики. «Дисфункция сурфактанта». Домашний справочник по генетике. Получено 2019-10-24.
- ^ Справка, Дом генетики. «Ген ABCA3». Домашний справочник по генетике. Получено 2019-10-24.
- ^ Ashton, M. R .; Postle, A.D .; Холл, М. А .; Smith, S.L .; Kelly, F.J .; Норманд, И. К. (апрель 1992 г.). «Фосфатидилхолиновый состав аспиратов эндотрахеальной трубки новорожденных и последующих респираторных заболеваний». Архив детских болезней. 67 (4 Спец. №): 378–382. Дои:10.1136 / adc.67.4_spec_no.378. ISSN 1468-2044. ЧВК 1590480. PMID 1586174.
- ^ Луизони, Стефания; Гребер, Урс Ф. (2016-01-01), Куриэль, Дэвид Т. (редактор), «2 - Биология проникновения аденовирусных клеток: рецепторы, пути, механизмы», Аденовирусные векторы для генной терапии (второе издание), Academic Press, стр. 27–58, ISBN 9780128002766, получено 2019-10-25
