Кардиолипин - Cardiolipin

Кардиолипин (Название ИЮПАК 1,3-бис (sn-3’-фосфатидил) -sn-глицерин, также известный как Калькуттский антиген) является важным компонентом внутренняя митохондриальная мембрана, где он составляет около 20% от общей липидной композиции. Его также можно найти в мембранах большинства бактерии. Название «кардиолипин» произошло от того факта, что он был впервые обнаружен в сердцах животных. Впервые он был выделен из говяжьего сердца в начале 1940-х годов.[1] В клетках млекопитающих, но также и в клетках растений,[2][3] кардиолипин (CL) находится почти исключительно во внутренней митохондриальной мембране, где он важен для оптимального функционирования многих ферменты которые участвуют в метаболизме энергии митохондрий.
Структура

Кардиолипин (КЛ) - это разновидность дифосфатидилглицерин липид. Два фосфатидная кислота части соединиться с глицерин позвоночник в центре, образуя димерную структуру. Таким образом, он имеет четыре алкильные группы и потенциально несет два отрицательных заряда. Так как кардиолипин состоит из четырех различных алкильных цепей, потенциал сложности этого вида молекул огромен. Однако в большинстве тканей животных кардиолипин содержит 18-углеродные жирные алкильные цепи с 2 ненасыщенными связями на каждой из них.[4] Было высказано предположение, что конфигурация (18: 2) 4 ацильной цепи является важным структурным требованием для высокого сродства CL к белкам внутренней мембраны в митохондриях млекопитающих.[5] Однако исследования с изолированными ферментными препаратами показывают, что его важность может варьироваться в зависимости от исследуемого белка.
Поскольку в молекуле два фосфата, каждый из них может улавливать один протон. Хотя он имеет симметричную структуру, ионизация одного фосфата происходит при совершенно другом уровне кислотности, чем ионизация обоих: pK1 = 3 и pK2 > 7,5. Таким образом, в нормальных физиологических условиях (при pH около 7) молекула может нести только один отрицательный заряд. Гидроксильные группы (–OH и –O−) на фосфате образует стабильную внутримолекулярную водородную связь с гидроксильной группой центрированного глицерина, образуя таким образом бициклическую резонансную структуру. Эта структура захватывает один протон, что очень полезно для окислительного фосфорилирования.
Поскольку головная группа образует такую компактную структуру велосипеда, площадь головной группы довольно мала по сравнению с большой хвостовой областью, состоящей из 4 ацильных цепей. На основе этой особой структуры в 1982 году был представлен флуоресцентный митохондриальный индикатор нонилакридиновый оранжевый (NAO).[6] и позже было обнаружено, что он воздействует на митохондрии, связываясь с CL. У NAO очень большая голова и маленькая структура хвоста, которая может компенсировать маленькую голову кардиолипина, большую структуру хвоста, и располагаться в строго упорядоченном виде.[7] Было опубликовано несколько исследований с использованием NAO как количественного митохондриального индикатора, так и индикатора содержания ХЛ в митохондриях. Однако на NAO влияет мембранный потенциал и / или пространственное расположение CL,[8][9][10] поэтому нецелесообразно использовать NAO для количественных исследований ХЛ или митохондрий неповрежденных дышащих митохондрий. Но NAO по-прежнему представляет собой простой метод оценки содержания CL.
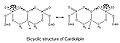
Кардиолипин бициклическая структура

Структура НАО
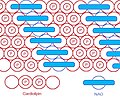
НАО и КЛ организованы в строгом порядке
Метаболизм и катаболизм

Метаболизм
Эукариотический путь
Считается, что у эукариот, таких как дрожжи, растения и животные, процессы синтеза происходят в митохондриях. Первым шагом является ацилирование глицерин-3-фосфата глицерин-3-фосфатом. ацилтрансфераза. Затем ацилглицерин-3-фосфат можно еще раз ацилировать с образованием фосфатидная кислота (ПА). С помощью фермента CDP-DAG-синтазы (CDS) (фосфатидатцитидилилтрансфераза ), PA преобразуется в цитидиндифосфат -диацилглицерин (CDP-DAG). Следующим шагом является преобразование CDP-DAG в фосфатидилглицерин фосфат (PGP) ферментом PGP-синтазой, за которым следует дефосфорилирование автор: PTPMT1 [11] сформировать PG. Наконец, молекула CDP-DAG связана с PG с образованием одной молекулы кардиолипина, катализируемой локализованным в митохондриях ферментом кардиолипинсинтазой (CLS).[2][3][12]
Прокариотический путь
У прокариот, таких как бактерии, дифосфатидилглицеринсинтаза катализирует перенос фосфатидил часть одного фосфатидилглицерина на свободную 3'-гидроксильную группу другого с отщеплением одной молекулы глицерина за счет действия фермента, связанного с фосфолипаза D. В некоторых физиологических условиях фермент может действовать в обратном порядке, удаляя кардиолипин.
Катаболизм
Катаболизм кардиолипина может происходить за счет катализа фосфолипаза А2 (PLA) для удаления жирных ацильных групп. Фосфолипаза D (PLD) в митохондриях гидролизует кардиолипин до фосфатидная кислота.[13]
Функции
Регулирует агрегатные структуры

Из-за уникальной структуры кардиолипина изменение pH и наличие двухвалентный катионы могут вызвать структурные изменения. CL показывает большое разнообразие форм агрегатов. Установлено, что в присутствии Са2+ или других двухвалентных катионов, CL может иметь пластинчатый -к-шестиугольник (Lа-ЧАСII) фаза перехода. И считается, что он имеет тесную связь с мембранный сплав.[14]
Облегчает четвертичную структуру
Фермент цитохром с оксидаза, также известный как Комплекс IV, представляет собой большой трансмембранный белок комплекс, обнаруженный в митохондриях и бактериях. Это последний фермент в дыхательных путях. электронная транспортная цепь расположен во внутренней митохондриальной или бактериальной мембране. Он получает электрон от каждой из четырех молекул цитохрома с и передает их одной молекуле кислорода, превращая молекулярный кислород в две молекулы воды. Было показано, что Комплексу IV необходимы две связанные молекулы CL для поддержания его полной ферментативной функции. Цитохром bc1 (Комплекс III) также нуждается в кардиолипине для поддержания своего четвертичная структура и функциональная роль.[15] Комплекс V окислительного фосфорилирования Аппарат также демонстрирует высокую аффинность связывания с CL, связывая четыре молекулы CL на молекулу комплекса V.[16]

Запускает апоптоз
Распределение кардиолипина на внешней мембране митохондрий должно приводить к апоптозу клеток, о чем свидетельствует высвобождение цитохрома c (cyt c), активация каспазы-8, индукция MOMP и активация инфламмасомы NLRP3.[17] В течение апоптоз, cyt c высвобождается из межмембранного пространства митохондрий в цитозоль. Cyt c может затем связываться с рецептором IP3 на эндоплазматический ретикулум, стимулируя высвобождение кальция, который затем реагирует обратно, вызывая высвобождение cyt c. Когда концентрация кальция достигает токсичного уровня, это вызывает гибель клеток. Считается, что цитохром с играет роль в апоптозе через высвобождение апоптотических факторов из митохондрии.[18]Кардиолипин-специфический оксигеназа производит CL гидропероксиды что может привести к изменению конформации липида. Окисленный CL переносится с внутренней мембраны на внешнюю, а затем способствует образованию проницаемой поры, которая высвобождает cyt c.

Служит ловушкой для протонов для окислительного фосфорилирования
Вовремя окислительного фосфорилирования процесс катализируется Комплекс IV большие количества протонов переносятся с одной стороны мембраны на другую, вызывая сильное изменение pH. Предполагается, что CL действует как ловушка для протонов внутри митохондриальных мембран, тем самым строго локализуя пул протонов и минимизируя изменения pH в межмембранном пространстве митохондрий.
Эта функция связана с уникальной структурой CL. Как указано выше, CL может захватывать протон в бициклической структуре, неся отрицательный заряд. Таким образом, эта бициклическая структура может служить в качестве электронного буферного пула для высвобождения или поглощения протонов для поддержания pH около мембран.[7]
Прочие функции
- Холестерин перемещение с внешней на внутреннюю митохондриальную мембрану
- Активирует расщепление боковой цепи холестерина митохондрий
- Импортировать белок в митохондриальный матрикс
- Антикоагулянт функция
- Модулирует α-синуклеин[19] - нарушение этого процесса считается причиной болезни Паркинсона.
Клиническое значение
Синдром Барта
Синдром Барта это редкое генетическое заболевание, которое в 1970-х годах было признано причиной детской смерти. Имеет мутацию в гене, кодирующем тафаззин, фермент, участвующий в биосинтез кардиолипина. Тафаззин - незаменимый фермент для синтеза кардиолипина у эукариот, участвующих в ремоделировании ацильных цепей ХЛ путем переноса линолевая кислота с ПК на монолизокардиолипин.[20] Мутация тафаззина вызывает недостаточное ремоделирование кардиолипина. Тем не менее, похоже, что клетки компенсируют, и производство АТФ аналогично или выше, чем у нормальных клеток.[21] Самки гетерозиготный на черту не влияют. У людей, страдающих этим заболеванием, аномальные митохондрии. Кардиомиопатия и общая слабость обычна для этих пациентов.
Болезнь Паркинсона и болезнь Альцгеймера
Окислительный стресс и перекисное окисление липидов, как полагают, являются факторами, ведущими к потере нейронов и митохондриальной дисфункции в черная субстанция в болезнь Паркинсона, и может играть раннюю роль в патогенезе Болезнь Альцгеймера.[22][23] Сообщается, что содержание ХЛ в головном мозге снижается с возрастом,[24] и недавнее исследование мозга крысы показывает, что это результат перекисного окисления липидов в митохондриях, подвергшихся стрессу со стороны свободных радикалов. Другое исследование показывает, что путь биосинтеза ХЛ может быть выборочно нарушен, вызывая снижение на 20% и изменение состава содержания ХЛ.[25] Это также связано с 15% снижением активности связанного комплекса I / III в цепи переноса электронов, что, как полагают, является критическим фактором в развитии болезни Паркинсона.[26]
Безалкогольная жировая болезнь печени и сердечная недостаточность
Недавно сообщалось, что в неалкогольная жировая болезнь печени[27] и сердечная недостаточность,[28] снижение уровня ХЛ и изменение состава ацильной цепи также наблюдается при дисфункции митохондрий. Тем не менее, роль CL в процессе старения и ишемии / реперфузии остается спорным.
Болезнь Танжера
Болезнь Танжера также связан с аномалиями ХЛ. Болезнь Танжера характеризуется очень низкой плазма крови уровни холестерина липопротеинов высокой плотности (ЛПВП) («хороший холестерин»), накопление эфиры холестерина в тканях и повышенный риск развития сердечно-сосудистые заболевания.[29] В отличие от синдрома Барта, болезнь Танжера в основном вызвана аномально повышенной продукцией CL. Исследования показывают, что при болезни Танжера уровень ХЛ увеличивается в три-пять раз.[30] Поскольку повышенный уровень CL усилит окисление холестерина, а затем образование оксистерины следовательно, увеличивает отток холестерина. Этот процесс может функционировать как механизм ускользания от избытка холестерина из клетки.
Сахарный диабет
Болезни сердца в два раза чаще встречаются у людей с диабетом. У диабетиков сердечно-сосудистые осложнения возникают в более раннем возрасте и часто приводят к преждевременной смерти, что делает сердечные заболевания основным убийцей диабетиков. Было обнаружено, что кардиолипин недостаточен в сердце на самых ранних стадиях диабета, возможно, из-за фермента, переваривающего липиды, который становится более активным в сердечной мышце, страдающей диабетом.[31]
Сифилис
Кардиолипин из коровьего сердца используется в качестве антигена в Тест Вассермана за сифилис. Антитела к кардиолипину также могут быть увеличены при многих других состояниях, включая системную красную волчанку, малярию и туберкулез, поэтому этот тест не является специфичным.
ВИЧ-1
Вирус иммунодефицита человека -1 (ВИЧ-1) заразил более 60 миллионов человек во всем мире. Гликопротеин оболочки ВИЧ-1 содержит по крайней мере четыре сайта для нейтрализующих антител. Среди этих сайтов мембранно-проксимальная область (MPR) особенно привлекателен в качестве мишени для антител, поскольку он способствует проникновению вируса в Т-клетки и является высококонсервативным среди вирусных штаммов.[32] Однако обнаружено, что два антитела, направленные против 2F5, 4E10 в MPR, реагируют с аутоантигенами, включая кардиолипин. Таким образом, такие антитела сложно вызвать вакцинацией.[33]
Рак
Впервые это было предложено Отто Генрих Варбург что рак возник в результате необратимого повреждения митохондриального дыхания, но структурная основа этого повреждения остается неуловимой. Поскольку кардиолипин является важным фосфолипидом, который обнаруживается почти исключительно во внутренней митохондриальной мембране и очень важен для поддержания функции митохондрий, предполагается, что аномалии ХЛ могут нарушать функцию митохондрий и биоэнергетику. Изучение[34] опубликованная в 2008 году о опухолях мозга мышей, подтверждающая теорию рака Варбурга, показывает серьезные отклонения в содержании или составе CL во всех опухолях.
Антифосфолипидный синдром
Пациенты с антитела против кардиолипина (Антифосфолипидный синдром ) могут иметь рецидивирующие тромботические события даже в раннем и позднем подростковом возрасте. Эти события могут происходить в сосудах, в которых тромбоз может быть относительно редко, таких как печеночные или почечные вены. Эти антитела обычно обнаруживаются у молодых женщин с рецидивирующими самопроизвольными абортами. При антикардиолипин-опосредованном аутоиммунном заболевании существует зависимость от аполипопротеин H для признания.[35]
Дополнительные антикардиолипиновые заболевания
Бартонеллезная инфекция
Бартонеллез это серьезная хроническая бактериальная инфекция, которой подвержены как кошки, так и люди. Спинелла обнаружила, что у одного пациента с bartonella henselae также были антитела к кардиолипину, что позволяет предположить, что бартонелла может запускать их производство.[36]
Синдром хронической усталости
Синдром хронической усталости изнурительное заболевание неизвестной причины, часто возникающее после острой вирусной инфекции. Согласно одному исследованию, 95% пациентов с CFS имеют антитела к кардиолипину.[37]
Смотрите также
Рекомендации
- ^ Пангборн М. (1942). «Выделение и очистка серологически активного фосфолипида из говяжьего сердца». J. Biol. Chem. 143: 247–256.
- ^ а б М. Новицки; М. Френтцен (2005). «Кардиолипинсинтаза Arabidopsis thaliana». Письма FEBS. 579 (10): 2161–2165. Дои:10.1016 / j.febslet.2005.03.007. PMID 15811335. S2CID 21937549.
- ^ а б М. Новицки (2006). «Характеристика кардиолипин-синтазы Arabidopsis thaliana». Кандидат наук. Диссертация, RWTH-Aachen University. Архивировано из оригинал на 2011-10-05. Получено 2011-07-11.
- ^ Майкл ШЛАЙМ; Стюарт БРОДИ; Карл Ю. ХОСТЕТЛЕР (март 1993 г.). «Митохондриальный кардиолипин у различных эукариот». Европейский журнал биохимии. 212 (3): 727–733. Дои:10.1111 / j.1432-1033.1993.tb17711.x. PMID 8385010.[мертвая ссылка ]
- ^ Шламе М., Хорват Л., Вай Л. (1994). «Взаимосвязь между липидным насыщением и липидно-белковым взаимодействием в митохондриях печени, модифицированная каталитическим гидрированием по отношению к молекулярным видам кардиолипина». Biochem. J. 265 (1): 79–85. Дои:10.1042 / bj2650079. ЧВК 1136616. PMID 2154183.
- ^ Эрбрих У., Науйок А, Петчел К., Циммерманн Х.В. (1982). «Флуоресцентное окрашивание митохондрий в живых HeLa- и LM-клетках новыми акридиновыми красителями». Гистохимия. 74 (1): 1–7. Дои:10.1007 / BF00495046. PMID 7085344. S2CID 19343056.
- ^ а б Томас Х. Хейнс; Норберт А. Денчер (2002). «Кардиолипин: ловушка протонов для окислительного фосфорилирования». FEBS Lett. 528 (1–3): 35–39. Дои:10.1016 / S0014-5793 (02) 03292-1. PMID 12297275. S2CID 39841617.
- ^ М. Гарсиафернандес; Д. Чеккарелли; У Мускателло (2004). «Использование флуоресцентного красителя 10-N-нонилакридинового оранжевого в количественных и локальных анализах кардиолипина: исследование на различных экспериментальных моделях». Аналитическая биохимия. 328 (2): 174–180. Дои:10.1016 / j.ab.2004.01.020. PMID 15113694.
- ^ Якобсон Дж., Дюшен М.Р., Хилес С.Дж. (2002). «Внутриклеточное распределение флуоресцентного красителя нонилакридинового оранжевого реагирует на потенциал митохондриальной мембраны: значение для анализа кардиолипина и митохондрий». Масса. J Neurochem. 82 (2): 224–233. Дои:10.1046 / j.1471-4159.2002.00945.x. PMID 12124423.
- ^ Кейдж Дж. Ф., Белл-Принц С., Стейнкамп Дж. А. (2000). «Окрашивание митохондриальных мембран 10-нонилакридиновым оранжевым, MitoFluor Green и Mito-Tracker Green зависит от лекарств, изменяющих потенциал митохондриальной мембраны». Цитометрия. 39 (3): 203–210. Дои:10.1002 / (SICI) 1097-0320 (20000301) 39: 3 <203 :: AID-CYTO5> 3.0.CO; 2-Z. PMID 10685077.
- ^ Чжан, Дж; Диксон Дж. Э. (8 июня 2011 г.). «Митохондриальная фосфатаза PTPMT1 необходима для биосинтеза кардиолипина». Cell Metab. 13 (6): 690–700. Дои:10.1016 / j.cmet.2011.04.007. ЧВК 3119201. PMID 21641550.
- ^ Р. Х. Хауткупер; Ф. М. ВАЗ (2008). «Кардиолипин, сердце митохондриального метаболизма». Клетка. Мол. Life Sci. 65 (16): 2493–2506. Дои:10.1007 / s00018-008-8030-5. PMID 18425414. S2CID 33856581.
- ^ Грегор Севк (1993-08-02). Справочник по фосфолипидам. п. 783. ISBN 978-0-8247-9050-9.
- ^ Антонио Ортис; Дж. Антуанетта Киллиан; Ари Дж. Верклей; Ян Вильшут (1999). «Слияние мембран и фазовый переход из пластинчатого в инвертированный-гексагональный в системах кардиолипиновых везикул, вызванный двухвалентными катионами». Биофизический журнал. 77 (4): 2003–2014. Дои:10.1016 / S0006-3495 (99) 77041-4. ЧВК 1300481. PMID 10512820.
- ^ Baltazar Gomez Jr .; Нил С. Робинсон (1999). «Фосфолипазное переваривание связанного кардиолипина обратимо инактивирует бычий цитохром bc1». Биохимия. 38 (28): 9031–9038. Дои:10.1021 / bi990603r. PMID 10413476.
- ^ Эбл К.С., Коулман В.Б., Хантган Р.Р., Каннингем С.К. (1990). «Тесно связанный кардиолипин в митохондриальной АТФ-синтазе сердца крупного рогатого скота по данным спектроскопии ядерного магнитного резонанса 31P». J. Biol. Chem. 265 (32): 19434–19440. PMID 2147180.
- ^ Paradies, G; Петросилло, G; Paradies, V; Руджеро, FM (2009). «Роль перекисного окисления кардиолипина и Ca2 + в митохондриальной дисфункции и болезни». Клеточный кальций. 45 (6): 643–650. Дои:10.1016 / j.ceca.2009.03.012. PMID 19368971.
- ^ Наталья Анатольевна Беликова; и другие. (2006). «Пероксидазная активность и структурные переходы цитохрома c, связанного с кардиолипин-содержащими мембранами». Биохимия. 45 (15): 4998–5009. Дои:10.1021 / bi0525573. ЧВК 2527545. PMID 16605268.
- ^ Райан, Тэмми; Бамм, Владимир В .; Stykel, Morgan G .; Coackley, Carla L .; Хамфрис, Кайла М .; Джеймисон-Уильямс, Рианнон; Амбасудхан, Раджеш; Моссер, Дик Д .; Липтон, Стюарт А. (26 февраля 2018 г.). «Воздействие кардиолипина на внешнюю митохондриальную мембрану модулирует α-синуклеин». Nature Communications. 9 (1): 817. Дои:10.1038 / s41467-018-03241-9. ISSN 2041-1723. ЧВК 5827019. PMID 29483518.
- ^ Xu Y .; Malhotra A .; Ren M .; Шламе М. (2006). «Ферментативная функция тафаззина». J. Biol. Chem. 281 (51): 39217–39224. Дои:10.1074 / jbc.M606100200. PMID 17082194.
- ^ Гонсальвес Ф. (2013). «Синдром Барта: клеточная компенсация митохондриальной дисфункции и ингибирование апоптоза из-за изменений ремоделирования кардиолипина, связанных с мутацией гена тафаззина (TAZ)». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1832 (8): 1194–1206. Дои:10.1016 / j.bbadis.2013.03.005. PMID 23523468.
- ^ Бил М.Ф. (2003). «Митохондрии, окислительное повреждение и воспаление при болезни Паркинсона». Энн Нью-Йорк Академия наук. 991: 120–131. Дои:10.1111 / j.1749-6632.2003.tb07470.x. PMID 12846981.
- ^ Дженнер П. (1991). «Окислительный стресс как причина болезни Паркинсона». Acta Neurol Scand Suppl. 136: 6–15. Дои:10.1002 / ana.10483. PMID 12666096. S2CID 29915368.
- ^ Ruggiero FM, Cafagna F, Petruzzella V, Gadaleta MN, Quagliariello E (1991). «Липидный состав синаптических и несинаптических митохондрий мозга крысы и эффект старения». J Neurochem. 59 (2): 487–491. Дои:10.1111 / j.1471-4159.1992.tb09396.x. PMID 1629722.
- ^ Эллис CE, Мерфи EJ, Митчелл Д.К., Головко М.Ю., Скаглиа Ф., Барсело-Коблин Г.К., Нуссбаум Р.Л. (2005). «Нарушение митохондриальных липидов и нарушение цепи переноса электронов у мышей, лишенных α-синуклеина». Mol Cell Biol. 25 (22): 10190–10201. Дои:10.1128 / MCB.25.22.10190-10201.2005. ЧВК 1280279. PMID 16260631.
- ^ Доусон TM, Доусон В.Л. (2003). «Молекулярные пути нейродегенерации при болезни Паркинсона». Наука. 302 (5646): 819–822. Дои:10.1126 / science.1087753. PMID 14593166. S2CID 35486083.
- ^ Petrosillo G .; Portincasa P .; Grattagliano I .; Казанова Г .; Matera M .; Руджеро Ф. М .; Ferri D .; Паради Г. (2007). «Митохондриальная дисфункция у крыс с неалкогольной жировой дистрофией печени: участие комплекса I, активных форм кислорода и кардиолипина». Биохим. Биофиз. Acta. 1767 (10): 1260–1267. Дои:10.1016 / j.bbabio.2007.07.011. PMID 17900521.
- ^ Sparagna G.C .; Chicco A. J .; Мерфи Р. К .; Bristow M. R .; Johnson C.A .; Rees M. L .; Макси М. Л .; McCune S. A .; Мур Р. Л. (2007). «Потеря сердечного тетралинолеоил кардиолипина при сердечной недостаточности человека и экспериментальной сердечной недостаточности». J. Lipid Res. 48 (7): 1559–1570. Дои:10.1194 / мл. M600551-JLR200. PMID 17426348.
- ^ Орам Дж. Ф. (2000). «Болезнь Танжера и ABCA1». Биохим. Биофиз. Acta. 1529 (1–3): 321–330. Дои:10.1016 / S1388-1981 (00) 00157-8. PMID 11111099.
- ^ Фобкер М .; Voss R .; Reinecke H .; Crone C .; Assmann G .; Уолтер М. (2001). «Накопление кардиолипина и лизокардиолипина в фибробластах субъектов с болезнью Танжера». FEBS Lett. 500 (3): 157–162. Дои:10.1016 / S0014-5793 (01) 02578-9. PMID 11445077. S2CID 38288370.
- ^ Сяньлинь Хань; и другие. (2007). «Изменения в содержании и составе кардиолипина в миокарде происходят на самых ранних стадиях диабета: исследование липидомики с дробовиком». Биохимия. 46 (21): 6417–6428. Дои:10.1021 / bi7004015. ЧВК 2139909. PMID 17487985.
- ^ Гэри Дж. Набель (2005). «Иммунология: на грани: нейтрализация оболочки ВИЧ-1». Наука. 308 (5730): 1878–1879. Дои:10.1126 / science.1114854. PMID 15976295. S2CID 27891438.
- ^ Дж. М. Бинли; и другие. (2004). «Комплексный анализ нейтрализации перекрестных кладок панели моноклональных антител против вируса иммунодефицита человека типа 1». Дж. Вирол. 78 (23): 13232–13252. Дои:10.1128 / JVI.78.23.13232-13252.2004. ЧВК 524984. PMID 15542675.
- ^ Майкл А. Кибиш; и другие. (2008). «Кардиолипин и аномалии цепи переноса электронов в митохондриях опухолей головного мозга мышей: липидомные доказательства, подтверждающие теорию рака Варбурга». Журнал липидных исследований. 49 (12): 2545–2556. Дои:10.1194 / мл. M800319-JLR200. ЧВК 2582368. PMID 18703489.
- ^ Макнил HP, Симпсон Р.Дж., Честерман К.Н., Крилис С.А. (1990). «Антифосфолипидные антитела направлены против сложного антигена, который включает липидсвязывающий ингибитор коагуляции: бета 2-гликопротеин I (аполипопротеин H)». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 87 (11): 4120–4. Дои:10.1073 / pnas.87.11.4120. ЧВК 54059. PMID 2349221.
- ^ Spinella A, Lumetti F, Sandri G, Cestelli V, Mascia MT. Помимо болезни кошачьих царапин: клинический случай инфекции бартонеллы, имитирующей васкулит. Case Rep Infect Dis. 2012; 2012: 354625.
- ^ Хокама Ю., Кампора С.Е., Хара С., Курибаяси Т., Ле Хуэйн Д., Ябусаки К. Антитела к антикардиолипину в сыворотке крови пациентов с диагностированным синдромом хронической усталости. Анал J Clin Lab. 2009; 23 (4): 210-2.
внешняя ссылка
- Кардиолипин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Кардиолипин (дифосфатидилглицерин)


