CBD-DMH - CBD-DMH
 | |
| Идентификаторы | |
|---|---|
| |
| Количество CAS |
|
| PubChem CID | |
| ChemSpider | |
| Химические и физические данные | |
| Формула | C25ЧАС38О2 |
| Молярная масса | 370,57 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Каннабидиол-диметилгептил (CBD-DMH или DMH-CBD) является синтетическим гомолог из каннабидиол где пентильная цепь заменена диметилгептильной цепью. Несколько изомеры этого соединения известны. Наиболее часто используемый изомер в исследованиях - (-) - CBD-DMH, который имеет такой же стереохимия как природный каннабидиол и 1,1-диметилгептильная боковая цепь. Это соединение не является психоактивным и действует в основном как анандамид ингибитор обратного захвата, но более эффективен, чем каннабидиол, как противосудорожное средство и имеет примерно такую же эффективность, как и противовоспалительное средство.[1][2][3][4][5] Неожиданно «неестественное» энантиомер (+) - CBD-DMH, стереохимия которого полностью изменилась по сравнению с каннабидиолом, оказался агонистом каннабиноидного рецептора прямого действия с Kя 17,4 нм при CB1 и 211нМ при CB2, и вызывает типичные каннабиноидные эффекты в исследованиях на животных.[6]
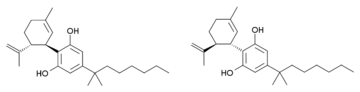
Также было описано другое аналогичное соединение с двойной связью в циклогексен кольцо смещено между 1,6-положениями, а не 2,3-положениями (т.е. аналогично синтетическому THC аналоги, такие как парагексил ), изопропенильная группа, насыщенная до изопропила, и 1,2-диметилгептильная боковая цепь. Он синтезируется Сокращение березы из 1,2-диметилгептильного аналога каннабидиол. Это соединение также оказывает сильные каннабиноидоподобные эффекты у животных, но имеет три хиральных центра и состоит из смеси восьми стереоизомеры, которые не были изучены индивидуально, поэтому неизвестно, какие стереоизомеры являются активными.[7][8]

Смотрите также
- Аномальный каннабидиол
- Каннабиноидные рецепторы
- HU-211
- HUF-101
- KLS-13019
- О-1871
- О-1918
- НЕСС-040С5
- Тетрагидроканнабифорол
использованная литература
- ^ Лейте, младший; Карлини, EA; Lander, N; Mechoulam, R (1982). «Противосудорожные эффекты (-) и (+) изомеров каннабидиола и их гомологов диметилгептила». Фармакология. 24 (3): 141–6. Дои:10.1159/000137588. PMID 7071126.
- ^ Бизоньо, Т; Hanus, L; Де Петрочеллис, L; Чилибон, S; Понде, Германия; Брэнди, я; Moriello, AS; Дэвис, JB; Mechoulam, R; Ди Марцо, V (2001). «Молекулярные мишени для каннабидиола и его синтетических аналогов: влияние на ваниллоидные рецепторы VR1 и на клеточное поглощение и ферментативный гидролиз анандамида». Br J Pharmacol. 134 (4): 845–52. Дои:10.1038 / sj.bjp.0704327. ЧВК 1573017. PMID 11606325.
- ^ Fride, E; Понде, Д; Брейер, А; Ханус, Л. (2005). «Периферические, но не центральные эффекты производных каннабидиола: опосредование CB (1) и неидентифицированными рецепторами». Нейрофармакология. 48 (8): 1117–29. Дои:10.1016 / j.neuropharm.2005.01.023. PMID 15910887. S2CID 16531395.
- ^ Бен-Шабат, S; Hanus, LO; Кацавиан, Г; Галлили, Р. (2006). «Новые производные каннабидиола: синтез, связывание с каннабиноидным рецептором и оценка их противовоспалительной активности». J Med Chem. 49 (3): 1113–7. Дои:10.1021 / jm050709m. PMID 16451075.
- ^ Юкнат, А; Kozela, E; Каушанский, Н; Mechoulam, R; Фогель, З. (2016). «Противовоспалительные эффекты производного каннабидиола диметилгептил-каннабидиола - исследования на микроглии BV-2 и энцефалитогенных Т-клетках». J Basic Clin Physiol Pharmacol. 27 (3): 289–96. Дои:10.1515 / jbcpp-2015-0071. PMID 26540221.
- ^ Hanus, LO; Чилибон, S; Понде, Германия; Брейер, А; Fride, E; Mechoulam, R (февраль 2005 г.). «Энантиомерные производные каннабидиола: синтез и связывание с рецепторами каннабиноидов». Org Biomol Chem. 3 (6): 1116–1123. Дои:10.1039 / B416943C. PMID 15750656.
- ^ Раздан Р.К., Парс Х.Г., Томпсон В.Р., Гранчелли Ф.Е. (1974). «Литий-аммиачное восстановление тетрагидроканнабинолов». Буквы Тетраэдра. 15 (49–50): 4315–4318. Дои:10.1016 / S0040-4039 (01) 92152-5.
- ^ Раздан, К. (1981). «Полный синтез каннабиноидов». У Джона Апсимона (ред.). Полный синтез натуральных продуктов. Wiley Interscience. п.245. ISBN 978-0-471-05460-3. OCLC 19487018.
