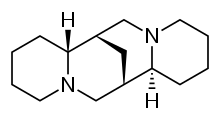
Спартеин - Sparteine
 | |
| Клинические данные | |
|---|---|
| Другие имена | (6р,8S,10р,12S) -7,15-диазатетрацикло [7.7.1.02,7.010,15] гептадекан |
| AHFS /Drugs.com | Международные названия лекарств |
| Код УВД | |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.001.808 |
| Химические и физические данные | |
| Формула | C15ЧАС26N2 |
| Молярная масса | 234.387 г · моль−1 |
| 3D модель (JSmol ) | |
| Плотность | 1,02 г / см3 |
| Температура плавления | 30 ° С (86 ° F) |
| Точка кипения | 325 ° С (617 ° F) |
| Растворимость в воде | 3,04 мг / мл (20 ° С) |
| |
| |
| | |
Спартеин это класс 1а антиаритмический агент; блокатор натриевых каналов. Это алкалоид и может быть извлечен из шотландский веник. Это преобладающий алкалоид в Lupinus mutabilis, и считается хелат двухвалентные катионы кальций и магний. Он не одобрен FDA для использования людьми в качестве антиаритмического средства и не включен в Классификация антиаритмических препаратов Vaughan Williams.
Он также используется как хиральный лиганд в органическая химия, особенно в синтезе с участием литийорганические реагенты.
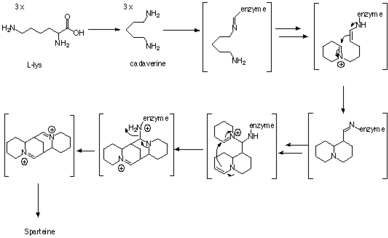
Биосинтез

Спартеин - это люпин алкалоид содержащую тетрациклическую бис-хинолизидиновую кольцевую систему, полученную из трех C5 цепочки лизин или, более конкретно, L-лизин.[1] Первым промежуточным звеном в биосинтезе является кадаверин, продукт декарбоксилирования лизина, катализируемый ферментом лизиндекарбоксилазой (LDC).[2] Три единицы кадаверина используются для формирования хинолизидинового скелета. Механизм образования был изучен ферментативно, а также с помощью экспериментов с индикаторами, но точный путь синтеза все еще остается неясным.
Трассирующие исследования с использованием 13C-15N-дважды меченный кадаверин показал, что три звена кадаверина включены в спартеин, и две связи C-N от двух звеньев кадаверина остаются нетронутыми.[3] Наблюдения также были подтверждены с помощью 2Эксперименты по мечению H ЯМР.[4]
Затем ферментативные данные показали, что три молекулы кадаверина превращаются в хинолизидиновое кольцо через промежуточные соединения, связанные с ферментом, без образования каких-либо свободных промежуточных соединений. Первоначально считалось, что превращение кадаверина в соответствующий альдегид, 5-аминопентаналь, катализируется ферментом диаминоксидазой.[5] Затем альдегид самопроизвольно превращается в соответствующее основание Шиффа Δ1-пиперидин. Сцепление двух молекул происходит между двумя таутомерами Δ1-пиперидин в реакции альдольного типа. Затем имин гидролизуют до соответствующего альдегида / амина. Затем первичный амин окисляется до альдегида с последующим образованием имина с образованием хинолизидинового кольца.[5]
Через 17-оксоспартеинсинтазу
Более поздние ферментативные данные показали наличие 17-оксоспартеинсинтаза (OS), фермент трансаминаза.[6][7][8][9][10][11] Дезаминированный кадаверин не высвобождается из фермента, поэтому можно предположить, что фермент катализирует образование хинолизидинового скелета каналированным образом.[9][10][11] 7-оксоспартеину требуется четыре единицы пирувата в качестве NH2 акцепторы и производит четыре молекулы аланина. И лизиндекарбоксилаза, и хинолизидиновый скелетообразующий фермент локализованы в хлоропластах.[12]
Смотрите также
Рекомендации
- ^ Дьюик PM (2009). Лекарственные натуральные продукты, 3-й. Эд. Вайли. п. 311.
- ^ Голебевский WM, Spenser ID (1988). «Биосинтез алкалоидов люпина. II. Спартеин и лупанин». Канадский химический журнал. 66 (7): 1734–1748. Дои:10.1139 / v88-280.
- ^ Рана Дж, Робинс ди-джей (1983). «Биосинтез алкалоидов хинолизидина: включение [1-амино-15 N, 1-13 C] кадаверина в спартеин». Журнал химического общества, химические коммуникации (22): 1335–6. Дои:10.1039 / c39830001335.
- ^ Фрейзер AM, Робинс DJ (1984). J. Chem. Soc., Chem. Сообщество. 22: 1147–9. Отсутствует или пусто
| название =(помощь) - ^ а б Анишевский Т (2007). Алкалоиды - Секреты жизни, 1-е изд.. Эльзевир. стр.98 –101.
- ^ Подмигнуть М., Хартманн Т. (1984). Энзимология биосинтеза хинолизидиновых алкалоидов; Химия натуральных продуктов: Залевски и Сколик (ред.). С. 511–520.
- ^ Wink M (декабрь 1987 г.). «Алкалоиды хинолизидина: биохимия, метаболизм и функции в растениях и культурах суспензий клеток». Planta Medica. 53 (6): 509–14. Дои:10.1055 / с-2006-962797. PMID 17269092.
- ^ Винк М., Хартманн Т. (май 1979 г.). «Трансаминирование кадаверина и пирувата: основной этап ферментативного биосинтеза хинолизидинового алкалоида в суспензионных культурах клеток Lupinus polyphyllus». Письма FEBS. 101 (2): 343–6. Дои:10.1016/0014-5793(79)81040-6. PMID 446758.
- ^ а б Перри Р., Винк М. (1988). «О роли Δ1-пиперидина и трипиперидина в биосинтезе хинолизидиновых алкалоидов». З. Натурфорш. 43 (5–6): 363–369. Дои:10.1515 / znc-1988-5-607.
- ^ а б Атта-ур-Рахман (ред.) (1995). Химия натуральных продуктов. 15. Эльзевир. п. 537. ISBN 978-0-444-42691-8.CS1 maint: дополнительный текст: список авторов (связь)
- ^ а б Робертс М., Винк М., ред. (1998). Алкалоиды: биохимия, экология и применение в медицине. Пленум Пресс. С. 112–114.
- ^ Подмигнуть М., Хартманн Т. (1980). «Ферментативный синтез хинолизидиновых алкалоидов в хлоропластах люпина». З. Натурфорш. 35 (1–2): 93–97. Дои:10.1515 / znc-1980-1-218.
внешняя ссылка
 СМИ, связанные с Спартеин в Wikimedia Commons
СМИ, связанные с Спартеин в Wikimedia Commons