Липополисахарид - Lipopolysaccharide

Липополисахариды (LPS), также известный как эндотоксины, большие молекулы состоящий из липид и полисахарид состоит из О-антигена, внешнего ядра и внутреннего ядра, соединенных Ковалентная связь; они находятся в внешняя мембрана из Грамотрицательные бактерии.
Период, термин липоолигосахарид («LOS») используется для обозначения низкомолекулярной формы бактериальных липополисахаридов.
Открытие
Токсическая активность ЛПС была впервые обнаружена и названа «эндотоксином» Ричард Фридрих Иоганнес Пфайффер, кто различал экзотоксины, который он классифицировал как токсин, который выделяется бактериями в окружающую среду, и эндотоксины, которые он считал токсином, находящимся «внутри» бактериальной клетки и высвобождающимся только после разрушения стенки бактериальной клетки.[1]:84 Последующая работа показала, что выпуск ЛПС из грамм отрицательный микробов не обязательно требует разрушения стенки бактериальной клетки, скорее, ЛПС секретируется как часть нормальной физиологической активности перемещение мембранных пузырьков в виде бактериальные везикулы наружной мембраны (OMV), который также может содержать другие факторы вирулентности и белки.[2]
Сегодня термин «эндотоксин» в основном используется как синоним ЛПС,[3] хотя есть несколько эндотоксинов, не связанных с ЛПС, например, так называемые дельта-эндотоксин белки, секретируемые Bacillus thuringiensis.
Функции у бактерий
ЛПС является основным компонентом внешней мембраны Грамотрицательные бактерии, что в значительной степени способствует структурной целостности бактерий и защищает мембрану от определенных видов химического воздействия. LPS также увеличивает отрицательный заряд клеточная мембрана и помогает стабилизировать общую структуру мембраны. Это имеет решающее значение для многих грамотрицательных бактерий, которые погибают, если их мутировать или удалить; однако оказывается, что ЛПС не важен по крайней мере для некоторых грамотрицательных бактерий, таких как Neisseria meningitidis, Moraxella catarrhalis, и Acinetobacter baumannii.[4] ЛПС вызывает сильный ответ у нормального животного иммунная система. Это также было связано с непатогенными аспектами бактериальной экологии, включая поверхностную адгезию, бактериофаг чувствительность и взаимодействие с хищниками, такими как амебы.
ЛПС необходим для правильного конформации омптин Мероприятия; однако гладкий LPS будет стерически препятствовать омптинам.
Сочинение
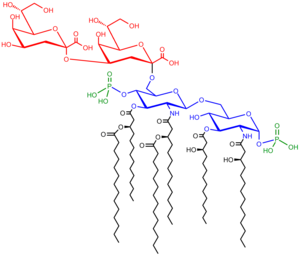
Он состоит из трех частей:
- О-антиген (или О-полисахарид)
- Основной олигосахарид
- Липид А
О-антиген
Повторяющийся гликан полимер содержащийся в LPS, называется O антиген, O полисахарид или O-боковая цепь бактерий. O-антиген присоединен к коровому олигосахариду и включает самый внешний домен молекулы LPS. Состав O-цепи варьируется от штамма к штамму. Например, существует более 160 различных структур O-антигенов, продуцируемых разными Кишечная палочка штаммы.[5] Наличие или отсутствие цепей O определяет, считается ли LPS шероховатой или гладкой. О-цепи полной длины сделают LPS гладким, тогда как отсутствие или сокращение O-цепочек сделает LPS грубым.[6] Бактерии с грубым LPS обычно имеют более проницаемые клеточные мембраны для гидрофобных антибиотиков, так как грубый LPS более эффективен. гидрофобный.[7] O-антиген экспонируется на самой внешней поверхности бактериальной клетки и, как следствие, является мишенью для распознавания хозяином. антитела.
Основной
Основной домен всегда содержит олигосахаридный компонент, который присоединяется непосредственно к липид А и обычно содержит сахара Такие как гептоза и 3-дезокси-D-манно-окт-2-улозоновая кислота (также известный как KDO, кето-дезоксиоктулозонат).[8] Ядра LPS многих бактерий также содержат неуглеводные компоненты, такие как фосфатные, аминокислотные и этаноламиновые заместители.
Липид А
Липид А в нормальных условиях фосфорилированный глюкозамин дисахарид украшен множеством жирные кислоты. Эти гидрофобные цепи жирных кислот закрепляют ЛПС на бактериальной мембране, а остальная часть ЛПС выступает с поверхности клетки. Домен липида А ответственен за большую часть токсичности Грамотрицательные бактерии. Когда бактериальные клетки лизированный посредством иммунная система фрагменты мембраны, содержащие липид А, попадают в кровоток, вызывая лихорадку, диарею и возможный смертельный эндотоксический шок (также называемый септический шок ). Фрагмент липида А является очень консервативным компонентом ЛПС.[9] Однако структура липида A варьируется среди видов бактерий, а структура липида A определяет общую иммунную активацию хозяина.[10]
Липоолигосахариды
Липоолигосахариды (LOS) - это гликолипиды, обнаруженные во внешней мембране некоторых типов Грамотрицательные бактерии, Такие как Neisseria виды и Гемофильный виды Этот термин является синонимом низкомолекулярной формы бактериального ЛПС.[11] LOS играет центральную роль в поддержании целостности и функциональности внешней мембраны Грамотрицательный клеточная оболочка. Липоолигосахариды играют важную роль в патогенезе некоторых бактериальных инфекций, поскольку они способны действовать как иммуностимуляторы и иммуномодуляторы.[11] Кроме того, молекулы LOS отвечают за способность некоторых бактериальных штаммов проявлять молекулярные мимикрия и антигенное разнообразие, помогая уклоняться от иммунной защиты хозяина и тем самым способствуя вирулентность этих бактериальных напряжения.
С химической точки зрения липоолигосахариды лишены О-антигенов и содержат только фиксирующуюся на внешней мембране часть на основе липида А и олигосахаридное ядро.[12] В случае Neisseria meningitidis, то липид А часть молекулы имеет симметричную структуру, а внутреннее ядро состоит из 3-дезокси-D-манно-2-октулозоновая кислота (KDO) и гептоза (Hep) фрагменты. Внешняя сердцевина олигосахаридной цепи варьируется в зависимости от бактериального напряжение.[11][12]Термин липоолигосахарид используется для обозначения низкомолекулярной формы бактериальных липополисахаридов, которые можно разделить на две формы: высокомолекулярная (Mr, или гладкая) форма обладает высокой молекулярной массой, повторяя полисахарид О-цепь, в то время как форма с низким молекулярным весом (с низким Mr или грубая), не имеет О-цепи, но вместо нее содержит короткий олигосахарид.[11]
Модификации ЛПС
Изготовление LPS может быть изменено, чтобы представить специфическую структуру сахара. Они могут быть распознаны либо другими ЛПС (что позволяет ингибировать токсины ЛПС), либо гликозилтрансферазами, которые используют эту структуру сахара для добавления более специфических сахаров. Высококонсервативный фермент-хозяин может детоксифицировать ЛПС, когда он входит в ткани животных или вырабатывается в них. Он также может превращать ЛПС в кишечнике в ингибитор ЛПС. Нейтрофилы, макрофаги и дендритные клетки продуцируют эту липазу, ацилоксиацилгидролазу (AOAH), которая инактивирует ЛПС путем удаления двух вторичных ацильных цепей из липида А с образованием тетраацил-ЛПС. Если им вводят ЛПС парентерально, у мышей, у которых отсутствует АОАГ, развиваются высокие титры неспецифических антител, развивается длительная гепатомегалия и наблюдается длительная толерантность к эндотоксинам. Инактивация ЛПС может потребоваться животным для восстановления гомеостаза после парентерального воздействия ЛПС.[13] Хотя у мышей есть много других механизмов для подавления передачи сигналов LPS, ни один из них не может предотвратить эти изменения у животных, у которых отсутствует AOAH.
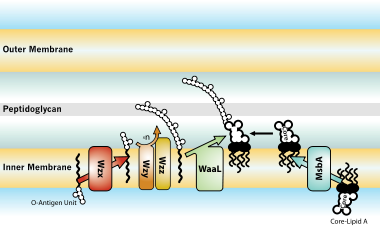
Биосинтез и транспорт
Биологическое воздействие на хозяев, инфицированных грамотрицательными бактериями
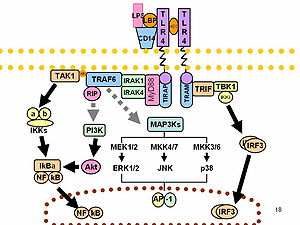
Иммунная реакция
ЛПС действует как прототип эндотоксина, потому что он связывает CD14 /TLR4 /MD2 рецептор комплекс во многих типах клеток, но особенно в моноциты, дендритные клетки, макрофаги и В-клетки, который способствует секреции про-воспалительный цитокины, оксид азота, и эйкозаноиды.[16]
В составе сотовой реакция на стресс, супероксид является одним из основных активные формы кислорода индуцируется LPS в различных типах клеток, которые экспрессируют TLR (толл-подобный рецептор ).
ЛПС также является экзогенным пироген (жаропонижающее вещество).
Имея решающее значение для грамотрицательных бактерий, эти молекулы являются кандидатами в мишени для новых противомикробный агенты.
Некоторые исследователи сомневаются в сообщениях об общих токсических эффектах, приписываемых всем липополисахаридам, в частности, для цианобактерии.[17]
Функция ЛПС изучается в течение нескольких лет из-за его роли в активации многих факторы транскрипции. LPS также производит множество типов медиаторов, участвующих в септический шок. Люди гораздо более чувствительны к ЛПС, чем другие животные (например, мыши). Доза 1 мкг / кг вызывает шок у человека, но мыши переносят дозу, в тысячу раз более высокую.[18] Это может быть связано с различиями в уровне циркулирующих природных антител между двумя видами.[19][20]Саид и др. показали, что ЛПС вызывает Ил-10 -зависимое ингибирование CD4 Т-клетки расширение и функционирование за счет повышающего регулирования ПД-1 уровни на моноциты что приводит к продукции IL-10 моноцитами после связывания PD-1 PD-L1.[21]
Эндотоксины в значительной степени ответственны за драматические клинические проявления инфекций патогенными грамотрицательными бактериями, такими как Neisseria meningitidis, патогены, вызывающие менингококковая инфекция, включая менингококкемия, Синдром Уотерхауса – Фридериксена, и менингит. Щелочная фосфатаза предотвращает воспаление кишечника (и "дырявый кишечник ") от бактерий путем дефосфорилирования липидной части А ЛПС.[22][23][24]
Брюс Бейтлер был удостоен части Нобелевской премии по физиологии и медицине 2011 года за свою работу, демонстрирующую, что TLR4 рецептор LPS.[25][26]
Было показано, что части ЛПС из нескольких бактериальных штаммов химически подобны поверхностным молекулам клетки-хозяина человека; способность некоторых бактерий представлять на своей поверхности молекулы, которые химически идентичны или похожи на поверхностные молекулы некоторых типов клеток-хозяев, называется молекулярной мимикрия.[27] Например, в Neisseria meningitidis L2,3,5,7,9, концевой тетрасахаридной частью олигосахарида (лакто-N-неотетраоза) является тот же тетрасахарид, что и в параглобозид, предшественник ABH гликолипид антигены найдены у человека эритроциты.[11] В другом примере терминальная трисахаридная часть (лактотриаоза) олигосахарида из патогенных Neisseria виды LOS также встречается в лактоносерии. гликосфинголипиды из клеток человека.[11] Большинство менингококков из групп B и C, а также гонококки, было показано, что этот трисахарид является частью их структуры LOS.[11] Присутствие этих "имитаторов" на поверхности клеток человека может, помимо действия в качестве "камуфляжа" со стороны иммунной системы, играть роль в устранении иммунная толерантность при заражении хозяев определенными человеческий лейкоцитарный антиген (HLA) генотипы, такие как HLA-B35.[11]
Недавно опубликованное новое исследование показало, что LPS может быть непосредственно обнаружен гемопоэтические стволовые клетки (HSC) через связывание с TLR4, вызывая их пролиферацию в ответ на системную инфекцию. Этот ответ активирует передачу сигналов TLR4-TRIF-ROS-p38 внутри HSC и через устойчивую активацию TLR4 может вызвать пролиферативный стресс, что приведет к нарушению их способности к конкурентному репопуляции.[28] Инфекция у мышей, использующих S. typhimurium показали аналогичные результаты, подтвердив также экспериментальную модель in vivo.
Влияние вариабельности на иммунный ответ
О-антигены (внешние углеводы) являются наиболее вариабельной частью молекулы ЛПС, придающей антигенную специфичность. Напротив, липид А является наиболее консервативной частью. Однако состав липида А также может варьироваться (например, по количеству и природе ацил цепочки даже внутри или между родами). Некоторые из этих вариантов могут придавать этим LPS антагонистические свойства. Например, Rhodobacter sphaeroides дифосфориллипид A (RsDPLA) является мощным антагонистом LPS в клетках человека, но является агонистом в клетках хомяка и лошадей.[нужна цитата ]
Было высказано предположение, что конический липид А (например, из Кишечная палочка ) являются более агонистическими, менее коническими липидами А, как липиды Porphyromonas gingivalis может активировать другой сигнал (TLR2 вместо TLR4), и полностью цилиндрический липид А, подобный липиду Rhodobacter sphaeroides антагонистичен TLR.[29][30]
Кластеры генов LPS сильно различаются между разными штаммами, подвидами, видами бактериальных патогенов растений и животных.[31][32]
Нормальная человеческая кровь сыворотка содержит анти-LOS-антитела, которые обладают бактерицидным действием, а пациенты, у которых есть инфекции, вызванные серотипически разными штаммами, обладают анти-LOS-антителами, которые отличаются по своей специфичности по сравнению с нормальной сывороткой.[33] Эти различия в гуморальном иммунном ответе на разные типы LOS могут быть связаны со структурой молекулы LOS, в первую очередь в структуре олигосахаридной части молекулы LOS.[33]В Neisseria gonorrhoeae было продемонстрировано, что антигенность молекул LOS может изменяться во время инфекции из-за способности этих бактерий синтезировать более одного типа LOS,[33] характеристика известная как изменение фазы. Кроме того, Neisseria gonorrhoeae, а также Neisseria meningitidis и Haemophilus influenzae,[11] могут дополнительно изменять свои LOS in vitro, например через сиалирование (модификация остатками сиаловой кислоты), и в результате способны повысить их устойчивость к дополнять -опосредованное убийство [33] или даже подавляют активацию комплемента[11] или избежать воздействия бактерицидный антитела.[11] Сиалирование также может способствовать нарушению нейтрофил привязанность и фагоцитоз клетками иммунной системы, а также снижением окислительного взрыва.[11] Haemophilus somnus, патоген крупного рогатого скота, также демонстрирует изменение фазы LOS, характеристика, которая может помочь избежать бык иммунная защита хозяина.[34]Взятые вместе, эти наблюдения предполагают, что вариации в молекулах бактериальной поверхности, такие как LOS, могут помочь патогену избежать как гуморальный (опосредованные антителами и комплементом) и клеточно-опосредованный (например, уничтожение нейтрофилами) иммунная защита хозяина.
Неканонические пути распознавания LPS
Недавно было показано, что помимо TLR4 опосредованные пути, некоторые члены семьи переходные рецепторные потенциальные ионные каналы распознают LPS.[35] LPS-опосредованная активация TRPA1 был показан на мышах[36] и Drosophila melanogaster мухи.[37] При более высоких концентрациях ЛПС активирует другие органы сенсорной Канал TRP семья, например, TRPV1, TRPM3 и в некоторой степени TRPM8.[38] LPS признан TRPV4 на эпителиальных клетках. Активация TRPV4 LPS была необходима и достаточна для индукции продукции оксида азота с бактерицидным эффектом.[39]
Влияние на здоровье
Эндотоксемия
Наличие эндотоксинов в крови называется эндотоксемией. Это может привести к септический шок, если иммунный ответ сильно выражен.[40]
Кроме того, эндотоксемия кишечного происхождения, особенно в интерфейс хозяин-патоген, считается важным фактором развития алкогольного гепатита,[41] который, вероятно, будет развиваться на основе синдром избыточного бактериального роста в тонкой кишке и увеличенный кишечная проницаемость.[42]
Липид А может вызвать неконтролируемую активацию иммунной системы млекопитающих с производством воспалительный посредники, которые могут привести к септический шок.[12] Этот воспалительный реакция опосредована Толл-подобный рецептор 4 который отвечает за активацию клеток иммунной системы.[12] Повреждение эндотелиальный слой кровеносных сосудов, вызванный этими воспалительный медиаторы могут привести к синдрому утечки капилляров, расширению кровеносных сосудов и снижению сердечной функции и могут привести к септический шок.[43] Выраженная активация комплемента также может наблюдаться позже по мере размножения бактерий в крови.[43] Высокая бактериальная пролиферация, вызывающая деструктивное повреждение эндотелия, также может привести к диссеминированное внутрисосудистое свертывание (ДВС-синдром) с потерей функции некоторых внутренних органов, таких как почки, надпочечники и легкие из-за нарушения кровоснабжения. Кожа может проявлять последствия повреждения сосудов, часто в сочетании с истощением факторов свертывания крови в виде петехии, пурпура и синяки. Конечности также могут быть поражены, иногда с разрушительными последствиями, такими как развитие гангрена, требуя последующего ампутация.[43] Нарушение функции надпочечников может вызвать надпочечниковая недостаточность и дополнительные кровоизлияние в причины надпочечников Синдром Уотерхауса-Фридериксена, оба из которых могут быть опасными для жизни. гонококковый LOS может нанести ущерб человеку фаллопиевы трубы.[33]
Аутоиммунное заболевание
В молекулярная мимикрия некоторых молекул LOS вызывают аутоиммунные реакции хозяина, такие как вспышки рассеянный склероз.[11][27] Другие примеры бактериальной мимикрии структур хозяина через LOS обнаружены у бактерий Helicobacter pylori и Campylobacter jejuni, микроорганизмы, вызывающие желудочно-кишечные заболевания у людей, и Haemophilus ducreyi что приводит к мягкий шанкр. Определенный C. jejuni Серотипы ЛПС (приписываемые определенным тетра- и пентасахаридным фрагментам основного олигосахарида) также связаны с Синдром Гийена-Барре и вариант Гийена – Барре, названный Синдром Миллера-Фишера.[11]
Связь с ожирением
Эпидемиологические исследования показали, что повышенная нагрузка эндотоксинами, которая может быть результатом увеличения популяций эндотоксин-продуцирующих бактерий в кишечном тракте, связана с определенными группами пациентов, связанными с ожирением.[44][45][46] Другие исследования показали, что очищенный эндотоксин из кишечная палочка может вызвать ожирение и инсулинорезистентность при введении в стерильный модели мышей.[47] Более недавнее исследование выявило потенциально важную роль Энтеробактерные клоаки B29 в отношении ожирения и инсулинорезистентности у пациента-человека.[48] Предполагаемый механизм связи эндотоксина с ожирением заключается в том, что эндотоксин индуцирует путь, опосредованный воспалением, что является причиной наблюдаемого ожирения и инсулинорезистентности.[47] Бактериальные роды, связанные с эффектами ожирения, связанными с эндотоксинами, включают: Эшерихия и Энтеробактер.
Системы лабораторных исследований и производства биотехнологий
Липополисахариды - частые загрязнители в плазмида ДНК приготовленные из бактерий или белков, экспрессируемых из бактерий, и должен быть удалены из ДНК или белка, чтобы избежать заражения экспериментов и избежать токсичности продуктов, произведенных с использованием промышленная ферментация.[49]
Также, овальбумин часто содержит эндотоксины. Яичный альбумин является одним из тщательно изученных белков на животных моделях, а также установленным модельным аллергеном гиперчувствительности дыхательных путей (AHR). Коммерчески доступный овальбумин, загрязненный LPS, может полностью активировать эндотелиальные клетки в тесте in vitro на первой стадии воспаления и фальсифицирует результаты исследований, так как не точно отражает влияние единственного белкового антигена на физиологию животных.[нужна цитата ]
В фармацевтическом производстве необходимо удалить все следы эндотоксина из контейнеров с лекарственными препаратами, так как даже небольшое количество эндотоксина может вызвать заболевание у человека. А депирогенизация Для этого используется духовка. Для разложения этого вещества требуется температура выше 300 ° C. Определенная скорость снижения эндотоксина - это зависимость между временем и температурой. Исходя из первичного упаковочного материала, такого как шприцы или флаконы, температура стекла 250 ° C и время выдержки 30 минут являются типичными для достижения снижения уровня эндотоксинов в 1000 раз.[50]
Стандарт проба для определения наличия эндотоксина - это Лизат амебоцитов Limulus (LAL) анализ с использованием крови из Подковообразный краб (Лимулус полифем).[51] Очень низкие уровни ЛПС могут вызывать коагуляцию лизата лимулуса из-за мощного усиления ферментативного каскада. Однако из-за сокращающейся популяции подковообразных крабов и того факта, что существуют факторы, мешающие анализу LAL, были предприняты усилия по разработке альтернативных анализов, среди которых наиболее многообещающими являются: ELISA тесты с использованием рекомбинантный версия белка в анализе LAL, фактор C.[52]
Смотрите также
Рекомендации
- ^ Parija SC (1 января 2009 г.). Учебник микробиологии и иммунологии. Индия: Эльзевир. ISBN 978-8131221631.
- ^ Кулп А, Куэн MJ (2010). «Биологические функции и биогенез секретируемых бактериальных пузырьков наружной мембраны». Анну. Rev. Microbiol. 64: 163–84. Дои:10.1146 / annurev.micro.091208.073413. ЧВК 3525469. PMID 20825345.
- ^ Rietschel ET, Kirikae T, Schade FU, Mamat U, Schmidt G, Loppnow H, Ulmer AJ, Zähringer U, Seydel U, Di Padova F (1994). «Бактериальный эндотоксин: молекулярные отношения структуры к активности и функции». FASEB J. 8 (2): 217–25. Дои:10.1096 / fasebj.8.2.8119492. PMID 8119492.
- ^ Чжан Г., Мередит Т.К., Кане Д. (2013). «О важности липополисахарида для грамотрицательных бактерий». Curr. Мнение. Микробиол. 16 (6): 779–785. Дои:10.1016 / j.mib.2013.09.007. ЧВК 3974409. PMID 24148302.
- ^ Раец CR, Уитфилд С. (2002). «Липополисахаридные эндотоксины». Анну. Преподобный Biochem. 71: 635–700. Дои:10.1146 / annurev.biochem.71.110601.135414. ЧВК 2569852. PMID 12045108.
- ^ Риттиг М.Г., Кауфманн А., Робинс А., Шоу Б., Шпренгер Х., Гемза Д., Фулонг В., Руо Б., Дорнанд Дж. (2003). «Гладкие и грубые липополисахаридные фенотипы Brucella вызывают различный внутриклеточный трафик и высвобождение цитокинов / хемокинов в моноцитах человека». J. Leukoc. Биол. 74 (6): 1045–55. Дои:10.1189 / jlb.0103015. PMID 12960272.
- ^ Цудзимото Х, Гото Н, Нишино Т (1999). «Распространение макролидных антибиотиков через наружную мембрану Moraxella catarrhalis». J. Infect. Chemother. 5 (4): 196–200. Дои:10.1007 / с101560050034. PMID 11810516.
- ^ Хершбергер С., Бинкли С.Б. (1968). «Химия и метаболизм 3-дезокси-D-маннооктулозоновой кислоты. I. Стереохимическое определение». J. Biol. Chem. 243 (7): 1578–84. PMID 4296687.
- ^ Ценг Ю.Л., Датта А., Колли В.К., Карлсон Р.В., Стивенс Д.С. (май 2002 г.). «Эндотоксин Neisseria meningitidis, состоящий только из интактного липида А: инактивация менингококковой трансферазы 3-дезокси-D-маннооктулозоновой кислоты». J. Bacteriol. 184 (9): 2379–88. Дои:10.1128 / JB.184.9.2379-2388.2002. ЧВК 134985. PMID 11948150.
- ^ Khan, Mohd M .; Эрнст, Орна; Солнце, Цзин; Fraser, Iain D.C .; Эрнст, Роберт К .; Гудлетт, Дэвид Р .; Нита-Лазарь, Александра (24 июня 2018 г.). "Структурный анализ на основе масс-спектрометрии и стратегии системной иммунопротеомики для расшифровки ответа хозяина на эндотоксин". Журнал молекулярной биологии. 430 (17): 2641–2660. Дои:10.1016 / j.jmb.2018.06.032. ISSN 1089-8638. PMID 29949751.
- ^ а б c d е ж грамм час я j k л м п Моран А.П., Прендергаст М.М., Аппельмелк Б.Дж. (1996). «Молекулярная мимикрия структур хозяина бактериальными липополисахаридами и ее вклад в заболевание». ФЭМС Иммунол. Med. Микробиол. 16 (2): 105–15. Дои:10.1016 / s0928-8244 (96) 00072-7. PMID 8988391. В архиве из оригинала от 23 сентября 2016 г.
- ^ а б c d Килар А., Дёрний А., Кочиш Б. (2013). «Структурная характеристика бактериальных липополисахаридов с помощью масс-спектрометрии и методов разделения в режиме реального времени и в автономном режиме». Масс-спектрометр Rev. 32 (2): 90–117. Bibcode:2013MSRv ... 32 ... 90 тыс.. Дои:10.1002 / mas.21352. PMID 23165926.
- ^ Манфорд Р., Лу М., Варлей А.В. (2009). Убить бактерии ... а также их посланников?. Достижения в иммунологии. 103. С. 29–48. Дои:10.1016 / S0065-2776 (09) 03002-8. ISBN 9780123748324. ЧВК 2812913. PMID 19755182.
- ^ Ван X, Куинн П.Дж. (2010). «Липополисахарид: биосинтетический путь и модификация структуры». Прог. Липидный Res. 49 (2): 97–107. Дои:10.1016 / j.plipres.2009.06.002. PMID 19815028.
- ^ Руис Н., Кане Д., Силхави Т.Дж. (2009). «Транспорт липополисахаридов через клеточную оболочку: долгий путь открытий». Nat. Rev. Microbiol. 7 (9): 677–83. Дои:10.1038 / nrmicro2184. ЧВК 2790178. PMID 19633680.
- ^ Аббас, Абул (2006). Основы иммунологии. Эльзевир. ISBN 978-1-4160-2974-8.
- ^ Стюарт I, Шлютер П.Дж., Шоу Г.Р. (2006). «Цианобактериальные липополисахариды и здоровье человека - обзор». Здоровье окружающей среды. 5: 7. Дои:10.1186 / 1476-069X-5-7. ЧВК 1489932. PMID 16563160.
- ^ Уоррен Х.С., Фиттинг С, Хофф Э., Адиб-Конки М., Бизли-Топлифф Л., Тесини Б., Лян Х, Валентайн С., Хеллман Дж., Хайден Д., Кавайон Дж. М. (2010). «Устойчивость к бактериальной инфекции: различие между видами может быть связано с белками в сыворотке». J. Infect. Дис. 201 (2): 223–32. Дои:10.1086/649557. ЧВК 2798011. PMID 20001600.
- ^ Рид Р.Р., Продеус А.П., Хан В., Сюй Т., Розен Ф.С., Кэрролл М.С. (1997). «Эндотоксиновый шок у мышей с дефицитом антител: выяснение роли природных антител и комплемента в клиренсе липополисахарида». J. Immunol. 159 (2): 970–5. PMID 9218618.
- ^ Бос М., Продеус А.П., Шмидт Т., Кэрролл М.С., Чен Дж. (1998). «Важнейшая роль природного иммуноглобулина М в немедленной защите от системной бактериальной инфекции». J. Exp. Med. 188 (12): 2381–6. Дои:10.1084 / jem.188.12.2381. ЧВК 2212438. PMID 9858525.
- ^ Саид Э.А., Дюпюи Ф.П., Траутманн Л., Чжан Й., Ши Й., Эль-Фар М, Хилл Б.Дж., Ното А, Анкута П., Перец Й., Фонсека С.Г., Ван Гревенинге Дж., Буласель М.Р., Бруно Дж., Шукри Н.Х., Роути Дж. , Douek DC, Haddad EK, Sekaly RP (2010). «Вызванная запрограммированной смертью-1 продукция интерлейкина-10 моноцитами снижает активацию CD4 + Т-клеток во время ВИЧ-инфекции». Nat. Med. 16 (4): 452–9. Дои:10,1038 / нм. 2106. ЧВК 4229134. PMID 20208540.
- ^ Бейтс JM, Akerlund J, Mittge E, Guillemin K (2007). «Щелочная фосфатаза кишечника детоксифицирует липополисахариды и предотвращает воспаление у рыбок данио в ответ на кишечную микробиоту». Клеточный хозяин и микроб. 2 (6): 371–382. Дои:10.1016 / j.chom.2007.10.010. ЧВК 2730374. PMID 18078689.
- ^ Алам С.Н., Яммин Х., Моавен О, Ахмед Р., Мосс А. К., Бисвас Б., Мухаммад Н., Бисвас Р., Райчоудхури А., Калианнан К., Гош С., Рэй М., Хамарнех С. Р., Баруа С., Мало Н. С., Бхан А. К., Мало М.С. , Ходин Р.А. (апрель 2014 г.). «Кишечная щелочная фосфатаза предотвращает индуцированную антибиотиками чувствительность к кишечным патогенам». Анналы хирургии. 259 (4): 715–22. Дои:10.1097 / sla.0b013e31828fae14. ЧВК 3855644. PMID 23598380.
- ^ Lallès JP (февраль 2014 г.). «Кишечная щелочная фосфатаза: новые функции и защитные эффекты». Отзывы о питании. 72 (2): 82–94. Дои:10.1111 / nure.12082. PMID 24506153.
- ^ Полторак А, Хе Икс, Смирнова И., Лю М.Ю., Ван Хаффель С., Дю Икс, Бердвелл Д., Алехос Э., Сильва М., Галанос С., Фройденберг М., Риккарди-Кастаньоли П., Лейтон Б., Бейтлер Б. (1998). «Нарушение передачи сигналов LPS у мышей C3H / HeJ и C57BL / 10ScCr: мутации в гене Tlr4». Наука. 282 (5396): 2085–8. Bibcode:1998Научный ... 282.2085П. Дои:10.1126 / science.282.5396.2085. PMID 9851930.
- ^ «Нобелевская премия по физиологии и медицине 2011 года - пресс-релиз». www.nobelprize.org. В архиве из оригинала 23 марта 2018 г.. Получено 28 апреля 2018.
- ^ а б Честейн Э.М., Миллер С.Д. (2012). «Молекулярная мимикрия как пусковой механизм аутоиммунного демиелинизирующего заболевания ЦНС». Иммунол. Rev. 245 (1): 227–38. Дои:10.1111 / j.1600-065X.2011.01076.x. ЧВК 3586283. PMID 22168423.
- ^ Такидзава, Хитоши; Фрич, Кристин; Ковтонюк, Лариса В .; Сайто, Ясуюки; Яккала, Чакрадхар; Джейкобс, Курт; Ахуджа, Акшай К .; Лопес, Массимо; Хаусманн, Анника (3 августа 2017 г.). «Индуцированная патогенами передача врожденных иммунных сигналов TLR4-TRIF в гемопоэтических стволовых клетках способствует пролиферации, но снижает конкурентоспособность». Стволовая клетка. 21 (2): 225–240.e5. Дои:10.1016 / j.stem.2017.06.013. ISSN 1875-9777. PMID 28736216.
- ^ Netea MG, van Deuren M, Kullberg BJ, Cavaillon JM, Van der Meer JW (2002). «Определяет ли форма липида А взаимодействие ЛПС с Toll-подобными рецепторами?». Тенденции Иммунол. 23 (3): 135–9. Дои:10.1016 / S1471-4906 (01) 02169-X. PMID 11864841.
- ^ Сейдел Ю., Оикава М., Фукасе К., Кусумото С., Бранденбург К. (2000). «Внутренняя конформация липида А отвечает за агонистическую и антагонистическую активность». Евро. J. Biochem. 267 (10): 3032–9. Дои:10.1046 / j.1432-1033.2000.01326.x. PMID 10806403.
- ^ Ривз П.П., Ван Л. (2002). Геномная организация LPS-специфических локусов. Curr. Вершина. Microbiol. Иммунол. Актуальные темы микробиологии и иммунологии. 264. С. 109–35. Дои:10.1007/978-3-642-56031-6_7. ISBN 978-3-540-42682-0. PMID 12014174.
- ^ Патил ПБ, Сонти Р.В. (2004). «Вариация, указывающая на горизонтальный перенос генов в липополисахаридном (lps) биосинтетическом локусе в Xanthomonas oryzae pv. Oryzae, возбудителе бактериального фитофтороза риса». BMC Microbiol. 4: 40. Дои:10.1186/1471-2180-4-40. ЧВК 524487. PMID 15473911.
- ^ а б c d е Ямасаки Р., Кервуд Д.Е., Шнайдер Х., Куинн К.П., Гриффисс Дж.М., Мандрелл Р.Э. (1994). «Структура липоолигосахарида, продуцируемого Neisseria gonorrhoeae, штамм 15253, выделенный от пациента с диссеминированной инфекцией. Доказательства нового пути гликозилирования гонококкового липоолигосахарида». J. Biol. Chem. 269 (48): 30345–51. PMID 7982947.
- ^ Говард MD, Кокс А.Д., Вайзер Дж. Н., Шуриг Г. Г., Инзана Т. Дж. (2000). «Антигенное разнообразие липоолигосахарида Haemophilus somnus: доступность фосфорилхолинового эпитопа с переменной фазой». J. Clin. Микробиол. 38 (12): 4412–9. Дои:10.1128 / JCM.38.12.4412-4419.2000. ЧВК 87614. PMID 11101573.
- ^ Боонен, Бретт; Альпизар, Йеранди; Месегер, Виктор; Талавера, Карел; Боонен, Бретт; Alpizar, Yeranddy A .; Meseguer, Victor M .; Талавера, Карел (11 августа 2018 г.). «Каналы TRP как сенсоры бактериальных эндотоксинов». Токсины. 10 (8): 326. Дои:10.3390 / токсины 10080326. ЧВК 6115757. PMID 30103489.
- ^ Месегер, Виктор; Alpizar, Yeranddy A .; Луис, Енох; Таджада, Сендоа; Денлингер, Бристоль; Фахардо, Отто; Маненшейн, Ян-Альберт; Фернандес-Пенья, Карлос; Талавера, Артуро; Кичко, Татьяна; Навиа, Белен; Санчес, Алисия; Сеньярис, Роза; Ри, Питер; Перес-Гарсия, Мария Тереза; Лопес-Лопес, Хосе Рамон; Воетс, Томас; Бельмонте, Карлос; Талавера, Карел; Виана, Феликс (20 января 2014 г.). «Каналы TRPA1 опосредуют острое нейрогенное воспаление и боль, вызванные бактериальными эндотоксинами». Nature Communications. 5: 3125. Bibcode:2014НатКо ... 5,3125 млн. Дои:10.1038 / ncomms4125. ЧВК 3905718. PMID 24445575.
- ^ Солдано, Алессия; Альпизар, Ерандди А; Боонен, Бретт; Франко, Луис; Лопес-Рекена, Алехандро; Лю, Гуанда; Мора, Наталья; Якси, Эмре; Воетс, Томас; Веннекенс, Руди; Hassan, Bassem A; Талавера, Карел (14 июня 2016 г.). "Опосредованное вкусом избегание бактериальных липополисахаридов посредством активации TRPA1 у дрозофилы". eLife. 5. Дои:10.7554 / eLife.13133. ЧВК 4907694. PMID 27296646.
- ^ Боонен, Бретт; Alpizar, Yeranddy A .; Санчес, Алисия; Лопес-Рекена, Алехандро; Воетс, Томас; Талавера, Карел (июль 2018 г.). «Дифференциальные эффекты липополисахарида на сенсорных TRP-каналах мыши». Клеточный кальций. 73: 72–81. Дои:10.1016 / j.ceca.2018.04.004. PMID 29689522.
- ^ Alpizar, Yeranddy A .; Боонен, Бретт; Санчес, Алисия; Юнг, Кэрол; Лопес-Рекена, Алехандро; Naert, Робби; Стилант, Брехт; Луйц, Катриен; Плата, Кристина; Де Воогт, Ванесса; Vanoirbeek, Jeroen A. J .; Meseguer, Victor M .; Воетс, Томас; Альварес, Хулио Л .; Хеллингс, Питер В .; Hoet, Peter H.M .; Немери, Бенуа; Вальверде, Мигель А .; Талавера, Карел (20 октября 2017 г.). «Активация TRPV4 запускает защитные реакции на бактериальные липополисахариды в эпителиальных клетках дыхательных путей». Nature Communications. 8 (1): 1059. Bibcode:2017НатКо ... 8.1059A. Дои:10.1038 / s41467-017-01201-3. ЧВК 5651912. PMID 29057902.
- ^ Опал С.М. (2010). Эндотоксины и другие триггеры сепсиса. Contrib Nephrol. Вклад в нефрологию. 167. С. 14–24. Дои:10.1159/000315915. ISBN 978-3-8055-9484-4. PMID 20519895.
- ^ Ceccanti M, Attili A, Balducci G, Attilia F, Giacomelli S, Rotondo C, Sasso GF, Xirouchakis E, Attilia ML (2006). «Острый алкогольный гепатит». J. Clin. Гастроэнтерол. 40 (9): 833–41. Дои:10.1097 / 01.mcg.0000225570.04773.5d. PMID 17016141.
- ^ Parlesak A, Schäfer C, Schütz T, Bode JC, Bode C (2000). «Повышенная проницаемость кишечника для макромолекул и эндотоксемия у пациентов с хроническим злоупотреблением алкоголем на различных стадиях алкогольной болезни печени». J. Hepatol. 32 (5): 742–7. Дои:10.1016 / S0168-8278 (00) 80242-1. PMID 10845660.
- ^ а б c Стивенс Д.С., Гринвуд Б., Брандтзаег П. (2007). «Эпидемический менингит, менингококкемия и Neisseria meningitidis». Ланцет. 369 (9580): 2196–210. Дои:10.1016 / S0140-6736 (07) 61016-2. PMID 17604802.
- ^ Морено-Наваррете Дж. М., Ортега Ф, Серино М., Люче Э, Вагет А., Пардо Дж., Сальвадор Дж., Рикарт В., Фрюбек Г., Бурселин Р., Фернандес-Реаль Дж. М. (2012) «Циркулирующий липополисахарид-связывающий белок (LBP) как маркер инсулинорезистентности, связанной с ожирением». Int J Obes (Лондон). 36 (11): 1442–9. Дои:10.1038 / ijo.2011.256. PMID 22184060.
- ^ Lepper PM, Schumann C, Triantafilou K, Rasche FM, Schuster T., Frank H, Schneider EM, Triantafilou M, von Eynatten M (2007). «Ассоциация липополисахарид-связывающего белка и ишемической болезни сердца у мужчин». Варенье. Coll. Кардиол. 50 (1): 25–31. Дои:10.1016 / j.jacc.2007.02.070. PMID 17601541.
- ^ Ruiz AG, Casafont F, Crespo J, Cayón A, Mayorga M, Estebanez A, Fernadez-Escalante JC, Pons-Romero F (2007). «Уровни липополисахарид-связывающего белка в плазме и экспрессия гена TNF-альфа в печени у пациентов с ожирением: доказательства потенциальной роли эндотоксина в патогенезе неалкогольного стеатогепатита». Obes Surg. 17 (10): 1374–80. Дои:10.1007 / s11695-007-9243-7. PMID 18000721.
- ^ а б Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C, Waget A, Delmée E, Cousin B, Sulpice T, Chamontin B, Ferrières J, Tanti JF , Гибсон Г.Р., Кастейла Л., Дельзенн Н.М., Алесси М.К., Бурселин Р. (2007). «Метаболическая эндотоксемия вызывает ожирение и инсулинорезистентность». Сахарный диабет. 56 (7): 1761–72. Дои:10.2337 / db06-1491. PMID 17456850.
- ^ Фэй Н., Чжао Л. (декабрь 2012 г.). «Условно-патогенный микроорганизм, выделенный из кишечника человека с ожирением, вызывает ожирение у беспроблемных мышей». ISME J. 7 (4): 880–4. Дои:10.1038 / ismej.2012.153. ЧВК 3603399. PMID 23235292.
- ^ Уикс, Ян П .; Howell, Meredith L .; Хэнкок, вторник; Косака, Хитоши; Олее, Цайвэй; Карсон, Деннис А. (март 1995 г.). «Бактериальный липополисахарид коочистится с плазмидной ДНК: последствия для животных моделей и генной терапии человека». Генная терапия человека. 6 (3): 317–323. Дои:10.1089 / гл.1995.6.3-317. PMID 7779915.
- ^ 16 декабря 2014 г. «Обнаружение эндотоксинов с помощью теста LAL, хромогенный метод». Архивировано из оригинал 29 марта 2015 г.. Получено 14 марта 2015.
- ^ Иванага S (2007). «Биохимический принцип теста Limulus для определения бактериальных эндотоксинов». Proc. Jpn. Акад., Сер. B, Phys. Биол. Наука. 83 (4): 110–9. Bibcode:2007PJAB ... 83..110I. Дои:10.2183 / pjab.83.110. ЧВК 3756735. PMID 24019589.
- ^ Дин Дж. Л., Хо Б. (2001). «Новая эра в тестировании пирогенов» (PDF). Тенденции биотехнологии. 19 (8): 277–81. Дои:10.1016 / s0167-7799 (01) 01694-8. PMID 11451451. Архивировано из оригинал (PDF) 2 января 2014 г.. Получено 2 января 2014.
внешняя ссылка
- Липополисахариды в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)