Калиевый канал, активируемый кальцием - Calcium-activated potassium channel
Эта статья включает в себя список общих Рекомендации, но он остается в основном непроверенным, потому что ему не хватает соответствующих встроенные цитаты. (Август 2018 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Калиевые каналы, активируемые кальцием калиевые каналы, управляемые кальцием,[1] или которые структурно или филогенетически связаны с каналами, управляемыми кальцием. Впервые они были обнаружены в 1958 году Гардосом, который увидел, что уровни кальция внутри клетки могут влиять на проницаемость калия через клеточную мембрану. Затем в 1970 году Мич был первым, кто заметил, что внутриклеточный кальций может запускать калиевые токи. У человека они делятся на три подтипа: каналы с большой проводимостью или BK, которые имеют очень высокую проводимость от 100 до 300 пСм, промежуточную проводимость или IK-каналы с промежуточной проводимостью от 25 до 100 пСм и малую проводимость или SK-каналы с небольшой проводимостью от 2 до 25 пс.[2]
Это семейство ионных каналов, по большей части, активируется внутриклеточным Ca2+ и содержит 8 членов в геноме человека. Однако некоторые из этих каналов (KCa4 и КCa5 каналов) вместо этого реагируют на другие внутриклеточные лиганды, такие как Na+, Cl−, и pH. Кроме того, несколько членов семейства являются как лигандами, так и Напряжение активирован, что еще больше усложняет описание этого семейства. KCa субъединицы канала α имеют шесть или семь трансмембранный сегменты, похожие на KV каналы но иногда с дополнительной N-концевой трансмембранной спиралью. Субъединицы α образуют гомо- и гетеротетрамерные комплексы. Кальций-связывающий домен может содержаться в последовательности субъединицы α, как в KCa1, или может происходить через дополнительный связывающий кальций белок, такой как кальмодулин.
Структура
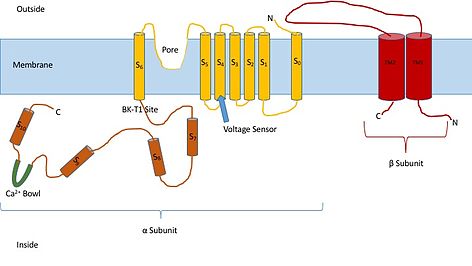
Знание структуры этих каналов может дать представление об их функции и механизме стробирования. Они состоят из двух разных субъединиц: альфа и бета. Альфа-субъединица представляет собой тетрамер, который образует поры, датчик напряжения и область, чувствительную к кальцию. Эта субъединица канала состоит из семи трансмембранных единиц и большой внутриклеточной области. Датчик напряжения выполнен трансмембранной областью S4, имеющей несколько Аргинин остатки, которые действуют так, чтобы «ощущать» изменения заряда и перемещаться таким же образом, как и другие калиевые каналы, управляемые напряжением. Когда они двигаются в ответ на изменения напряжения, они открывают и закрывают ворота. Линкер между областями S5 и S6 служит для образования пор канала. Внутри клетки стоит обратить внимание на чашу из кальция. Считается, что эта чаша является местом связывания кальция.[3]
Считается, что бета-субъединица канала является регуляторной субъединицей канала. Существует четыре различных типа бета-субъединицы: 1, 2, 3 и 4. Бета 2 и 3 являются ингибирующими, а бета 1 и 4 - возбуждающими или заставляют канал быть более открытым, чем закрытым. Возбуждающие бета-субъединицы влияют на альфа-субъединицы таким образом, что канал редко инактивируется.[4]
Классификация и описание гомологий
Человек KCa каналы
Ниже приведен список из 8 известных кальций-активируемых калиевых каналов человека, сгруппированных в соответствии с гомологией последовательностей трансмембранных гидрофобных ядер:[5]
Канал ВК
Хотя это не подразумевается в названии, но подразумевается структурой, эти каналы также могут быть активированы напряжением. Считается, что различные способы активации в этих каналах независимы друг от друга. Эта особенность канала позволяет им участвовать во многих различных физиологических функциях. Физиологические эффекты BK-каналов широко изучались с использованием нокаут-мышей. При этом наблюдались изменения в кровеносных сосудах мышей. У животных без ВК-каналов наблюдалось повышение среднего артериального давления и тонуса сосудов. Эти данные показывают, что каналы BK участвуют в расслаблении гладкомышечных клеток. В любой мышечной клетке повышенный уровень внутриклеточного кальция вызывает сокращение. В гладкомышечных клетках повышенный уровень внутриклеточного кальция вызывает открытие каналов ВК, которые, в свою очередь, позволяют ионам калия выходить из клетки. Это вызывает дальнейшую гиперполяризацию и закрытие потенциалозависимых кальциевых каналов, после чего может произойти релаксация. Мыши с нокаутом также испытали интенционный тремор, меньшую длину шага и меньшую скорость плавания. Все это симптомы атаксия, указывая на то, что каналы BK очень важны в мозжечке.[6]
Подтипы BK каналов
ИК канал
Каналы промежуточной проводимости кажутся наименее изученными из всех каналов. Считается, что структурно они очень похожи на каналы BK с основными различиями в проводимости и методах модуляции. Известно, что каналы IK модулируются кальмодулином, тогда как каналы BK - нет.
Каналы ИК показали сильную связь с кальцификацией в сосудистой сети, поскольку ингибирование канала вызывает уменьшение кальцификации сосудов. Чрезмерная экспрессия этих каналов совершенно по-разному влияет на организм. Исследования показали, что это лечение вызывает разрастание гладкомышечных клеток сосудов. Это открытие вызвало дальнейшие исследования этих каналов, и исследователи обнаружили, что каналы IK регулируют клеточный цикл в раковых клетках, В- и Т-лимфоцитах, а также стволовых клетках. Эти открытия обещают будущие методы лечения IK-каналов.
Подтипы ИК-каналов
SK канал
Кальций с небольшой проводимостью активирует калиевые каналы, которые сильно отличаются от своих родственников с большей проводимостью. Основное и самое интересное отличие каналов SK в том, что они нечувствительны к напряжению. Эти каналы могут быть открыты только при повышенном уровне внутриклеточного кальция. Эта особенность каналов SK предполагает, что они имеют немного другую структуру, чем каналы BK и IK.
Как и другие калиевые каналы, они участвуют в гиперполяризации клеток после потенциала действия. Способность этих каналов активировать кальций позволяет им участвовать в вазорегуляции, слуховой настройке волосковых клеток, а также в циркадном ритме. Исследователи пытались выяснить, какие каналы ответственны за реполяризацию и постгиперполяризацию потенциалов действия. Они сделали это путем фиксации напряжения на ячейках, обработки их различными блокаторами каналов BK и SK, а затем стимулирования ячейки для создания тока. Исследователи обнаружили, что переполяризация клеток происходит из-за каналов BK и что часть постгиперполяризации происходит из-за тока через каналы SK. Они также обнаружили, что при блокировании каналов SK ток во время постгиперполяризации все еще имеет место. Был сделан вывод, что существует другой неизвестный тип калиевого канала, допускающий эти токи.[7]
Понятно, что в МАИ задействованы каналы СК. Непонятно, как именно это происходит. Есть три разных идеи, как это сделать. 1) Простая диффузия кальция объясняет медленную кинетику этих токов, 2) Медленная кинетика возникает из-за других каналов с медленной активацией, или 3) Кальций просто активирует систему вторичных мессенджеров для активации каналов SK. Было показано, что простая диффузия является маловероятным механизмом, поскольку ток чувствителен к температуре, а диффузионный механизм не будет чувствительным к температуре. Это также маловероятно, потому что с концентрацией кальция изменяется только амплитуда тока, а не кинетика активации канала.
Подтипы SK каналов
Другие подсемейства
Прокариотический КCa каналы
Номер прокариотический KCa каналы описаны как структурно, так и функционально. Все они управляются кальцием или другими лигандами и являются гомолог к человеку KCa каналы, в частности KCa1.1 стробирования кольцо. Эти структуры служили шаблонами для лигандного стробирования.
| Протеин | Разновидность | Лиганд | Функция | Ссылка |
|---|---|---|---|---|
| Кч | кишечная палочка | Неизвестный | Канал | [8][9] |
| MthK | Methanothermobacter thermautotrophicus | Кальций, Кадмий, Барий, pH | Канал | [10][11][12][13][14] |
| TrkA / TrkH | Вибрион парагемолитический | АТФ, ADP | Канал | [15][16] |
| KtrAB | Bacillus subtilis | АТФ, АДФ | Транспортер | [17] |
| GsuK | Геобактер серы | Кальций, АДФ, НАД | Канал | [18] |
| TM1088 | Thermotoga maritima | Неизвестный | Неизвестный | [19] |
Смотрите также
Рекомендации
- ^ Vergara, C .; Latorre, R .; Marrion, N.V .; Адельман, Дж. П. (1998). «Калиевые каналы, активируемые кальцием». Текущее мнение в нейробиологии. 8 (3): 321–329. Дои:10.1016 / s0959-4388 (98) 80056-1. ISSN 0959-4388. PMID 9687354.
- ^ УИВЕР, ЭМИ К .; БОМБЕНА, ВАЛЕРИ С .; СОНТЕЙМЕР, ХАРАЛЬД (15 августа 2006 г.). «Экспрессия и функция активированных кальцием калиевых каналов в клетках глиомы человека». Глия. 54 (3): 223–233. Дои:10.1002 / glia.20364. ISSN 0894-1491. ЧВК 2562223. PMID 16817201.
- ^ Гхатта, Шринивас; Ниммагадда, Дипти; Сюй, Сяопин; О'Рурк, Стивен Т. (01.04.2006). «Активированные кальцием калиевые каналы с большой проводимостью: структурные и функциональные последствия». Фармакология и терапия. 110 (1): 103–116. Дои:10.1016 / j.pharmthera.2005.10.007. PMID 16356551.
- ^ "Калиевые каналы, активируемые кальцием и натрием | Введение | Руководство по ФАРМАКОЛОГИИ BPS / IUPHAR". www.guidetopharmacology.org. Получено 2019-04-22.
- ^ Вей А.Д., Гутман Г.А., Олдрич Р., Чанди К.Г., Гриссмер С., Вульф Х. (декабрь 2005 г.). "Международный союз фармакологии. LII. Номенклатура и молекулярные взаимоотношения кальций-активированных калиевых каналов". Фармакологические обзоры. 57 (4): 463–72. Дои:10.1124 / пр.57.4.9. PMID 16382103. S2CID 8290401.
- ^ Бреннер, Р. (2000). «Клонирование и функциональная характеристика новых бета-субъединиц кальций-активируемых калиевых каналов с большой проводимостью, hKCNMB3 и hKCNMB4». J Biol Chem. 275 (9): 6453–6461. Дои:10.1074 / jbc.275.9.6453. PMID 10692449.
- ^ Сах, Панкадж (1996). «Ca2 + активированные токи K + в нейронах: типы, физиологические роли и модуляция». Тенденции в неврологии. 19 (4): 150–154. Дои:10.1016 / s0166-2236 (96) 80026-9. PMID 8658599.
- ^ Milkman R (апрель 1994). «Гомолог Escherichia coli белков эукариотических калиевых каналов». Труды Национальной академии наук Соединенных Штатов Америки. 91 (9): 3510–4. Bibcode:1994ПНАС ... 91.3510М. Дои:10.1073 / пнас.91.9.3510. ЧВК 43609. PMID 8170937.
- ^ Цзян Ю., Пико А., Каден М., Чайт Б.Т., Маккиннон Р. (март 2001 г.). «Структура домена RCK из K + канала E. coli и демонстрация его присутствия в BK-канале человека». Нейрон. 29 (3): 593–601. Дои:10.1016 / s0896-6273 (01) 00236-7. PMID 11301020.
- ^ Цзян Ю., Ли А., Чен Дж., Каден М., Чайт Б.Т., Маккиннон Р. (май 2002 г.). «Кристаллическая структура и механизм кальциевого калиевого канала». Природа. 417 (6888): 515–22. Bibcode:2002Натура.417..515J. Дои:10.1038 / 417515a. PMID 12037559.
- ^ Смит Ф.Дж., По В.П., Чинголани Дж., Ротберг Б.С. (2013). «Структурная основа аллостерических взаимодействий между Са2 + -связывающими сайтами в домене RCK K + канала». Nature Communications. 4: 2621. Bibcode:2013НатКо ... 4.2621S. Дои:10.1038 / ncomms3621. PMID 24126388.
- ^ Е С, Ли И, Чен Л., Цзян И (сентябрь 2006 г.). «Кристаллические структуры безлигандного стробирующего кольца MthK: понимание механизма стробирования лигандов K + каналов». Клетка. 126 (6): 1161–73. Дои:10.1016 / j.cell.2006.08.029. PMID 16990139.
- ^ Dvir H, Valera E, Choe S (август 2010 г.). «Структура MthK RCK в комплексе с кадмием». Журнал структурной биологии. 171 (2): 231–7. Дои:10.1016 / j.jsb.2010.03.020. ЧВК 2956275. PMID 20371380.
- ^ Смит Ф.Дж., По В.П., Чинголани Дж., Ротберг Б.С. (декабрь 2012 г.). «Кристаллическая структура затворного кольца, связанного с Ba (2 +), выявляет элементарные этапы активации домена RCK». Структура. 20 (12): 2038–47. Дои:10.1016 / j.str.2012.09.014. ЧВК 3518701. PMID 23085076.
- ^ Цао И, Джин Икс, Хуанг Х, Деребе М.Г., Левин Э.Д., Кабалисваран В., Пан И, Пунта М, Лав Дж., Вен Дж, Квик М, Йе С, Клосс Б., Бруни Р., Мартинес-Хакерт Э, Хендриксон В. Рост Б., Джавич Дж. А., Раджашанкар К. Р., Цзян Ю., Чжоу М. (март 2011 г.). «Кристаллическая структура переносчика ионов калия ТрхХ». Природа. 471 (7338): 336–40. Bibcode:2011Натура.471..336C. Дои:10.1038 / природа09731. ЧВК 3077569. PMID 21317882.
- ^ Цао И, Пан И, Хуан Х, Джин Х, Левин Э. Дж., Клосс Б., Чжоу М. (апрель 2013 г.). «Стробирование ионного канала TrkH с помощью связанного с ним белка RCK TrkA». Природа. 496 (7445): 317–22. Bibcode:2013Натура.496..317C. Дои:10.1038 / природа12056. ЧВК 3726529. PMID 23598339.
- ^ Vieira-Pires RS, Szollosi A, Morais-Cabral JH (апрель 2013 г.). «Строение транспортера калия KtrAB». Природа. 496 (7445): 323–8. Bibcode:2013Натура.496..323В. Дои:10.1038 / природа12055. HDL:10216/110345. PMID 23598340.
- ^ Kong C, Zeng W, Ye S, Chen L, Sauer DB, Lam Y, Derebe MG, Jiang Y (2012). «Отчетливые механизмы стробирования, выявленные структурами мультилигандного закрытого K (+) канала». eLife. 1: e00184. Дои:10.7554 / eLife.00184. ЧВК 3510474. PMID 23240087.
- ^ Деллер М.С., Джонсон Х.А., Миллер М.Д., Спраггон Дж., Эльслигер М.А., Уилсон И.А., Лесли С.А. (2015). «Кристаллическая структура двухсубъединичного октамерного затворного кольца TrkA». PLOS ONE. 10 (3): e0122512. Bibcode:2015PLoSO..1022512D. Дои:10.1371 / journal.pone.0122512. ЧВК 4380455. PMID 25826626.
внешняя ссылка
- Активированный кальцием + калий + каналы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- «Активированные кальцием калиевые каналы». База данных рецепторов и ионных каналов IUPHAR. Международный союз фундаментальной и клинической фармакологии.
