Мембранный липид - Membrane lipid
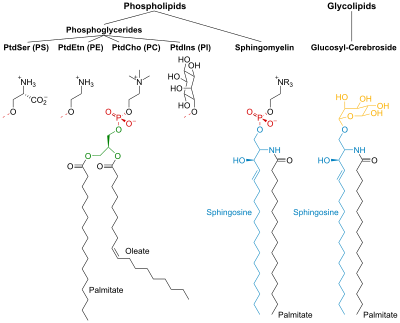
PtdCho - Фосфатидилхолин; PtdEtn - Фосфатидилэтаноламин; PtdIns - Фосфатидилинозитол; PtdSer - Фосфатидилсерин.
Мембранные липиды представляют собой группу соединений (структурно подобных жирам и маслам), которые образуют двухслойную поверхность всех клеток (липидный бислой ). Три основных класса мембран липиды находятся фосфолипиды, гликолипиды, и холестерин. Липиды амфифильные: у них есть один конец, растворимый в воде («полярный»), и конец, растворимый в жире («неполярный»). Путем формирования двойного слоя с полярными концами, направленными наружу, и неполярными концами, направленными внутрь, липиды мембран могут образовывать «липидный бислой», который удерживает водянистую внутреннюю часть клетки отдельно от водянистой наружной поверхности. Расположение липидов и различных белков, действующих как рецепторы и поры каналов в мембране, контролирует вход и выход других молекул и ионов как части метаболизма клетки. Чтобы выполнять физиологические функции, мембранные белки облегчают вращение и диффузию в боковом направлении в двумерном пространстве липидного бислоя благодаря наличию оболочки из липидов, тесно прикрепленной к поверхности белка, называемой кольцевая липидная оболочка.
Биологические роли
Двухслойный слой, образованный липидами мембраны, служит защитной единицей живой клетки. Мембранные липиды также образуют матрицу, в которой мембранные белки проживать. Исторически считалось, что липиды выполняли лишь структурную роль. На самом деле у липидов много функциональных ролей: они служат регуляторными агентами в рост клеток и адгезия. Они участвуют в биосинтез других биомолекулы. Они могут служить для увеличения ферментативной активности ферменты.[1]
Не двухслойный образующий липидоподобный моногалактозил диглицерид (MGDG) преобладает в массе липидов в тилакоид мембраны, которые при гидратации сами по себе образуют обратную гексагональную цилиндрическую фазу. Однако в сочетании с другими липидами и каротиноиды /хлорофиллы мембран тилакоидов, они также соответствуют друг другу как липидные бислои.[2]
Мембранный липидный язык
Мембрана метаболиты из полиненасыщенные жирные кислоты (ПНЖК) играют важную роль в межклеточных биохимических коммуникациях. Кроуфорд (2010) в его главе Длинноцепочечные полиненасыщенные жирные кислоты в эволюции мозга человека сообщил, что касается язык липидов, что важность повышенной сложности этих липидов была вызвана аэробный метаболизм, при этом простой язык прокариоты, состоящий всего из нескольких слов, был расширен до словаря из более чем 1000 слов эукариот клетки.
Около 500 миллионов лет назад некоторые нервные клетки и некоторые клетки кишечника позвоночных мигрировали и специализировались в более сложных условиях. нервная система: the мозг, а также в поглощении и хранении йодосоединений: фолликулярной щитовидная железа. В ПНЖК наличие двойная связь между двумя атомами углерода (или двойная связь углерод-углерод) дает им возможность изменять свою молекулярную структуру с помощью ферментов, таких как фосфолипазы, циклооксигеназы и липоксигеназы и др. Полученные вещества, получившие название эйкозаноиды: простагландины (PG), лейкотриены (LT), липоксины и тромбоксан (Техас); и докозаноиды: резолвины, протектины, и марезины, являются мощными липидными медиаторами, которые оказывают определенное действие в организме; они организуют воспаление, гемодинамический, иммунная реакция и восстановление тканей.
Многие ПНЖК не могут быть синтезированы животными организмами и считаются существенный, и поэтому должны быть включены в диеты. Это: линолевая кислота (C18: 2 n-6), омега-6 и альфа-линоленовая (C18: 3 n-3) омега-3, арахидоновая кислота (AA) - омега - 6 (C20: 4n-6) и докозагексаеновая кислота (ДГК) - Омега 3 (C22: 6n-3). Эти ПНЖК включены в фосфолипидную мембрану всех клеток организма. В параллели, эктодермический клетки дифференцированный в нейронный клетки, стали примитивной нервной системой и мозгом. Обе эти клетки синтезировали йодолипиды, как новые слова химического липидный язык развился среди клеточных мембран в процессе эволюции жизни. Эти биохимические сигналы между клетками, поскольку контакт и модификация мембран у многоклеточных организмов сформировали основы адаптации к земной среде, и их изменения важны в механизме апоптоз, канцерогенез и дегенеративные заболевания, а также для понимания некоторых обсуждаемых проблем, касающихся эволюция человека (в качестве Гипотеза водных обезьян ).[3][4][5][6][7]
Основные классы
Фосфолипиды
Фосфолипиды и гликолипиды состоят из двух длинных неполярных (гидрофобный ) углеводородные цепи связан с гидрофильный головная группа.
Головки фосфолипидов фосфорилированный и они состоят либо из:
- Глицерин (отсюда и название фосфоглицериды дано этой группе липидов), или
- Сфингозин (например. сфингомиелин и керамид ).
Тетраэфир диалкилглицерина глицерина (GDGT) помогает изучать древние факторы окружающей среды.[8]
Гликолипиды
Головки гликолипидов (гликолипиды - сахар) содержат сфингозин с одна или несколько единиц сахара прикреплен к нему. Гидрофобные цепи принадлежат к:
- два жирные кислоты (FA) - в случае фосфоглицеридов, или
- одна ЖК и углеводородный хвост сфингозина - в случае сфингомиелина и гликолипидов.
Галактолипиды - моногалактозилдиглицерид (MGDG) и дигалактозилдигликрерид (DGDG) образуют преобладающие липиды в мембранах тилакоидов хлоропластов высших растений; Липосомные структуры, образованные общим липидным экстрактом тилакоидных мембран, были чувствительны к сахарозе, поскольку она превращает бислои в мицеллярные структуры.[9]
Жирные кислоты
Жирные кислоты в фосфо- и гликолипидах обычно содержат четное число, обычно от 14 до 24, углерод атомы, с 16- и 18-углеродные самый распространенный. ЖК могут быть насыщенными или ненасыщенными, в зависимости от конфигурации двойные связи почти всегда СНГ. Длина и степень ненасыщенность цепей ТВС оказывают сильное влияние на текучесть мембран.Растение тилакоидные мембраны сохранять высокую текучесть даже при относительно низких температурах окружающей среды благодаря обилию 18-углеродных жирных ацильных цепей с тремя двойными связями, линоленовая кислота, как показали исследования ЯМР 13С.[10]
Фосфоглицериды
В фосфоглицериды, гидроксильные группы у C-1 и C-2 глицерина являются этерифицированный к карбоксил группы ФА. Гидроксильная группа C-3 этерифицируется с фосфорной кислотой. Полученное соединение, названное фосфатидат, самый простой фосфоглицерат. В мембранах присутствует лишь небольшое количество фосфатидата. Однако он является ключевым промежуточным звеном в биосинтезе других фосфоглицеридов.
Сфинголипиды
Сфингозин является аминоспирт который содержит длинный, ненасыщенный углеводородная цепь. В сфингомиелине и гликолипидах аминогруппа сфингозина связана с ЖК посредством амид связь. В сфингомиелине первичный гидроксил группа сфингозина этерифицирована до фосфорила холин.

В гликолипидах к этой группе относится сахарный компонент. Самый простой гликолипид - это цереброзид, в котором есть только один остаток сахара, либо Glc или же Гал. Более сложные гликолипиды, такие как ганглиозиды, содержат разветвленную цепь из семи сахарных остатков.
Стерины
Самый известный стерол является холестерин, который встречается у людей. Холестерин естественным образом встречается и у других эукариот. клеточные мембраны. Стерины имеют гидрофобную четырехчленную жесткую структуру с конденсированным кольцом и небольшую группу полярных головок.
Холестерин био синтезируется из мевалонат через циклизацию сквалена терпеноиды. Клеточные мембраны требуют высокого уровня холестерина - обычно в среднем 20% холестерина на всей мембране, локально увеличиваясь в областях рафтинга до 50% холестерина (-% - молекулярное соотношение).[11] Преимущественно ассоциируется с сфинголипиды (см. диаграмму) в богатых холестерином липидные рафты области мембран эукариотических клеток.[12] Образование липидных рафтов способствует агрегации периферических и трансмембранные белки включая стыковку SNARE и ВАМП белки.[13] Ложки, такие как ситостерин и стигмастерин, и гопаноиды выполняют аналогичную функцию у растений и прокариоты.
Смотрите также
Рекомендации
- ^ Р. Б. Геннис. Биомембраны - молекулярная структура и функция. Спрингер-Верлаг, Нью-Йорк (1989).
- ^ Яшрой Р.С. (1990) Пластинчатая дисперсия и фазовое разделение липидов хлоропластных мембран с помощью электронной микроскопии с отрицательным окрашиванием. Журнал биологических наук, т. 15 (2), стр. 93-98.https://www.researchgate.net/publication/230820037_Lamellar_dispersion_and_phase_separation_of_chloroplast_membrane_lipids_by_negative_staining_electron_microscopy?ev=prf_pub
- ^ Вентури, S .; Donati, F.M .; Вентури, А .; Вентури, М. (2000). «Дефицит йода в окружающей среде: вызов эволюции земной жизни?». Щитовидная железа. 10 (8): 727–9. Дои:10.1089/10507250050137851. PMID 11014322.
- ^ Crawford, M.A .; Блум, М .; Broadhurst, C.L .; Schmidt, W. F .; Cunnane, S.C .; Galli, C .; Gehbremeskel, K .; Linseisen, F .; Lloyd-Smith, J .; Паркингтон, Дж. (1999). «Доказательства уникальной функции докозагексаеновой кислоты во время эволюции мозга современного гоминида». Липиды. 34 Дополнение: S39 – S47. Дои:10.1007 / BF02562227. PMID 10419087. S2CID 4060454.
- ^ Вентури С., Бегин М.Э. (2010). "Гормон щитовидной железы, йод и эволюция человеческого мозга". В Cunnane S, Stewart K (ред.). Влияние окружающей среды на эволюцию человеческого мозга. Джон Уайли и сыновья. стр.105–124. ISBN 978-0-470-45268-4.
- ^ Кроуфорд MA (2010). «Длинноцепочечные полиненасыщенные жирные кислоты в эволюции человеческого мозга». В Cunnane S, Stewart K (ред.). Влияние окружающей среды на эволюцию человеческого мозга. Джон Уайли и сыновья. стр.13–32. ISBN 978-0-470-45268-4.
- ^ Вентури, Себастьяно (2014). «Йод, ПНЖК и йодолипиды в здоровье и болезнях: эволюционная перспектива». Эволюция человека-. 29 (1–3): 185–205. ISSN 0393-9375.
- ^ Вейерс; и другие. (2007). «Экологический контроль распределения липидов бактериальной тетраэфирной мембраны в почвах». Geochimica et Cosmochimica Acta. 71 (3): 703–713. Дои:10.1016 / j.gca.2006.10.003.
- ^ Яшрой Р.С. (1994) Дестабилизация ламеллярной дисперсии липидов тилакоидных мембран сахарозой. Biochimica et Biophysica Acta, т. 1212, с. 129-133.https://www.researchgate.net/publication/15042978_Destabilisation_of_lamellar_dispersion_of_thylakoid_membrane_lipids_by_sucrose?ev=prf_pub
- ^ Яшрой Р.С. (1987) 13-C ЯМР исследования липидных жирных ацильных цепей хлоропластных мембран. Индийский журнал биохимии и биофизики, т. 24 (6), стр. 177-178.https://www.researchgate.net/publication/230822408_13-C_NMR_studies_of_lipid_fatty_acyl_chains_of_chloroplast_membranes?ev=prf_pub
- ^ де Мейер Ф., Смит Б. Влияние холестерина на структуру фосфолипидного бислоя. Proc NatlAcad Sci U S A 2009; 106: 3654-8.
- ^ Чен, Хешун; Родилась, Элла; Mathur, Satya N .; Филд, Ф. Джеффри (1 декабря 1993 г.). «Синтезы холестерина и сфингомиелина регулируются независимо в культивируемых клетках кишечника человека, CaCo-2: роль мембранного холестерина и содержания сфингомиелина» (PDF). Журнал липидных исследований. Американское общество биохимии и молекулярной биологии. 34 (12): 2159–67. ISSN 0022-2275. PMID 8301234.
- ^ Lang T, Bruns D, Wenzel D, Riedel D, Holroyd P, Thiele C, Jahn R. SNARE сконцентрированы в холестерин-зависимых кластерах, которые определяют сайты стыковки и слияния для экзоцитоза EMBO J 2001; 20: 2202-13.
внешняя ссылка
- Мембрана + липиды в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
