Тилакоид - Thylakoid
| Клеточная биология | |
|---|---|
| В хлоропласт | |
 Компоненты типичного хлоропласта 1 Гранум 3 Тилакоид ◄ Вы здесь 4 Стромальный тилакоид |

Тилакоиды мембранные отсеки внутри хлоропласты и цианобактерии. Они являются местом светозависимые реакции из фотосинтез. Тилакоиды состоят из тилакоидная мембрана окружающий тилакоид просвет. Тилакоиды хлоропластов часто образуют стопки дисков, называемые грана (единственное число: гранум). Граны связаны между собой тилакоидами между зернами и стромой, которые объединяют стеки гранум в единый функциональный отсек.
Этимология
Слово Тилакоид исходит из Греческий слово тилакос что означает «мешок» или «мешочек».[1] Таким образом, тилакоид означает «подобный мешочку» или «подобный мешочку».
Структура



Тилакоиды - это мембранные структуры, встроенные в хлоропласт. строма. Стопка тилакоидов называется гранумом и напоминает стопку монет.
Мембрана
В тилакоидная мембрана это сайт светозависимые реакции фотосинтеза с фотосинтетические пигменты встроен непосредственно в мембрану. Это чередующийся узор из темных и светлых полос, каждая размером 1 нанометр.[3] Липидный бислой тилакоидов имеет общие черты с прокариотическими мембранами и внутренней хлоропластной мембраной. Например, кислые липиды могут быть обнаружены в мембранах тилакоидов, цианобактерий и других фотосинтезирующих бактерий и участвуют в функциональной целостности фотосистем.[4] Тилакоидные мембраны высших растений состоят в основном из фосфолипиды[5] и галактолипиды которые асимметрично расположены вдоль и поперек мембран.[6] Мембраны тилакоидов богаче галактолипидами, чем фосфолипидами; также они преимущественно состоят из гексагональной фазы II, образующей липид моногалактозилдиглицерида. Несмотря на этот уникальный состав, мембраны тилакоидов растений, как было показано, предполагают в значительной степени динамическую организацию липидного бислоя.[7] Липиды, образующие тилакоидные мембраны, наиболее богатые линоленовой кислотой с высокой текучестью.[8] синтезируются сложным путем, включающим обмен предшественниками липидов между эндоплазматический ретикулум и внутреннюю мембрану оболочки пластид, которая транспортируется от внутренней мембраны к тилакоидам через везикулы.[9]
Люмен
В просвет тилакоида представляет собой непрерывную водную фазу, окруженную тилакоидная мембрана. Он играет важную роль для фотофосфорилирование в течение фотосинтез. Во время светозависимой реакции протоны перекачиваются через тилакоидную мембрану в просвет, делая его кислым до pH 4.
Пластинки гранума и стромы
У высших растений тилакоиды организованы в сборку мембран гранум-строма. А гранум (множественное число грана) представляет собой стопку тилакоидных дисков. Хлоропласты могут иметь от 10 до 100 гран. Грана связаны тилакоидами стромы, также называемыми межгранальными тилакоидами или ламели. Тилакоиды граны и тилакоиды стромы можно различить по их разному белковому составу. Грана способствует большему соотношению площади поверхности хлоропластов к объему. Недавний электронная томография Изучение тилакоидных мембран показало, что ламели стромы организованы в широкие листы, перпендикулярные оси стека грана, и образуют множественные правые спиральные поверхности на границе раздела граней.[2] Левые винтовые поверхности консолидируются между правыми спиралями и листами. Было показано, что эта сложная сеть чередующихся спиральных поверхностей мембран разного радиуса и шага минимизирует поверхностную энергию и энергию изгиба мембран.[2] Эта новая модель, самая обширная из созданных на сегодняшний день, показала, что особенности двух, казалось бы, противоречащих друг другу старых моделей[10][11] сосуществуют в структуре. Примечательно, что аналогичные расположения спиральных элементов с чередованием вращения, часто называемые конструкциями «гараж», предлагалось присутствовать в эндоплазматический ретикулум [12] И в сверхплотное ядерное вещество.[13][14][15] Эта структурная организация может составлять фундаментальную геометрию для соединения между плотно упакованными слоями или листами.[2]
Формирование
Хлоропласты развиваются из пропластиды когда саженцы выйти из-под земли. Для образования тилакоидов требуется свет. В зародыше растения и в отсутствие света пропластиды развиваются в этиопласты которые содержат полукристаллические мембранные структуры, называемые проламеллярными телами. Под воздействием света эти проламеллярные тела превращаются в тилакоиды. Этого не происходит у сеянцев, выращенных в темноте, которые подвергаются этиоляция. Недостаток света может привести к выходу тилакоидов из строя. Это вызывает разрушение хлоропластов, что приводит к гибели растения.
Для образования тилакоидов необходимо действие белок, индуцирующий везикулы, в пластидах 1 (VIPP1). Растения не могут выжить без этого белка, а снижение уровня VIPP1 приводит к замедлению роста и бледности растений с пониженной способностью к фотосинтезу. VIPP1, по-видимому, необходим для образования основной тилакоидной мембраны, но не для сборки белковых комплексов тилакоидной мембраны.[16] Он сохраняется у всех организмов, содержащих тилакоиды, включая цианобактерии,[17] зеленые водоросли, такие как Хламидомонада,[18] и высшие растения, такие как Arabidopsis thaliana.[19]
Выделение и фракционирование
Тилакоиды можно очищать из растительных клеток, используя комбинацию дифференциала и градиента. центрифугирование.[20] Разрушение изолированных тилакоидов, например, механическим сдвигом, высвобождает люменальную фракцию. Периферийные и интегральные мембранные фракции могут быть извлечены из оставшейся мембранной фракции. Лечение с карбонат натрия (Na2CO3) отсоединяется белки периферической мембраны, тогда как лечение с моющие средства и органические растворители солюбилизирует интегральные мембранные белки.
Белки
Тилакоиды содержат многие интегральные и периферические мембранные белки, а также белки просвета. Недавний протеомика исследования фракций тилакоидов предоставили дополнительные сведения о белковом составе тилакоидов.[21] Эти данные обобщены в нескольких базах данных пластидных белков, доступных в Интернете.[22][23]
Согласно этим исследованиям, тилакоид протеом состоит как минимум из 335 различных белков. Из них 89 находятся в просвете, 116 - интегральные мембранные белки, 62 - периферические белки на стороне стромы и 68 - периферические белки на стороне просвета. Дополнительные белки просвета с низким содержанием могут быть предсказаны с помощью вычислительных методов.[20][24] Из тилакоидных белков с известными функциями 42% участвуют в фотосинтезе. Следующие по величине функциональные группы включают белки, участвующие в нацеливание на белок, обработка и складывание с 11%, окислительный стресс ответ (9%) и перевод (8%).[22]
Интегральные мембранные белки
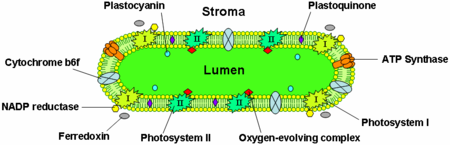
Тилакоидные мембраны содержат интегральные мембранные белки которые играют важную роль в сборке света и светозависимых реакциях фотосинтеза. В тилакоидной мембране есть четыре основных белковых комплекса:
Фотосистема II расположена в основном в тилакоидах граны, тогда как фотосистема I и АТФ-синтаза в основном расположены в тилакоидах стромы и внешних слоях граны. Комплекс цитохрома b6f равномерно распределен по мембранам тилакоидов. Из-за раздельного расположения двух фотосистем в тилакоидной мембранной системе требуются мобильные переносчики электронов для перемещения электронов между ними. Эти переносчики - пластохинон и пластоцианин. Пластохинон переносит электроны от фотосистемы II к комплексу цитохрома b6f, тогда как пластоцианин переносит электроны от комплекса цитохрома b6f к фотосистеме I.
Вместе эти белки используют световую энергию для цепи переноса электронов которые создают хемиосмотический потенциал через тилакоидную мембрану и НАДФН, продукт терминала редокс реакция. В АТФ-синтаза использует хемиосмотический потенциал для создания АТФ в течение фотофосфорилирование.
Фотографиисистемы
Эти фотосистемы представляют собой управляемые светом окислительно-восстановительные центры, каждый из которых состоит из антенный комплекс который использует хлорофиллы и аксессуар фотосинтетические пигменты Такие как каротиноиды и фикобилипротеины для сбора света с различными длинами волн. Каждый антенный комплекс содержит от 250 до 400 молекул пигмента, и энергия, которую они поглощают, передается посредством резонансной передачи энергии специализированному хлорофиллу. а в реакционном центре каждой фотосистемы. Когда один из двух хлорофиллов а молекулы в реакционном центре поглощают энергию, электрон возбуждается и передается молекуле-акцептору электронов. Фотосистема I содержит пару хлорофиллов а молекулы, обозначенные P700, в его реакционном центре, который максимально поглощает свет 700 нм. Фотосистема II содержит P680 хлорофилл, который лучше всего поглощает свет с длиной волны 680 нм (обратите внимание, что эти длины волн соответствуют темно-красному цвету - см. видимый спектр ). Буква P - это сокращение от пигмента, а число - это удельный пик поглощения в нанометрах для молекул хлорофилла в каждом реакционном центре. Это зеленый пигмент, присутствующий в растениях, который не виден невооруженным глазом.
Комплекс цитохрома b6f
Комплекс цитохрома b6f является частью цепи переноса электронов тилакоида и связывает перенос электронов с перекачкой протонов в просвет тилакоида. Энергетически он расположен между двумя фотосистемами и переносит электроны от фотосистемы II-пластохинона к пластоцианин-фотосистеме I.
АТФ-синтаза
Тилакоидная АТФ-синтаза представляет собой CF1FO-АТФ-синтазу, аналогичную митохондриальной АТФазе. Он интегрирован в тилакоидную мембрану, при этом часть CF1 втыкается в строму. Таким образом, синтез АТФ происходит на стромальной стороне тилакоидов, где АТФ необходим для светонезависимые реакции фотосинтеза.
Люмен белки
Электронный транспортный белок пластоцианин присутствует в просвете и переносит электроны от белкового комплекса цитохрома b6f к фотосистеме I. В то время как пластохиноны растворимы в липидах и поэтому перемещаются внутри тилакоидной мембраны, пластоцианин перемещается через просвет тилакоида.
Просвет тилакоидов также является местом окисления воды кислород выделяющий комплекс связаны с люменальной стороной фотосистемы II.
Люменальные белки можно предсказать с помощью вычислений на основе их сигналов нацеливания. У арабидопсиса из предсказанных белков просвета, обладающих Tat сигнала, самые большие группы с известными функциями на 19% вовлечены в процессинг белка (протеолиз и фолдинг), 18% - в фотосинтез, 11% - в метаболизм и 7% - переносчики окислительно-восстановительного потенциала и защиту.[20]
Экспрессия белка
У хлоропластов свои геном, кодирующий ряд тилакоидных белков. Однако в ходе эволюции пластид от их цианобактериальных эндосимбиотический предков, обширный перенос генов из генома хлоропласта в ядро клетки состоялся. Это приводит к тому, что четыре основных тилакоидных белковых комплекса кодируются частично геномом хлоропласта и частично геномом ядра. Растения разработали несколько механизмов совместной регуляции экспрессии различных субъединиц, кодируемых в двух разных органеллах, для обеспечения надлежащего стехиометрия и сборка этих белковых комплексов. Например, транскрипция ядерных генов, кодирующих части фотосинтетического аппарата, регулируется свет. Биогенез, стабильность и оборот тилакоидных белковых комплексов регулируются фосфорилирование через редокс-чувствительный киназы в тилакоидных мембранах.[25] В перевод Скорость кодируемых хлоропластом белков контролируется присутствием или отсутствием партнеров по сборке (контроль эпистазией синтеза).[26] Этот механизм включает негативный отзыв за счет связывания избытка белка с 5 'нетранслируемой областью хлоропласта мРНК.[27] Хлоропластам также необходимо сбалансировать соотношение фотосистем I и II в цепи переноса электронов. Редокс-состояние пластохинона-переносчика электронов в тилакоидной мембране напрямую влияет на транскрипцию генов хлоропластов, кодирующих белки реакционных центров фотосистем, тем самым противодействуя дисбалансу в цепи переноса электронов.[28]
Нацеливание белков на тилакоиды
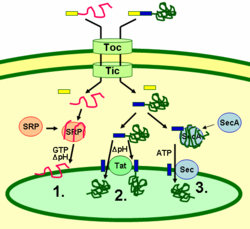
Тилакоидные белки направляются к месту назначения через сигнальные пептиды и прокариотического типа секреторные пути внутри хлоропласта. Большинству тилакоидных белков, кодируемых ядерным геномом растения, для правильной локализации необходимы два нацеленных сигнала: нацеливающий пептид на N-концевой хлоропласт (показан желтым на рисунке), за которым следует нацеленный на тилакоид пептид (показан синим). Белки импортируются через транслокон внешней и внутренней мембраны (Toc and Tic ) комплексы. После попадания в хлоропласт первый целевой пептид отщепляется протеазой, обрабатывающей импортируемые белки. Это демаскирует второй сигнал нацеливания, и белок экспортируется из стромы в тилакоид на втором этапе нацеливания. Этот второй шаг требует действия компонентов тилакоидов по транслокации белков и зависит от энергии. Белки встраиваются в мембрану посредством SRP-зависимого пути (1), Tat-зависимый путь (2), или спонтанно через их трансмембранные домены (на рисунке не показаны). Белки просвета транспортируются через тилакоидную мембрану в просвет либо посредством Tat-зависимого пути (2), либо посредством Sec-зависимого пути (3) и высвобождаются путем отщепления от тилакоидного нацеленного сигнала. Различные пути используют разные сигналы и источники энергии. Sec (секреторный) путь требует АТФ в качестве источника энергии и состоит из SecA, который связывается с импортируемым белком, и мембранным комплексом Sec для перемещения белка через него. Белки с двойником аргинин Мотив в их тилакоидном сигнальном пептиде перемещается через путь Tat (двойная транслокация аргинина), который требует мембраносвязанного комплекса Tat и градиента pH в качестве источника энергии. Некоторые другие белки вставляются в мембрану через SRP (частица распознавания сигнала ) путь. SRP хлоропласта может взаимодействовать со своими белками-мишенями либо посттрансляционно, либо ко-трансляционно, таким образом транспортируя импортированные белки, а также те, которые транслируются внутри хлоропласта. Путь SRP требует GTP и градиента pH в качестве источников энергии. Некоторые трансмембранные белки могут также спонтанно вставляться в мембрану со стороны стромы без потребности в энергии.[29]
Функция

Тилакоиды являются местом светозависимые реакции фотосинтеза. К ним относятся окисление воды под действием света и выделение кислорода, перекачка протонов через тилакоидные мембраны, связанных с цепью переноса электронов фотосистем и цитохромного комплекса, и синтез АТФ с помощью АТФ-синтазы с использованием генерируемого протонного градиента.
Фотолиз воды
Первым шагом в фотосинтезе является управляемое светом восстановление (расщепление) воды, чтобы обеспечить электроны для фотосинтетических цепей переноса электронов, а также протоны для создания протонного градиента. Реакция расщепления воды происходит на просветной стороне тилакоидной мембраны и управляется световой энергией, захваченной фотосистемами. Это окисление воды обычно приводит к образованию отходов O2 это жизненно важно для клеточное дыхание. Молекулярный кислород, образующийся в результате реакции, выбрасывается в атмосферу.
Электронные транспортные цепи
Во время фотосинтеза используются два различных варианта переноса электронов:
- Нециклический перенос электронов или же Нециклическое фотофосфорилирование производит НАДФН + Н+ и АТФ.
- Циклический перенос электронов или же Циклическое фотофосфорилирование производит только АТФ.
Нециклическое разнообразие предполагает участие обеих фотосистем, тогда как циклический поток электронов зависит только от фотосистемы I.
- Фотосистема I использует световую энергию для снижения НАДФ+ к НАДФН + Н+, и активен как в нециклическом, так и в циклическом переносе электронов. В циклическом режиме заряженный электрон передается по цепочке, которая в конечном итоге возвращает его (в его основном состоянии) хлорофиллу, который его активировал.
- Фотосистема II использует световую энергию для окисления молекул воды, производя электроны (e−), протоны (H+) и молекулярный кислород (O2) и активен только в нециклическом транспорте. Электроны в этой системе не сохраняются, а постоянно поступают из окисленного 2H2О (О2 + 4 часа+ + 4 е−) и выход с NADP+ когда он, наконец, снижается до НАДФН.
Хемиосмос
Основная функция тилакоидной мембраны и ее интегральных фотосистем - создание хемиосмотического потенциала. Носители в цепи переноса электронов используют часть энергии электрона для активного переноса протонов из строма к просвет. Во время фотосинтеза просвет становится кислый, ниже pH 4 по сравнению с pH 8 в строме.[30] Это представляет 10000-кратный градиент концентрации для протоны через тилакоидную мембрану.
Источник протонного градиента
Протоны в просвете происходят из трех основных источников.
- Фотолиз к фотосистема II окисляет воду до кислород, протоны и электроны в просвете.
- Перенос электронов из фотосистемы II в пластохинон в течение нециклический перенос электронов потребляет два протона из стромы. Они высвобождаются в просвет, когда восстановленный пластохинол окисляется белковым комплексом цитохрома b6f на стороне просвета тилакоидной мембраны. Из пула пластохинона электроны проходят через комплекс цитохрома b6f. Этот интегральный мембранный узел напоминает цитохром bc1.
- Уменьшение пластохинон к ферредоксин в течение циклический перенос электронов также переносит два протона из стромы в просвет.
Протонный градиент также вызван потреблением протонов в строме для производства НАДФН из НАДФ + на НАДФ-редуктазе.
Генерация АТФ
Молекулярный механизм образования АТФ (аденозинтрифосфата) в хлоропластах аналогичен таковому в митохондрии и забирает необходимую энергию из движущая сила протона (PMF).[нужна цитата ] Однако хлоропласты больше полагаются на химический потенциал PMF для генерации потенциальной энергии, необходимой для синтеза АТФ. PMF представляет собой сумму протонного химического потенциала (заданного градиентом концентрации протонов) и трансмембранного электрический потенциал (определяется разделением зарядов через мембрану). По сравнению с внутренними мембранами митохондрий, которые имеют значительно более высокий мембранный потенциал Из-за разделения зарядов у тилакоидных мембран отсутствует градиент заряда.[нужна цитата ] Чтобы компенсировать это, 10 000-кратный градиент концентрации протонов через тилакоидную мембрану намного выше, чем 10-кратный градиент через внутреннюю мембрану митохондрий. Результирующий хемиосмотический потенциал между просветом и строма достаточно высока, чтобы управлять синтезом АТФ с помощью АТФ-синтаза. Поскольку протоны возвращаются вниз по градиенту через каналы в АТФ-синтаза, ADP + Pя объединяются в АТФ. Таким образом, светозависимые реакции связаны с синтезом АТФ через протонный градиент.[нужна цитата ]
Тилакоидные мембраны цианобактерий
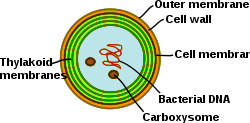
Цианобактерии фотосинтезирующие прокариоты с высоко дифференцированными мембранными системами. Цианобактерии имеют внутреннюю систему тилакоидных мембран, в которой полнофункциональные цепи переноса электронов фотосинтез и дыхание проживать. Наличие различных мембранных систем придает этим клеткам уникальную сложность среди бактерии. Цианобактерии должны быть способны реорганизовывать мембраны, синтезировать новые мембранные липиды и правильно нацеливать белки на правильную мембранную систему. В внешняя мембрана, плазматическая мембрана, и каждая тилакоидная мембрана играет особую роль в клетке цианобактерий. Понимание организации, функциональности, белкового состава и динамики мембранных систем остается серьезной проблемой в биологии цианобактериальных клеток.[31]
В отличие от тилакоидной сети высших растений, которая дифференцируется на ламеллы граны и стромы, тилакоиды у цианобактерий организованы в несколько концентрических оболочек, которые разделяются и сливаются с параллельными слоями, образуя сильно связанную сеть. Это приводит к образованию непрерывной сети, которая охватывает один просвет (как в хлоропластах высших растений) и позволяет водорастворимым и жирорастворимым молекулам диффундировать через всю мембранную сеть. Более того, внутри параллельных листов тилакоида часто наблюдаются перфорации. Эти промежутки в мембране позволяют частицам разного размера перемещаться по клетке, включая рибосомы, гранулы гликогена и липидные тела.[32] Относительно большое расстояние между тилакоидами дает место для внешних светособирающих антенн, фикобилисомы.[33] Эта макроструктура, как и в случае высших растений, проявляет некоторую гибкость при изменении физико-химической среды.[34]
Смотрите также
- Артур Мейер (ботаник)
- Андре Ягендорф
- Хемиосмос
- Электрохимический градиент
- Эндосимбиоз
- Выделение кислорода
- Фотосинтез
Рекомендации
- ^ θύλακος. Лидделл, Генри Джордж; Скотт, Роберт; Греко-английский лексикон на Проект Персей
- ^ а б c d е Бусси Ю., Шимони Э., Вайнер А., Капон Р., Чаруви Д., Нево Р., Эфрати Е., Райх З (2019). «Фундаментальная спиральная геометрия укрепляет фотосинтетическую мембрану растений». Proc Natl Acad Sci USA. 116 (44): 22366–22375. Дои:10.1073 / pnas.1905994116. ЧВК 6825288. PMID 31611387.
- ^ "Фотосинтез" Энциклопедия науки и техники Макгроу Хилла, 10-е изд. 2007. Vol. 13 п. 469
- ^ Сато Н. (2004). «Роль кислых липидов сульфохиновозилдиацилглицерина и фосфатидилглицерина в фотосинтезе: их специфичность и эволюция». J Plant Res. 117 (6): 495–505. Дои:10.1007 / s10265-004-0183-1. PMID 15538651. S2CID 27225926.
- ^ «фотосинтез». Британская энциклопедия. 2008 г. DVD Encyclopdia Britannica 2006 Ultimate Reference Suite 9 апреля 2008 г.
- ^ Спрак С.Г. (1987). «Структурно-функциональная организация галактолипидов на тилакоидной мембранной организации». J Bioenerg Biomembr. 19 (6): 691–703. Дои:10.1007 / BF00762303. PMID 3320041. S2CID 6076741.
- ^ Яшрой, Р. (1990). «Магнитно-резонансные исследования динамической организации липидов в мембранах хлоропластов» (PDF). Журнал биологических наук. 15 (4): 281–288. Дои:10.1007 / bf02702669. S2CID 360223.
- ^ Яшрой, Р. (1987). «Исследования ЯМР 13С липидных жирно-ацильных цепей мембран хлоропластов». Индийский журнал биохимии и биофизики. 24 (3): 177–178. PMID 3428918.
- ^ Беннинг К., Сюй Ц., Авай К. (2006). «Невезикулярный и везикулярный перенос липидов с участием пластид». Курр Опин Завод Биол. 9 (3): 241–7. Дои:10.1016 / j.pbi.2006.03.012. PMID 16603410.
- ^ Шимони Э, Рав-Хон О, Охад I, Брамфельд V, Райх З (2005). «Трехмерная организация тилакоидных мембран хлоропластов высших растений, выявленная методом электронной томографии». Растительная клетка. 17 (9): 2580–6. Дои:10.1105 / tpc.105.035030. ЧВК 1197436. PMID 16055630.
- ^ Mustárdy, L .; Buttle, K .; Steinbach, G .; Гараб, Г. (2008). "Трехмерная сеть тилакоидных мембран в растениях: квазигелическая модель сборки гранум-строма". Растительная клетка. 20 (10): 2552–2557. Дои:10.1105 / tpc.108.059147. ЧВК 2590735. PMID 18952780.
- ^ Терасаки М., Шемеш Т., Кастури Н., Клемм Р., Шалек Р., Хейворт К., Хэнд А., Янкова М., Хубер Г., Лихтман Дж., Рапопорт Т., Козлов М. (2013). «Сложенные друг с другом листы эндоплазматической сети соединены спиралевидными мембранными мотивами». Клетка. 154 (2): 285–96. Дои:10.1016 / j.cell.2013.06.031. ЧВК 3767119. PMID 23870120.
- ^ Берри ДК; Caplan ME; Горовиц CJ; Huber G; Шнайдер А.С. (2016). ""Автостоянка «Сооружения в ядерной астрофизике и клеточной биофизике». Phys Rev C. Американское физическое общество. 94 (5): 055801. Bibcode:2016PhRvC..94e5801B. Дои:10.1103 / PhysRevC.94.055801.
- ^ Горовиц CJ; Берри ДК; Бриггс СМ; Caplan ME; Камминг А; Шнайдер А.С. (2015). «Неупорядоченная ядерная паста, распад магнитного поля и охлаждение коры нейтронных звезд». Phys Rev Lett. 114 (3): 031102. arXiv:1410.2197. Bibcode:2015PhRvL.114c1102H. Дои:10.1103 / PhysRevLett.114.031102. PMID 25658989.
- ^ Schneider AS; Берри ДК; Caplan ME; Горовиц CJ; Лин З (2016). "Влияние топологических дефектов на наблюдаемые" ядерные макароны ". Phys Rev C. 93 (6): 065806. arXiv:1602.03215. Bibcode:2016PhRvC..93f5806S. Дои:10.1103 / PhysRevC.93.065806.
- ^ Елена Асеева; Фридрих Оссенбюль; Клаудиа Сиппель; Вон К. Чо; Бернхард Штайн; Лутц А. Эйхакер; Йорг Мёрер; Герхард Ваннер; Питер Вестхофф; Юрген Золь; Уте К. Воткнехт (2007). «Vipp1 необходим для образования основной тилакоидной мембраны, но не для сборки тилакоидных белковых комплексов». Physiol Biochem растений. 45 (2): 119–28. Дои:10.1016 / j.plaphy.2007.01.005. PMID 17346982.
- ^ Westphal S, Heins L, Soll J, Vothknecht U (2001). "Мутант Synechocystis с делецией Vipp1: связь между бактериальным фаговым шоком и биогенезом тилакоидов?". Proc Natl Acad Sci USA. 98 (7): 4243–8. Дои:10.1073 / pnas.061501198. ЧВК 31210. PMID 11274448.
- ^ Лю С., Виллмунд Ф., Голецки Дж., Какаче С., Маркерт С., Хес Б., Шрода М., Шрода М. (2007). «Шапероны хлоропластов HSP70B-CDJ2-CGE1 катализируют сборку и разборку олигомеров VIPP1 у Chlamydomonas». Завод J. 50 (2): 265–77. Дои:10.1111 / j.1365-313X.2007.03047.x. PMID 17355436.
- ^ Kroll D, Meierhoff K, Bechtold N, Kinoshita M, Westphal S, Vothknecht U, Soll J, Westhoff P (2001). «VIPP1, ядерный ген Arabidopsis thaliana, необходимый для образования тилакоидной мембраны». Proc Natl Acad Sci USA. 98 (7): 4238–42. Дои:10.1073 / pnas.061500998. ЧВК 31209. PMID 11274447.
- ^ а б c Пельтье Дж., Эмануэльссон О., Калуме Д., Иттерберг Дж., Фризо Дж., Руделла А., Либерлес Д., Седерберг Л., Рёпсторфф П., von Heijne G, ван Вейк KJ (2002). «Центральные функции люменального и периферического тилакоидного протеома Arabidopsis, определенные экспериментальным путем и общегеномным прогнозом». Растительная клетка. 14 (1): 211–36. Дои:10.1105 / tpc.010304. ЧВК 150561. PMID 11826309.
- ^ ван Вейк К. (2004). «Протеомика пластид». Physiol Biochem растений. 42 (12): 963–77. Дои:10.1016 / j.plaphy.2004.10.015. PMID 15707834.
- ^ а б Фризо Дж., Джакомелли Л., Иттерберг А., Пельтье Дж., Руделла А., Сан К., Вейк К. (2004). «Углубленный анализ протеома тилакоидной мембраны хлоропластов Arabidopsis thaliana: новые белки, новые функции и база данных протеомов пластид». Растительная клетка. 16 (2): 478–99. Дои:10.1105 / tpc.017814. ЧВК 341918. PMID 14729914.- База данных протеомов пластид
- ^ Клеффманн Т., Хирш-Хоффманн М., Груиссем В., Багинский С. (2006). «plprot: обширная база данных протеомов для различных типов пластид». Физиология растительной клетки. 47 (3): 432–6. Дои:10.1093 / pcp / pcj005. PMID 16418230. – База данных Plastid Protein
- ^ Пельтье Дж., Фризо Дж., Калуме Д., Рёпсторфф П., Нильссон Ф., Адамска И., ван Вейк К. (2000). «Протеомика хлоропласта: систематическая идентификация и целевой анализ люменальных и периферических тилакоидных белков». Растительная клетка. 12 (3): 319–41. Дои:10.1105 / tpc.12.3.319. ЧВК 139834. PMID 10715320.
- ^ Венер А.В., Охад И., Андерссон Б. (1998). «Фосфорилирование белков и окислительно-восстановительное зондирование тилакоидов хлоропластов». Курр Опин Завод Биол. 1 (3): 217–23. Дои:10.1016 / S1369-5266 (98) 80107-6. PMID 10066592.
- ^ Шоке Y, Wostrikoff K, Rimbault B, Zito F, Girard-Bascou J, Drapier D, Wollman F (2001). «Сборка-контролируемая регуляция трансляции гена хлоропластов». Biochem Soc Trans. 29 (Пт 4): 421–6. Дои:10.1042 / BST0290421. PMID 11498001.
- ^ Minai L, Wostrikoff K, Wollman F, Choquet Y (2006). «Биогенез хлоропластов ядер Фотосистемы II включает серию контролируемых сборкой шагов, которые регулируют трансляцию». Растительная клетка. 18 (1): 159–75. Дои:10.1105 / tpc.105.037705. ЧВК 1323491. PMID 16339851.
- ^ Аллен Дж, Пфанншмидт Т (2000). «Уравновешивание двух фотосистем: фотосинтетический перенос электронов управляет транскрипцией генов реакционных центров в хлоропластах». Philos Trans R Soc Lond B Biol Sci. 355 (1402): 1351–9. Дои:10.1098 / rstb.2000.0697. ЧВК 1692884. PMID 11127990.
- ^ а б Gutensohn M, Fan E, Frielingsdorf S, Hanner P, Hou B, Hust B, Klösgen R (2006). «Toc, Tic, Tat и др.: Структура и функция механизмов транспорта белка в хлоропластах». J. Plant Physiol. 163 (3): 333–47. Дои:10.1016 / j.jplph.2005.11.009. PMID 16386331.
- ^ Ягендорф А. Т. и Э. Урибе (1966). «Образование АТФ, вызванное кислотно-основным переходом хлоропластов шпината». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 55 (1): 170–177. Bibcode:1966ПНАС ... 55..170J. Дои:10.1073 / пнас.55.1.170. ЧВК 285771. PMID 5220864.
- ^ Эрреро А. и Флорес Э. (редактор). (2008). Цианобактерии: молекулярная биология, геномика и эволюция (1-е изд.). Caister Academic Press. ISBN 978-1-904455-15-8. [1].
- ^ Нево Р., Чаруви Д., Шимони Э., Шварц Р., Каплан А., Охад I, Райх З (2007). «Перфорация и соединение тилакоидной мембраны обеспечивают внутриклеточный трафик цианобактерий». EMBO J. 26 (5): 1467–1473. Дои:10.1038 / sj.emboj.7601594. ЧВК 1817639. PMID 17304210.
- ^ Олив, Дж; Аджлани, G; Астье, С; Recouvreur, M; Вернот, С (1997). «Ультраструктура и световая адаптация мутантов фикобилисом Synechocystis PCC 6803». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1319 (2–3): 275–282. Дои:10.1016 / S0005-2728 (96) 00168-5.
- ^ Надь, G; Посселт, Д; Ковач, L; Holm, JK; Сабо, М; Уги, Б; Роста, Л; Питерс, Дж; Тимминс, П; Гараб, Г (1 июня 2011 г.). «Обратимые реорганизации мембран во время фотосинтеза in vivo: обнаружены с помощью малоуглового рассеяния нейтронов» (PDF). Биохимический журнал. 436 (2): 225–30. Дои:10.1042 / BJ20110180. PMID 21473741.
Источники учебников
- Хеллер, Х. Крейг; Orians, Gordan H .; Первес, Уильям К. и Садава, Дэвид (2004). ЖИЗНЬ: Биологическая наука (7-е изд.). Sinauer Associates, Inc. ISBN 978-0-7167-9856-9.
- Рэйвен, Питер Х .; Рэй Ф. Эверт; Сьюзан Э. Эйххорн (2005). Биология растений (7-е изд.). Нью-Йорк: W.H. Издатели Freeman and Company. стр.115–127. ISBN 978-0-7167-1007-3.
- Эрреро А. и Флорес Э. (редакторы). (2008). Цианобактерии: молекулярная биология, геномика и эволюция (1-е изд.). Caister Academic Press. ISBN 978-1-904455-15-8.
