Хемиосмос - Википедия - Chemiosmosis
Хемиосмос это движение ионы через полупроницаемая мембрана связанная структура, вниз их электрохимический градиент. Примером этого может быть образование аденозинтрифосфат (АТФ) движением водород ионы (H+) через мембрана в течение клеточное дыхание или же фотосинтез.
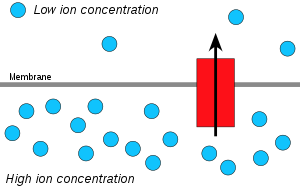
Ионы водорода, или протоны, буду размытый из области с высокой концентрацией протонов в область с более низкой концентрацией протонов, и электрохимический градиент концентрации Протонов через мембрану можно использовать для производства АТФ. Этот процесс связан с осмос, распространение воды через мембрану, поэтому это называется «хемиосмосом».
АТФ-синтаза это фермент который производит АТФ путем хемиосмоса. Он позволяет протонам проходить через мембрану и использует свободная энергия отличие от фосфорилат аденозиндифосфат (АДФ), делая АТФ. Генерация АТФ хемиосмосом происходит в митохондрии и хлоропласты, а также в большинстве бактерии и археи, электронная транспортная цепь перекачивает ионы H + в тилакоидные пространства через тилакоидные мембраны в строма (жидкость). Энергия от движения электрона через цепи переноса электронов проходит через АТФ-синтазу, которая позволяет протону проходить через них и использовать эту разницу в свободной энергии для фотофосфорилирования АДФ с образованием АТФ.
Хемиосмотическая теория
Питер Д. Митчелл предложил хемиосмотическая гипотеза в 1961 г.[1]Теория по существу предполагает, что большинство аденозинтрифосфат (АТФ) синтез в дышащий клетки происходит из электрохимический градиент через внутренние мембраны митохондрии используя энергия из НАДН и FADH2 образовался в результате разрушения богатых энергией молекулы Такие как глюкоза.
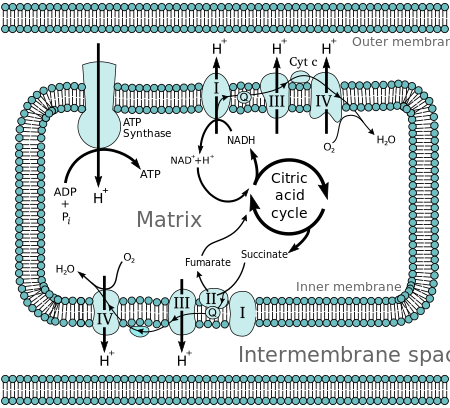
Молекулы, такие как глюкоза, метаболизируется производить ацетил-КоА как богатый энергией промежуточный продукт. В окисление из ацетилкофермент А (ацетил-КоА) в митохондриальный матрикс связан с снижение молекулы-носителя, такой как никотинамид аденин динуклеотид (НАД) и флавинаденин динуклеотид (FAD).[2]Перевозчики проходят электроны к электронная транспортная цепь (ETC) в внутренняя митохондриальная мембрана, которые, в свою очередь, передают их другим белкам в ETC. Энергия электронов используется для накачки протоны от матрица через строму, накапливая энергию в виде трансмембранного электрохимический градиент. Протоны возвращаются через внутреннюю мембрану через фермент. АТФ-синтаза. Поток протонов обратно в матрицу митохондрии через АТФ-синтаза обеспечивает достаточно энергии для соединения АДФ с неорганическими фосфат образовывать АТФ. Электроны и протоны последней накачки в ETC поглощаются кислород формировать воды.
В то время это было радикальным предложением, и его не приняли. Преобладала точка зрения, согласно которой энергия переноса электрона хранится в виде стабильного промежуточного продукта с высоким потенциалом, что было химически более консервативной концепцией. Проблема более старой парадигмы состоит в том, что никаких промежуточных продуктов с высокой энергией никогда не было обнаружено, и доказательства протонной накачки комплексами цепь переноса электронов стал слишком велик, чтобы его можно было игнорировать. В конце концов, масса свидетельств стала в пользу хемиосмотической гипотезы, и в 1978 году Питер Митчелл был награжден премией. Нобелевская премия по химии.[3]
Хемиосмотическое связывание важно для производства АТФ в митохондрии, хлоропласты[4]и много бактерии и археи.[5]
Протонодвижущая сила

Движение ионов через мембрану зависит от комбинации двух факторов:
- Распространение сила, вызванная градиентом концентрации - все частицы имеют тенденцию диффундировать от более высокой концентрации к более низкой.
- Электростатическая сила вызванный электрический потенциал градиент - катионы как протоны H+ имеют тенденцию рассеивать электрический потенциал вниз от положительной (P) стороны мембраны к отрицательной (N) стороне. Анионы самопроизвольно распространяются в противоположном направлении.
Эти два градиента, вместе взятые, можно выразить как электрохимический градиент.
Липидные бислои из биологические мембраны однако являются барьерами для ионов. Вот почему энергия может храниться в виде комбинации этих двух градиентов через мембрану. Только специальные мембранные белки, такие как ионные каналы может иногда позволять ионам перемещаться через мембрану (см. также: Мембранный транспорт ). В хемиосмотической теории трансмембранный АТФ-синтазы очень важны. Они преобразуют энергию спонтанного потока протонов через них в химическую энергию АТФ-связей.
Отсюда исследователи создали термин протонодвижущая сила (PMF), полученный из упомянутого ранее электрохимического градиента. Его можно описать как меру потенциальной энергии, накопленной как комбинацию протонов и градиентов напряжения (электрического потенциала) на мембране. Электрический градиент является следствием разделения зарядов на мембране (когда протоны H+ двигаться без противоион, Такие как хлористый Cl−).
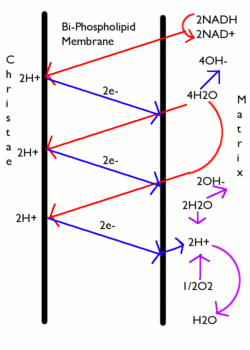
В большинстве случаев протонная движущая сила создается цепью переноса электронов, которая действует как протонный насос, используя Свободная энергия Гиббса из редокс реакции для выкачивания протонов (ионов водорода) через мембрану, разделяя заряд через мембрану. В митохондриях энергия, выделяемая цепью переноса электронов, используется для перемещения протонов из митохондриального матрикса (N-сторона) в межмембранное пространство (P-сторона). Перемещение протонов из митохондрии создает более низкую концентрацию положительно заряженных протонов внутри митохондрии, что приводит к избыточному отрицательному заряду внутри мембраны. Градиент электрического потенциала составляет около -170 мВ. [6], отрицательный внутри (N). Эти градиенты - разница зарядов и разница концентраций протонов создают комбинированный электрохимический градиент через мембрану, часто выражаемый как протонодвижущая сила (PMF). В митохондриях PMF почти полностью состоит из электрического компонента, но в хлоропластах PMF состоит в основном из градиента pH, поскольку заряд протонов H+ нейтрализуется движением Cl− и другие анионы. В любом случае PMF должен быть больше примерно 460 мВ (45 кДж / моль), чтобы АТФ-синтаза могла производить АТФ.
Уравнения
Протонодвижущая сила выводится из Свободная энергия Гиббса. Пусть N обозначает внутреннюю часть клетки, а P обозначает внешнюю сторону. потом[6]
куда
- - изменение свободной энергии Гиббса на единицу количества катионы переведен из P в N;
- это номер заряда из катион ;
- - электрический потенциал N относительно P;
- и - концентрации катионов при P и N соответственно;
- это Постоянная Фарадея;
- это газовая постоянная; и
- это температура.
Молярное изменение свободной энергии Гиббса часто интерпретируется как молярный электрохимический ионный потенциал .
Для электрохимический протонный градиент и как следствие:
куда
- .
Митчелл определил протонодвижущая сила (PMF) как
- .
Например, подразумевает . В это уравнение принимает вид:
.
Обратите внимание, что для спонтанного импорта протонов со стороны P (относительно более положительной и кислой) на сторону N (относительно более отрицательной и щелочной), отрицательно (аналогично ), тогда как PMF положительный (аналогично окислительно-восстановительному потенциалу клетки ).
Стоит отметить, что, как и в любом процессе трансмембранного транспорта, PMF является направленным. Знак трансмембранной разности электрических потенциалов выбран, чтобы представить изменение потенциальной энергии на единицу заряда, протекающего в ячейку, как указано выше. Кроме того, из-за перекачки протонов, вызываемой окислительно-восстановительным процессом, через сайты связывания, градиент протонов всегда внутри щелочной. По обеим этим причинам протоны втекают самопроизвольно со стороны P на сторону N. имеющаяся свободная энергия используется для синтеза АТФ (см. ниже). По этой причине PMF определен для импорта протонов, который является спонтанным. PMF для экспорта протонов, то есть перекачка протонов, катализируемая сайтами связывания, является просто отрицательным для PMF (импорта).
Самопроизвольный импорт протонов (со стороны P в сторону N) универсален для всех биоэнергетических мембран.[8] Этот факт не был признан до 1990-х годов, потому что просвет тилакоида хлоропласта интерпретировался как внутренняя фаза, но на самом деле он топологически эквивалентен внешнему виду хлоропласта. Azzone et al. подчеркнули, что внутренняя фаза (N сторона мембраны) - это цитоплазма бактерий, митохондриальный матрикс или строма хлоропластов; внешняя (P) сторона - это периплазматическое пространство бактерий, межмембранное пространство митохондрий или просвет хлоропластов. Кроме того, трехмерная томография внутренней митохондриальной мембраны показывает, что ее обширные инвагинации складываются в стопку, подобно тилакоидным дискам; следовательно, митохондриальное межмембранное пространство топологически очень похоже на просвет хлоропласта:[9]
Энергия, выраженная здесь как свободная энергия Гиббса, электрохимический протонный градиент или протонодвижущая сила (PMF), представляет собой комбинацию двух градиентов через мембрану:
- градиент концентрации (через ) и
- градиент электрического потенциала .
Когда система достигает равновесия, ; тем не менее, концентрации по обе стороны от мембраны не обязательно должны быть одинаковыми. Самопроизвольное движение через потенциальную мембрану определяется градиентами концентрации и электрического потенциала.
Молярная свободная энергия Гиббса синтеза АТФ
также называется потенциалом фосфорилирования. Соотношение равновесных концентраций можно рассчитать путем сравнения и , например, в случае митохондрии млекопитающего:[9]
ЧАС+ / АТФ = ΔGп / (Δp / 10,4 кДж · моль−1/ мВ) = 40,2 кДж · моль−1 / (173,5 мВ / 10,4 кДж · моль−1/ мВ) = 40,2 / 16,7 = 2,4. Фактическое отношение протон-связывающей с-субъединицы к количеству копий бета-субъединицы, синтезирующей АТФ, составляет 8/3 = 2,67, показывая, что в этих условиях митохондрия функционирует с эффективностью 90% (2,4 / 2,67).[9]
Фактически, термодинамическая эффективность в большинстве случаев ниже у эукариотических клеток, потому что АТФ должен экспортироваться из матрикса в цитоплазму, а АДФ и фосфат должны импортироваться из цитоплазмы. Это «стоит» один «дополнительный» импорт протона на АТФ,[6][7] следовательно, фактический КПД составляет всего 65% (= 2,4 / 3,67).
В митохондриях

Полная разбивка глюкоза в присутствии кислород называется клеточное дыхание. Последние стадии этого процесса происходят в митохондриях. Восстановленные молекулы НАДН и FADH2 порождаются Цикл Кребса, гликолиз, и пируват обработка. Эти молекулы передают электроны в электронная транспортная цепь, который использует высвобождаемую энергию для создания протонного градиента во внутреннем митохондриальная мембрана. АТФ-синтаза затем использует энергию, запасенную в этом градиенте, для производства АТФ. Этот процесс называется окислительного фосфорилирования потому что он использует энергию, выделяемую окисление НАДН и ФАДН2 для фосфолиза ADP в АТФ.
В растениях
В легкие реакции из фотосинтез генерировать АТФ под действием хемиосмоса. В фотоны в Солнечный свет принимаются антенным комплексом Фотосистема II, что волнует электроны к более высокому уровень энергии. Эти электроны движутся вниз по электронная транспортная цепь, вызывая активную перекачку протонов через тилакоидная мембрана в просвет тилакоида. Эти протоны затем текут вниз по градиенту их электрохимического потенциала через фермент, называемый АТФ-синтазой, создавая АТФ за счет фосфорилирование АДФ в АТФ. Электроны из начальной легкая реакция достигать Фотосистема I, затем поднимаются на более высокий энергетический уровень световой энергией, затем принимаются акцептором электронов и восстанавливают НАДФ + до НАДФН. Электроны, потерянные из Фотосистемы II, заменяются окислением воды, которая «расщепляется» на протоны и кислород комплексом, выделяющим кислород (OEC, также известный как WOC, или комплекс, окисляющий воду). Чтобы произвести одну молекулу двухатомного кислорода, 10 фотонов должны быть поглощены фотосистемами I и II, четыре электрона должны пройти через две фотосистемы, и будет произведено 2 НАДФН (позже используется для фиксации диоксида углерода в цикле Кальвина).
У прокариот

Бактерии и археи также может использовать хемиосмос для выработки АТФ. Цианобактерии, зеленые серные бактерии, и пурпурные бактерии синтезировать АТФ с помощью процесса, называемого фотофосфорилирование. Эти бактерии используют энергию света для создания протонного градиента с помощью фотосинтетический электронная транспортная цепь. Не фотосинтезирующие бактерии, такие как Кишечная палочка также содержат АТФ-синтаза. Фактически митохондрии и хлоропласты являются продуктом эндосимбиоза и восходят к инкорпорированным прокариотам. Этот процесс описан в эндосимбиотическая теория. Происхождение митохондрий послужило толчком к возникновению эукариот, а происхождение пластид послужило началом происхождения Archaeplastida, одной из основных супергрупп эукариот.
Хемиосмотическое фосфорилирование это третий путь, который производит АТФ из неорганических фосфат и молекула АДФ. Этот процесс является частью окислительного фосфорилирования.
Смотрите также
Рекомендации
- ^ Питер Митчелл (1961). «Связь фосфорилирования с переносом электронов и водорода по хемиосмотическому типу механизма». Природа. 191 (4784): 144–148. Bibcode:1961Натура.191..144М. Дои:10.1038 / 191144a0. PMID 13771349. S2CID 1784050.
- ^ Альбертс, Брюс; Александр Джонсон; Джулиан Льюис; Мартин Рафф; Кейт Робертс; Питер Уолтер (2002). «Протонные градиенты производят большую часть АТФ в клетке». Молекулярная биология клетки. Гирлянда. ISBN 0-8153-4072-9.
- ^ В Нобелевская премия в химии 1978.
- ^ Купер, Джеффри М. (2000). «Рисунок 10.22: Электронный транспорт и синтез АТФ во время фотосинтеза». Клетка: молекулярный подход (2-е изд.). Sinauer Associates, Inc. ISBN 0-87893-119-8.
- ^ Альбертс, Брюс; Александр Джонсон; Джулиан Льюис; Мартин Рафф; Кейт Робертс; Питер Уолтер (2002). "Рисунок 14-32: Важность H+-приводной транспорт в бактериях ». Молекулярная биология клетки. Гирлянда. ISBN 0-8153-4072-9.
- ^ а б c d е ж Николс Д. Г.; Фергюсон С. Дж. (1992). Биоэнергетика 2 (2-е изд.). Сан-Диего: Academic Press. ISBN 9780125181242.
- ^ а б c Страйер, Люберт (1995). Биохимия (четвертое изд.). Нью-Йорк - Бейзингсток: В. Х. Фриман и компания. ISBN 978-0716720096.
- ^ Аззоне, Джованни; и другие. (1993). «Трансмембранные измерения через биоэнергетические мембраны». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1183 (1): 1–3. Дои:10.1016 / 0005-2728 (93) 90002-Вт.
- ^ а б c Сильверштейн, Тодд (2014). "Исследование того, как термодинамическая эффективность биоэнергетических мембранных систем зависит от стехиометрии c-субъединицы F1F0 АТФ-синтазы ». Журнал биоэнергетики и биомембран. 46 (3): 229–241. Дои:10.1007 / s10863-014-9547-у. PMID 24706236. S2CID 1840860.
дальнейшее чтение
- Справочник по учебнику биохимии, из Книжная полка NCBI – Джереми М. Берг; Джон Л. Тимочко; Люберт Страйер (ред.). «18.4. Протонный градиент стимулирует синтез АТФ». Биохимия (5-е изд.). В. Х. Фриман.
- Техническая справка, относящаяся к одной серии экспериментов, направленных на проверку некоторых принципов хемиосмотической теории. – Сэйдзи Огава и Цо Мин Ли (1984). «Связь между потенциалом внутреннего фосфорилирования и протонной движущей силой в митохондриях во время синтеза и гидролиза АТФ». Журнал биологической химии. 259 (16): 10004–10011. PMID 6469951.

![{ displaystyle Delta ! G = zF Delta ! psi + RT ln { frac {[ mathrm {X} ^ {z +}] _ { text {N}}} {[ mathrm {X } ^ {z +}] _ { text {P}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e49984fb465bfe70fdf147d5c94b4691fde30b93)




![{ Displaystyle [ mathrm {X} ^ {z +}] _ { текст {P}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b04667620cf542631c6a2a692aefd89310230ddd)
![{ Displaystyle [ mathrm {X} ^ {z +}] _ { текст {N}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4da81b44fd243b0610ca90f2a571ffe2891ad71)





![{ Displaystyle Delta ! mu _ { mathrm {H} ^ {+}} = F Delta ! psi + RT ln { frac {[ mathrm {H} ^ {+}] _ { text {N}}} {[ mathrm {H} ^ {+}] _ { text {P}}}} = F Delta ! psi - ( ln 10) RT Delta mathrm {pH }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9401e1568170355be3a960a583f16f2d93c5a842)













![{ Displaystyle [ mathrm {H} ^ {+}] / [ mathrm {ATP}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e253bb9b194bd7dd88012ff9e7acd912dbf6931)
