Комплекс цитохрома b6f - Cytochrome b6f complex
| Комплекс цитохрома b6f | |||||||||
|---|---|---|---|---|---|---|---|---|---|
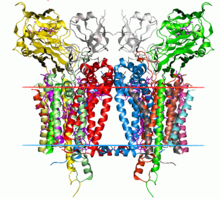 Кристаллическая структура комплекса цитохрома b6f из C. reinhardtii (1q90). Углеводородные границы липидный бислой показаны красными и синими линиями (сторона тилакоидного пространства и сторона стромы соответственно). | |||||||||
| Идентификаторы | |||||||||
| Символ | B6F | ||||||||
| Pfam | PF05115 | ||||||||
| ИнтерПро | IPR007802 | ||||||||
| TCDB | 3.D.3 | ||||||||
| OPM суперсемейство | 92 | ||||||||
| Белок OPM | 4pv1 | ||||||||
| Мембранома | 258 | ||||||||
| |||||||||
| Цитохром b6f комплекс | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.10.99.1 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
В цитохром б6ж сложный (пластохинол - пластоцианинредуктаза; EC 1.10.99.1 ) - это фермент, обнаруженный в тилакоид мембрана в хлоропласты растений, цианобактерии, и зеленые водоросли, который катализирует перенос электронов от пластохинол к пластоцианин.[1] Реакция аналогична реакции, катализируемой цитохром bc1 (Комплекс III) митохондриальный электронная транспортная цепь. В течение фотосинтез, цитохром b6f комплекс - это один шаг по цепочке, которая передает электроны из Фотосистема II к Фотосистема I, и в то же время закачивает протоны в тилакоидное пространство, что способствует созданию электрохимического (энергетического) градиента[2] который позже используется для синтеза АТФ из ADP.
Структура фермента
Цитохром b6f комплекс является димером, каждый мономер состоит из восьми субъединиц.[3] Они состоят из четырех больших субъединиц: 32 кДа цитохром f с цитохромом c-типа, 25 кДа цитохром b6 с группой гема с низким и высоким потенциалом, 19 кДа Железо-серный белок Риеске содержащий [2Fe-2S] кластер и субъединицу IV 17 кДа; вместе с четырьмя небольшими субъединицами (3-4 кДа): PetG, PetL, PetM и PetN.[3][4] Общая молекулярная масса 217 кДа.
Кристаллическая структура цитохрома b6f комплексы из Chlamydomonas reinhardtii, Мастигоклад ламинозный, и Носток sp. PCC 7120 были определены.[2][5][6][7][8][9]
Ядро комплекса структурно сходно с цитохромом bc.1 основной. Цитохром b6 и субъединица IV гомологичны цитохром b[10] и железо-серные белки Риске этих двух комплексов гомологичны.[11] Однако цитохром f и цитохром с1 не гомологичны.[12]
Цитохром b6f содержит семь протезные группы.[13][14] Четыре обнаружены в цитохроме b6f и bc1: гем цитохрома c типа c1 и f, два гема b-типа (bп и бп) в до н.э.1 и б6f и кластер [2Fe-2S] белка Риске. В цитохроме b обнаружены три уникальные простетические группы.6f: хлорофилл а, β-каротин, и гем cп (также известный как гем х).[5]
Межмономерное пространство в ядре димера комплекса цитохрома b6f занято липидами,[9] который обеспечивает направленность переноса электронов гем-гем за счет модуляции внутрибелкового диэлектрического окружения.[15]
Биологическая функция

В фотосинтез, цитохром b6f комплекс функционирует, чтобы опосредовать перенос электронов между двумя комплексами фотосинтетических реакционных центров, от Фотосистема II к Фотосистема I, при переносе протонов из стромы хлоропласта через тилакоид мембрана в просвет.[2] Электронный транспорт через цитохром b6f отвечает за создание протонный градиент что стимулирует синтез АТФ в хлоропластах.[4]
В отдельной реакции цитохром b6f-комплекс играет центральную роль в циклическое фотофосфорилирование, когда НАДФ+ не может принимать электроны от восстановленных ферредоксин.[1] Этот цикл приводит к созданию протонного градиента цитохромом b.6f, который можно использовать для управления синтезом АТФ. Также было показано, что этот цикл необходим для фотосинтеза,[16] в котором предлагается поддерживать надлежащее соотношение производства АТФ / НАДФН для фиксация углерода.[17][18]
Реакции депротонирования-окисления p-стороны хинола в комплексе цитохрома b6f вовлечены в образование активных форм кислорода.[19] Было высказано предположение, что интегральная молекула хлорофилла, расположенная в участке окисления хинола, выполняет структурную, нефотохимическую функцию, повышая скорость образования активных форм кислорода, возможно, обеспечивая окислительно-восстановительный путь для внутриклеточной коммуникации.[20]
Механизм реакции
Цитохром б6ж комплекс отвечает за "нециклический " (1) и "циклический " (2) перенос электронов между двумя мобильными окислительно-восстановительными носителями, пластохинон (QH2) и пластоцианин (ПК):
| ЧАС2О | → | фотосистема II | → | QH2 | → | Cyt б6ж | → | ПК | → | фотосистема I | → | НАДФН | (1) |
| QH2 | → | Cyt б6ж | → | ПК | → | фотосистема I | → | Q | (2) | ||||
Цитохром b6f катализирует перенос электронов от пластохинола к пластоцианину, перекачивая два протона из стромы в просвет тилакоида:
- QH2 + 2шт (Cu2+) + 2H+ (строма) → Q + 2Pc (Cu+) + 4H+ (люмен)[1]
Эта реакция происходит через Q цикл как в Комплексе III.[21] Пластохинон действует как переносчик электронов, переводя свои два электрона на высокий и низкий потенциал. цепи переноса электронов (ETC) через механизм, называемый бифуркацией электронов.[22] Комплекс содержит до трех молекул пластохинона (PQ), которые образуют сеть переноса электронов, которые отвечают за работу Q-цикла и его окислительно-восстановительные и каталитические функции в фотосинтезе.[23]
Q цикл

Первая половина Q-цикла
- QH2 связывается с положительной стороной «p» (стороной просвета) комплекса. Он окисляется до семихинон (SQ) железо-серным центром (высокопотенциальный ETC) и высвобождает два протона в просвет тилакоида.[нужна цитата ].
- Восстановленный центр железо-сера передает свой электрон через цитохром f на Pc.
- В низкопотенциальном ETC, SQ передает свой электрон гему bп цитохрома b6.
- Heme bп затем переносит электрон на гем bп.
- Heme bп восстанавливает Q одним электроном с образованием SQ.
Вторая половина Q цикла
- Второй QH2 связывается с комплексом.
- В ETC с высоким потенциалом один электрон восстанавливает окисленный Pc другим.
- В низкопотенциальном ЭТЦ электрон гема bп передается в SQ, а полностью приведенный Q2− забирает два протона из стромы с образованием QH2.
- Окисленный Q и восстановленный QH2 который был регенерирован, диффундирует в мембрану.
Циклический перенос электрона
В отличие от Комплекса III, цитохром b6f катализирует другую реакцию переноса электрона, которая является центральной для циклическое фотофосфорилирование. Электрон из ферредоксин (Fd) передается пластохинону, а затем цитохрому b6f для восстановления пластоцианина, который повторно окисляется P700 в Фотосистеме I.[24] Точный механизм восстановления пластохинона под действием ферредоксина все еще исследуется. Одно из предположений состоит в том, что существует ферредоксин: пластохинонредуктаза или НАДФ-дегидрогеназа.[24] Поскольку гем x, по-видимому, не требуется для цикла Q и не содержится в Комплексе III, было предложено использовать его для циклического фотофосфорилирования по следующему механизму:[22][25]
- Fd (красный) + гем x (окс) → Fd (окс) + гем x (красный)
- гем x (красный) + Fd (красный) + Q + 2H+ → гем x (ox) + Fd (ox) + QH2
Рекомендации
- ^ а б c Берг Дж. М., Тимочко Дж. Л., Страйер Л., Страйер Л. (2007). Биохимия. Нью-Йорк: W.H. Фримен. ISBN 978-0-7167-8724-2.
- ^ а б c Хасан С.С., Ямасита Э., Баниулис Д., Крамер В.А. (март 2013 г.). «Хинон-зависимые пути переноса протонов в фотосинтетическом комплексе цитохрома b6f». Труды Национальной академии наук Соединенных Штатов Америки. 110 (11): 4297–302. Дои:10.1073 / пнас.1222248110. ЧВК 3600468. PMID 23440205.
- ^ а б Whitelegge JP, Zhang H, Aguilera R, Taylor RM, Cramer WA (октябрь 2002 г.). «Жидкостная хроматография с полным охватом субъединиц, масс-спектрометрия с ионизацией электрораспылением (LCMS +) олигомерного мембранного белка: комплекса цитохрома b (6) f из шпината и цианобактерии Mastigocladus ламиносус». Молекулярная и клеточная протеомика. 1 (10): 816–27. Дои:10.1074 / mcp.m200045-mcp200. PMID 12438564.
- ^ а б Voet DJ, Voet JG (2011). Биохимия. Нью-Йорк, Нью-Йорк: Уайли, Дж. ISBN 978-0-470-57095-1.
- ^ а б Stroebel D, Choquet Y, Popot JL, Picot D (ноябрь 2003 г.). «Атипичный гем в комплексе цитохрома b (6) f». Природа. 426 (6965): 413–8. Дои:10.1038 / природа02155. PMID 14647374. S2CID 130033.
- ^ Ямасита Э., Чжан Х., Крамер В.А. (июнь 2007 г.). «Структура комплекса цитохрома b6f: ингибиторы аналогов хинона как лиганды гема cn». Журнал молекулярной биологии. 370 (1): 39–52. Дои:10.1016 / j.jmb.2007.04.011. ЧВК 1993820. PMID 17498743.
- ^ Баниулис Д., Ямасита Э., Уайтлегдж Дж. П., Зацман А. И., Хендрих депутат, Хасан С. С., Райан С. М., Крамер В. А. (апрель 2009 г.). «Структура-функция, стабильность и химическая модификация комплекса цианобактериального цитохрома b6f из Nostoc sp. PCC 7120». Журнал биологической химии. 284 (15): 9861–9. Дои:10.1074 / jbc.M809196200. ЧВК 2665108. PMID 19189962.
- ^ Хасан С.С., Стофлет Д.Т., Ямасита Э., Крамер В.А. (апрель 2013 г.). «Индуцированные липидами конформационные изменения в составе комплекса цитохрома b6f оксигенного фотосинтеза». Биохимия. 52 (15): 2649–54. Дои:10.1021 / bi301638h. ЧВК 4034689. PMID 23514009.
- ^ а б Хасан С.С., Крамер В.А. (июль 2014 г.). «Внутренняя липидная архитектура гетероолигомерного комплекса цитохрома b6f». Структура. 22 (7): 1008–15. Дои:10.1016 / j.str.2014.05.004. ЧВК 4105968. PMID 24931468.
- ^ Видгер WR, Крамер WA, Herrmann RG, Trebst A (февраль 1984 г.). «Гомология последовательностей и структурное сходство между цитохромом b митохондриального комплекса III и хлоропластным b6-f комплексом: положение гемов цитохрома b в мембране». Труды Национальной академии наук Соединенных Штатов Америки. 81 (3): 674–8. Дои:10.1073 / пнас.81.3.674. ЧВК 344897. PMID 6322162.
- ^ Каррелл С.Дж., Чжан Х., Крамер В.А., Смит Дж.Л. (декабрь 1997 г.). «Биологическая идентичность и разнообразие в фотосинтезе и дыхании: структура домена со стороны просвета хлоропластного белка Риске». Структура. 5 (12): 1613–25. Дои:10.1016 / s0969-2126 (97) 00309-2. PMID 9438861.
- ^ Мартинес С.Е., Хуанг Д., Щепаниак А., Крамер В.А., Смит Д.Л. (февраль 1994 г.). «Кристаллическая структура цитохрома f хлоропласта обнаруживает новую складку цитохрома и неожиданное лигирование гема». Структура. 2 (2): 95–105. Дои:10.1016 / s0969-2126 (00) 00012-5. PMID 8081747.
- ^ Baniulis D, Yamashita E, Zhang H, Hasan SS, Cramer WA (2008). «Структура-функция комплекса цитохрома b6f». Фотохимия и фотобиология. 84 (6): 1349–58. Дои:10.1111 / j.1751-1097.2008.00444.x. PMID 19067956.
- ^ Крамер В.А., Чжан Х., Ян Дж., Курису Г., Смит Дж. Л. (май 2004 г.). «Эволюция фотосинтеза: не зависящая от времени структура комплекса цитохрома b6f». Биохимия. 43 (20): 5921–9. Дои:10.1021 / bi049444o. PMID 15147175.
- ^ Хасан С.С., Захаров С.Д., Шове А., Стадницкий В., Савихин С., Крамер В.А. (июнь 2014 г.). «Карта диэлектрической гетерогенности в мембранном белке: гетероолигомерный комплекс цитохрома b6f». Журнал физической химии B. 118 (24): 6614–25. Дои:10.1021 / jp501165k. ЧВК 4067154. PMID 24867491.
- ^ Мунекаге Ю., Хашимото М., Мияке С., Томидзава К., Эндо Т., Тасака М., Шиканай Т. (июнь 2004 г.). «Циклический поток электронов вокруг фотосистемы I необходим для фотосинтеза». Природа. 429 (6991): 579–82. Дои:10.1038 / природа02598. PMID 15175756. S2CID 4421776.
- ^ Бланкеншип RE (2002). Молекулярные механизмы фотосинтеза. Оксфорд; Молден, Массачусетс: Blackwell Science. ISBN 978-0-632-04321-7.
- ^ Бендалл Д. (1995). «Циклическое фотофосфорилирование и электронный транспорт». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1229: 23–38. Дои:10.1016 / 0005-2728 (94) 00195-Б.
- ^ Баниулис Д., Хасан С.С., Стофлет Дж. Т., Крамер В.А. (декабрь 2013 г.). «Механизм повышенной продукции супероксида в комплексе цитохрома b (6) f кислородного фотосинтеза». Биохимия. 52 (50): 8975–83. Дои:10.1021 / bi4013534. ЧВК 4037229. PMID 24298890.
- ^ Хасан С.С., Проктор Е.А., Ямашита Е., Дохолян Н.В., Крамер В.А. (октябрь 2014 г.). «Движение внутри липопротеинового комплекса цитохрома b6f: закрытие хинонового портала». Биофизический журнал. 107 (7): 1620–8. Дои:10.1016 / j.bpj.2014.08.003. ЧВК 4190601. PMID 25296314.
- ^ Крамер В.А., Сориано Г.М., Пономарев М., Хуанг Д., Чжан Х., Мартинес С.Е., Смит Д.Л. (июнь 1996 г.). «Некоторые новые структурные аспекты и старые споры относительно комплекса цитохрома b6f кислородного фотосинтеза». Ежегодный обзор физиологии растений и молекулярной биологии растений. 47: 477–508. Дои:10.1146 / annurev.arplant.47.1.477. PMID 15012298.
- ^ а б Крамер В.А., Чжан Х., Ян Дж., Курису Г., Смит Дж. Л. (2006). «Трансмембранный трафик в комплексе цитохрома b6f». Ежегодный обзор биохимии. 75: 769–90. Дои:10.1146 / annurev.biochem.75.103004.142756. PMID 16756511.
- ^ Мэлоун Л.А., Цянь П., Майнеорд Г.Е., Хичкок А., Фармер Д.А., Томпсон Р.Ф. и др. (Ноябрь 2019 г.). «Крио-ЭМ структура комплекса цитохрома B 6 F шпината при разрешении 3,6 Å» (PDF). Природа. 575 (7783): 535–539. Дои:10.1038 / s41586-019-1746-6. PMID 31723268. S2CID 207987984.
- ^ а б Жолио П., Жолио А. (июль 2002 г.). «Циклический перенос электронов в листьях растений». Труды Национальной академии наук Соединенных Штатов Америки. 99 (15): 10209–14. Дои:10.1073 / pnas.102306999. ЧВК 126649. PMID 12119384.
- ^ Крамер В.А., Ян Дж., Чжан Х., Курису Дж., Смит Дж. Л. (2005). «Структура комплекса цитохрома b6f: новые простетические группы, Q-пространство и« гипотеза закуски »для сборки комплекса». Фотосинтез Исследования. 85 (1): 133–43. Дои:10.1007 / s11120-004-2149-5. PMID 15977064. S2CID 20731696.
внешняя ссылка
- Структурно-функциональные исследования цитохрома б6ж Сложный - Текущие исследования цитохрома б6ж в лаборатории Уильяма Крамера в Университете Пердью, США
- UMich Ориентация белков в мембранах семьи / суперсемейство-3 - Расчетное положение b6f и родственных комплексов в мембранах
- Цитохром + b6f + комплекс в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
