Синтаза жирных кислот - Fatty acid synthase
| Синтаза жирных кислот | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.85 | ||||||||
| Количество CAS | 9045-77-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| FASN | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||
| Псевдонимы | FASN, синтаза жирных кислот, Fasn, A630082H08Rik, FAS, OA-519, SDR27X1, синтаза жирных кислот | ||||||||||||||||||||||||
| Внешние идентификаторы | OMIM: 600212 MGI: 95485 ГомолоГен: 55800 Генные карты: FASN | ||||||||||||||||||||||||
| Номер ЕС | 2.3.1.85 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||
| Разновидность | Человек | Мышь | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ансамбль | |||||||||||||||||||||||||
| UniProt |
| ||||||||||||||||||||||||
| RefSeq (мРНК) | |||||||||||||||||||||||||
| RefSeq (белок) |
| ||||||||||||||||||||||||
| Расположение (UCSC) | Chr 17: 82.08 - 82,1 Мб | Chr 11: 120,81 - 120,82 Мб | |||||||||||||||||||||||
| PubMed поиск | [3] | [4] | |||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Синтаза жирных кислот (ФАС) является фермент что у людей кодируется FASN ген.[5][6][7][8]
Синтаза жирных кислот - мультифермент белок что катализирует синтез жирных кислот. Это не один фермент но целая ферментная система, состоящая из двух идентичных многофункциональных 272 кДа полипептиды, в котором субстраты передаются из одного функционального домена в другой.[9][10][11][12]
Его основная функция - катализировать синтез пальмитат (C16: 0, длинная цепь насыщенная жирная кислота ) из ацетил-КоА и малонил-КоА, в присутствии НАДФН.[8]
Жирные кислоты синтезируются декарбоксилированием. Клейзеновская конденсация реакция от ацетил-КоА и малонил-КоА. После каждого цикла удлинения бета-кетогруппа восстанавливается до полностью насыщенной углеродной цепи за счет последовательного действия кеторедуктаза (КР), дегидратаза (DH) и еноилредуктаза (ER). Растущая цепь жирных кислот переносится между этими активными центрами, будучи ковалентно присоединенной к фосфопантетеиновой простетической группе белок-носитель ацила (ACP), и выпускается действием тиоэстераза (TE) при достижении длины углеродной цепи 16 (пальмитиновая кислота).
Классы
Существует два основных класса синтаз жирных кислот.
- Системы типа I используют один большой многофункциональный полипептид и являются общими для обоих. животные и грибы (хотя структурное устройство синтаз грибов и животных различается). Система синтазы жирных кислот типа I также обнаружена в группе бактерий CMN (коринебактерии, микобактерии, и нокардия ). У этих бактерий система FAS I производит пальмитиновую кислоту и взаимодействует с системой FAS II для производства большего разнообразия липидных продуктов.[13]
- Тип II обнаружен в архее, бактериях и пластидах растений и характеризуется использованием дискретных монофункциональных ферментов для синтеза жирных кислот. Ингибиторы этого пути (FASII) исследуются по возможности. антибиотики.[14]
Механизм удлинения и восстановления FAS I и FAS II одинаков, поскольку домены ферментов FAS II в значительной степени гомологичны своим доменным аналогам в мультиферментных полипептидах FAS I. Однако различия в организации ферментов - интегрированных в FAS I и дискретных в FAS II - порождают многие важные биохимические различия.[15]
История эволюции синтаз жирных кислот во многом переплетается с историей поликетидсинтазы (ПКС). Поликетидсинтазы используют аналогичный механизм и гомологичные домены для производства липидов вторичных метаболитов. Кроме того, поликетидсинтазы также демонстрируют организацию типа I и типа II. Считается, что FAS I у животных возник в результате модификации PKS I у грибов, тогда как FAS I у грибов и группа бактерий CMN, по-видимому, возникли отдельно в результате слияния генов FAS II.[13]
Структура
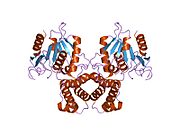
FAS млекопитающих состоит из гомодимера двух идентичных белковых субъединиц, в которых три каталитический домены в N-концевой секции (-кетоацилсинтаза (KS), малонил / ацетилтрансфераза (MAT) и дегидраза (DH)), разделены центральной областью из 600 остатков из четырех C-терминал домены (еноилредуктаза (ER), -кетоацилредуктаза (KR), белок-носитель ацила (ACP) и тиоэстераза (TE)).[16][17]
Традиционная модель организации FAS (см. Модель «голова к хвосту» справа) в значительной степени основана на наблюдениях, что бифункциональный реагент 1,3-дибромпропанон (DBP) может сшивать активный сайт. цистеин тиол домена KS в одном мономере ФАС с фосфопантетеин простетическая группа домена ACP в другом мономере.[18][19] Анализ комплементации димеров FAS, несущих различные мутации на каждом мономере, показал, что домены KS и MAT могут взаимодействовать с ACP любого мономера.[20][21] и повторное исследование экспериментов по сшиванию DBP показало, что тиол Cys161 активного сайта KS может быть сшит с ACP 4'-фосфопантетеин тиол любого мономера.[22] Кроме того, недавно сообщалось, что гетеродимерный ФАС, содержащий только один компетентный мономер, способен к синтезу пальмитата.[23]
Вышеупомянутые наблюдения казались несовместимыми с классической моделью «голова к хвосту» для организации FAS, и была предложена альтернативная модель, предсказывающая, что домены KS и MAT обоих мономеров расположены ближе к центру димера FAS, где они находятся. может получить доступ к ACP любого из субъединиц (см. рисунок вверху справа).[24]
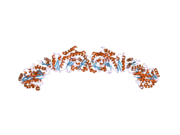
Рентгеновская кристаллография с низким разрешением обеих свиней (гомодимер)[25] и дрожжевой ФАС (гетерододекамер)[26] вместе со структурой дрожжевой ФАС с разрешением ~ 6 Å электронной крио-микроскопией (крио-ЭМ) [27] были решены.
Механизм перемещения субстрата
Решенные структуры дрожжевого FAS и FAS млекопитающих показывают две различные организации высококонсервативных каталитических доменов / ферментов в этой мультиферментной клеточной машине. Дрожжевой FAS имеет высокоэффективную жесткую бочкообразную структуру с 6 реакционными камерами, которые синтезируют жирные кислоты независимо, тогда как FAS млекопитающих имеет открытую гибкую структуру только с двумя реакционными камерами. Однако в обоих случаях консервативный АСР действует как мобильный домен, ответственный за транспортировку промежуточных субстратов жирных кислот к различным каталитическим сайтам. Первое прямое структурное понимание этого механизма челночного перемещения субстрата было получено с помощью крио-ЭМ анализа, при котором наблюдается связывание ACP с различными каталитическими доменами в бочкообразной синтазе жирных кислот дрожжей.[27] Результаты крио-ЭМ предполагают, что связывание ACP с различными сайтами является асимметричным и стохастическим, на что также указывают исследования компьютерного моделирования.[28]
 Обновленная модель FAS с позициями полипептидов, три каталитический домены и соответствующие им реакции, визуализация Коси Граматикофф. Обратите внимание, что FAS активен только как гомодимер, а не как изображенный мономер. |  Модель FAS «голова-к-хвосту» с положениями полипептидов, три каталитический домены и соответствующие им реакции, визуализация Коси Граматикофф. |
Регулирование
Метаболизм и гомеостаз синтазы жирных кислот транскрипционно регулируется вышестоящими стимулирующими факторами (USF1 и USF2 ) и белок, связывающий регуляторный элемент стерола -1c (SREBP-1c) в ответ на кормление / инсулин у живых животных.[29][30]
Несмотря на то что Х-рецептор печени (LXR) модулируют экспрессию белок, связывающий регуляторный элемент стерола -1c (SREBP-1c) при кормлении, регуляция FAS с помощью SREBP-1c зависит от USF.[30][31][32][33]
Ацилфлороглюцинолы изолирован от папоротника Dryopteris crassirhizoma проявляют ингибирующую активность в отношении синтазы жирных кислот.[34]
Клиническое значение
Ген, кодирующий FAS, был исследован как возможный онкоген.[35] ФАС - это усиленный при раке груди и желудка, а также как индикатор плохого прогноза, также может быть полезной в качестве химиотерапевтической цели.[36][37][38] ФАС ингибиторы поэтому являются активной областью открытие лекарств исследование.[39][40][41][42]
ФАС также может участвовать в производстве эндогенного лиганд для ядерного рецептора PPARальфа, цель фибрат препараты от гиперлипидемии,[43] и исследуется как возможная лекарственная мишень для лечения метаболического синдрома.[44] Орлистат который является ингибитором липазы желудочно-кишечного тракта, также ингибирует ФАС и имеет потенциал как лекарство от рака.[45][46]
В некоторых линиях раковых клеток этот белок был слит с рецептор эстрогена альфа (ER-альфа), в котором N-конец ФАС совмещен в рамке с C-конец ER-alpha.[8]
Ассоциация с лейомиома матки было сообщено.[47]
Смотрите также
- Открытие и разработка ингибиторов желудочно-кишечной липазы
- Синтез жирных кислот
- Метаболизм жирных кислот
- Разложение жирных кислот
- Редуктаза белка-носителя еноилацила
- Список нарушений обмена жирных кислот
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000169710 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000025153 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Джаякумар А., Чирала СС, Чиналт А.С., Балдини А., Абу-Эльхейга Л., Вакил С.Дж. (февраль 1995 г.). «Выделение и картирование хромосом геномных клонов, кодирующих ген синтазы жирных кислот человека». Геномика. 23 (2): 420–424. Дои:10.1006 / geno.1994.1518. PMID 7835891.
- ^ Джаякумар А., Тай М.Х., Хуанг В.Й., аль-Фил В., Су М., Абу-Эльхейга Л., Чирала С.С., Вакил С.Дж. (октябрь 1995 г.). «Синтаза жирных кислот человека: свойства и молекулярное клонирование». Труды Национальной академии наук Соединенных Штатов Америки. 92 (19): 8695–8699. Bibcode:1995PNAS ... 92.8695J. Дои:10.1073 / пнас.92.19.8695. ЧВК 41033. PMID 7567999.
- ^ Перссон Б., Каллберг И., Брей Дж. Э., Бруфорд Е., Деллапорта С. Л., Фавиа А. Д., Дуарте Р. Г., Йорнвалл Х., Кавана К. Л., Кедишвили Н., Кисиела М., Мазер Е., Минднич Р., Орчард С., Пеннинг TM, Торнтон Д. М., Адамски Дж. , Oppermann U (февраль 2009 г.). «Инициатива по номенклатуре SDR (короткоцепочечная дегидрогеназа / редуктаза и родственные ферменты)». Химико-биологические взаимодействия. 178 (1–3): 94–98. Дои:10.1016 / j.cbi.2008.10.040. ЧВК 2896744. PMID 19027726.
- ^ а б c «Энтрез Ген: синтаза жирных кислот FASN».
- ^ Альбертс А.В., Штраус А.В., Хеннесси С., Вагелос PR (октябрь 1975 г.). «Регуляция синтеза синтетазы жирных кислот печени: связывание антител синтетазы жирных кислот с полисомами». Труды Национальной академии наук Соединенных Штатов Америки. 72 (10): 3956–3960. Bibcode:1975PNAS ... 72.3956A. Дои:10.1073 / пнас.72.10.3956. ЧВК 433116. PMID 1060077.
- ^ Ступс Дж. К., Арсланян М. Дж., О Й. Х., Ауне К. К., Ванаман Т. К., Вакил С. Дж. (Май 1975 г.). «Наличие двух полипептидных цепей, содержащих синтетазу жирных кислот». Труды Национальной академии наук Соединенных Штатов Америки. 72 (5): 1940–1944. Bibcode:1975ПНАС ... 72.1940С. Дои:10.1073 / пнас.72.5.1940. ЧВК 432664. PMID 1098047.
- ^ Смит С., Агради Э., Либертини Л., Дилипан К.Н. (апрель 1976 г.). «Специфическое высвобождение тиоэстеразного компонента мультиферментного комплекса синтетазы жирных кислот путем ограниченной трипсинизации». Труды Национальной академии наук Соединенных Штатов Америки. 73 (4): 1184–1188. Bibcode:1976ПНАС ... 73.1184С. Дои:10.1073 / pnas.73.4.1184. ЧВК 430225. PMID 1063400.
- ^ Смит С., Витковски А., Джоши А. К. (июль 2003 г.). «Структурно-функциональная организация синтазы жирных кислот животных». Прогресс в исследованиях липидов. 42 (4): 289–317. Дои:10.1016 / S0163-7827 (02) 00067-X. PMID 12689621.
- ^ а б Jenke-Kodama H, Sandmann A, Müller R, Dittmann E (октябрь 2005 г.). «Эволюционные последствия бактериальных поликетидсинтаз». Молекулярная биология и эволюция. 22 (10): 2027–2039. Дои:10.1093 / molbev / msi193. PMID 15958783.
- ^ Фулмер Т. (март 2009 г.). «Не так ФАС». Биржа науки и бизнеса. 2 (11): 430. Дои:10.1038 / scibx.2009.430.
- ^ Стивенс Л., Прайс NC (1999). Основы энзимологии: клеточная и молекулярная биология каталитических белков. Оксфорд [Оксфордшир]: Издательство Оксфордского университета. ISBN 978-0-19-850229-6.
- ^ Чирала С.С., Джаякумар А., Гу З.В., Вакиль С.Дж. (март 2001 г.). «Синтаза жирных кислот человека: роль междомена в образовании каталитически активного димера синтазы». Труды Национальной академии наук Соединенных Штатов Америки. 98 (6): 3104–3108. Bibcode:2001PNAS ... 98.3104C. Дои:10.1073 / pnas.051635998. ЧВК 30614. PMID 11248039.
- ^ Смит С. (декабрь 1994 г.). «Синтаза жирных кислот животных: один ген, один полипептид, семь ферментов». Журнал FASEB. 8 (15): 1248–1259. Дои:10.1096 / fasebj.8.15.8001737. PMID 8001737. S2CID 22853095.
- ^ Ступс Дж. К., Вакил С. Дж. (Май 1981 г.). «Синтетаза жирных кислот животных. Новое расположение сайтов бета-кетоацилсинтетазы, содержащих домены двух субъединиц». Журнал биологической химии. 256 (10): 5128–5133. PMID 6112225.
- ^ Ступс Дж. К., Вакил С. Дж. (Март 1982 г.). «Синтетаза жирных кислот животных. Идентификация остатков, составляющих новое расположение сайта бета-кетоацилсинтетазы, и их роль в его инактивации холода». Журнал биологической химии. 257 (6): 3230–3235. PMID 7061475.
- ^ Джоши А.К., Ранган В.С., Смит С. (февраль 1998 г.). «Дифференциальное аффинное мечение двух субъединиц гомодимерной синтазы жирных кислот животных позволяет выделить гетеродимеры, состоящие из субъединиц, которые были независимо модифицированы». Журнал биологической химии. 273 (9): 4937–4943. Дои:10.1074 / jbc.273.9.4937. PMID 9478938.
- ^ Ранган В.С., Джоши А.К., Смит С. (сентябрь 2001 г.). «Картирование функциональной топологии синтазы жирных кислот животных путем мутантной комплементации in vitro». Биохимия. 40 (36): 10792–18799. Дои:10.1021 / bi015535z. PMID 11535054.
- ^ Витковски А., Джоши А.К., Ранган В.С., Фалик А.М., Витковска Х.Э., Смит С. (апрель 1999 г.). «Дибромпропаноновое сшивание фосфопантетеина и цистеиновых тиолов в активном центре синтазы жирных кислот животного происхождения может происходить как внутри, так и между субъединицами. Переоценка модели параллельных антипараллельных субъединиц». Журнал биологической химии. 274 (17): 11557–11563. Дои:10.1074 / jbc.274.17.11557. PMID 10206962.
- ^ Джоши А.К., Ранган В.С., Витковски А., Смит С. (февраль 2003 г.). «Разработка активного димера синтазы жирных кислот животных только с одной компетентной субъединицей». Химия и биология. 10 (2): 169–173. Дои:10.1016 / S1074-5521 (03) 00023-1. PMID 12618189.
- ^ Астуриас Ф.Д., Чадик Дж. З., Чунг И. К., Старк Х., Витковски А., Джоши А. К., Смит С. (март 2005 г.). «Структура и молекулярная организация синтазы жирных кислот млекопитающих». Структурная и молекулярная биология природы. 12 (3): 225–232. Дои:10.1038 / nsmb899. PMID 15711565. S2CID 6132878.
- ^ Майер Т., Лейбундгут М., Бан Н. (сентябрь 2008 г.). «Кристаллическая структура синтазы жирных кислот млекопитающих». Наука. 321 (5894): 1315–1322. Bibcode:2008Научный ... 321.1315M. Дои:10.1126 / science.1161269. PMID 18772430. S2CID 3168991.
- ^ Ломакин И.Б., Сюн Ю., Стейтц Т.А. (апрель 2007 г.). «Кристаллическая структура дрожжевой синтазы жирных кислот, клеточная машина с восемью активными центрами, работающими вместе». Клетка. 129 (2): 319–332. Дои:10.1016 / j.cell.2007.03.013. PMID 17448991. S2CID 8209424.
- ^ а б Гипсон П., Миллс Д. Д., Ваутс Р., Гринингер М., Вонк Дж., Кюльбрандт В. (май 2010 г.). «Прямое структурное понимание механизма перемещения субстрата дрожжевой синтазы жирных кислот с помощью электронной криомикроскопии». Труды Национальной академии наук Соединенных Штатов Америки. 107 (20): 9164–9169. Bibcode:2010PNAS..107.9164G. Дои:10.1073 / pnas.0913547107. ЧВК 2889056. PMID 20231485.
- ^ Ансельми К., Гринингер М., Гипсон П., Фаральдо-Гомес Дж. Д. (сентябрь 2010 г.). «Механизм перемещения субстрата белком-ацилом-носителем в мега-синтазе жирных кислот». Журнал Американского химического общества. 132 (35): 12357–12364. Дои:10.1021 / ja103354w. PMID 20704262.
- ^ Паулаускис Дж. Д., Сул Х. С. (январь 1989 г.). «Гормональная регуляция транскрипции гена синтазы жирных кислот мыши в печени». Журнал биологической химии. 264 (1): 574–577. PMID 2535847.
- ^ а б Латаса MJ, Гриффин MJ, Мун Ю.С., Кан Ч., Сул Х.С. (август 2003 г.). «Занятость и функция регуляторного элемента -150 стеролов и -65 E-бокса в регуляции питания гена синтазы жирных кислот у живых животных». Молекулярная и клеточная биология. 23 (16): 5896–5907. Дои:10.1128 / MCB.23.16.5896-5907.2003. ЧВК 166350. PMID 12897158.
- ^ Гриффин М.Дж., Вонг Р.Х., Пандья Н., Сул Х.С. (февраль 2007 г.). «Прямое взаимодействие между USF и SREBP-1c опосредует синергетическую активацию промотора синтазы жирных кислот». Журнал биологической химии. 282 (8): 5453–5467. Дои:10.1074 / jbc.M610566200. PMID 17197698.
- ^ Йошикава Т., Шимано Х, Амемия-Кудо М, Яхаги Н., Хэсти А.Х., Мацудзака Т, Окадзаки Х, Тамура Й, Иидзука Й, Охаши К., Осуга Дж, Харада К., Готода Т, Кимура С., Ишибаши С., Ямада Н. ( Май 2001 г.). «Идентификация рецептора X печени-ретиноида X рецептора в качестве активатора промотора гена белка 1c, связывающего регуляторный элемент стерола». Молекулярная и клеточная биология. 21 (9): 2991–3000. Дои:10.1128 / MCB.21.9.2991-3000.2001. ЧВК 86928. PMID 11287605.
- ^ Repa JJ, Liang G, Ou J, Bashmakov Y, Lobaccaro JM, Shimomura I, Shan B, Brown MS, Goldstein JL, Mangelsdorf DJ (ноябрь 2000 г.). «Регулирование гена белка-1c, связывающего регуляторный элемент мышиного стерола (SREBP-1c), рецепторами оксистерола, LXRalpha и LXRbeta». Гены и развитие. 14 (22): 2819–2830. Дои:10.1101 / gad.844900. ЧВК 317055. PMID 11090130.
- ^ Na M, Jang J, Min BS, Lee SJ, Lee MS, Kim BY, Oh WK, Ahn JS (сентябрь 2006 г.). «Активность ацилфлороглюцинолов, выделенных из Dryopteris crassirhizoma, ингибирующая синтазу жирных кислот». Письма по биоорганической и медицинской химии. 16 (18): 4738–4742. Дои:10.1016 / j.bmcl.2006.07.018. PMID 16870425.
- ^ Барон А., Мигита Т., Тан Д., Лода М. (январь 2004 г.). «Синтаза жирных кислот: метаболический онкоген при раке простаты?». Журнал клеточной биохимии. 91 (1): 47–53. Дои:10.1002 / jcb.10708. PMID 14689581. S2CID 26175683.
- ^ Hunt DA, Lane HM, Zygmont ME, Dervan PA, Hennigar RA (2007). «Стабильность МРНК и сверхэкспрессия синтазы жирных кислот в клеточных линиях рака груди человека». Противораковые исследования. 27 (1A): 27–34. PMID 17352212.
- ^ Ганслер Т.С., Хардман В., Хант Д.А., Шаффель С., Хеннигар Р.А. (июнь 1997 г.). «Повышенная экспрессия синтазы жирных кислот (OA-519) в новообразованиях яичников предсказывает более короткую выживаемость». Патология человека. 28 (6): 686–692. Дои:10.1016 / S0046-8177 (97) 90177-5. PMID 9191002.
- ^ Ezzeddini R, Taghikhani M, Somi MH, Samadi N, Rasaee, MJ (май 2019 г.). «Клиническое значение FASN по отношению к HIF-1α и SREBP-1c при аденокарциноме желудка». Науки о жизни. 224: 169–176. Дои:10.1016 / j.lfs.2019.03.056. PMID 30914315.
- ^ «Первое исследование на людях с ингибитором синтазы жирных кислот». oncotherapynetwork.com. 7 апреля 2017 года.
- ^ Лу Т., Шуберт К., Каммингс, доктор медицины, Биньян Дж., Коннолли П.Дж., Сманс К., Людовичи Д., Паркер М.Х., Мейер К., Рокабой С., Александр Р., Грасбергер Б., Де Брекер С., Эссер Н., Фраипонц Е., Гилиссен Р., Янссенс Б., Пеэтерс Д., Ван Наффель Л., Вермёлен П., Бишофф Дж., Мерпоэль Л. (май 2018 г.). «Разработка и синтез серии ингибиторов домена KR биодоступной синтазы жирных кислот (FASN) для лечения рака». Письма по биоорганической и медицинской химии. 28 (12): 2159–2164. Дои:10.1016 / j.bmcl.2018.05.014. PMID 29779975.
- ^ Hardwicke MA, Rendina AR, Williams SP, Moore ML, Wang L, Krueger JA, Plant RN, Totoritis RD, Zhang G, Briand J, Burkhart WA, Brown KK, Parrish CA (сентябрь 2014 г.). «Ингибитор синтазы жирных кислот человека связывает β-кетоацилредуктазу в сайте кето-субстрата». Природа Химическая Биология. 10 (9): 774–779. Дои:10.1038 / nchembio.1603. PMID 25086508.
- ^ Vander Heiden MG, DeBerardinis RJ (февраль 2017 г.). «Понимание взаимосвязей между метаболизмом и биологией рака». Клетка. 168 (4): 657–669. Дои:10.1016 / j.cell.2016.12.039. ЧВК 5329766. PMID 28187287.
- ^ Чакраварти М.В., Лодхи И.Дж., Инь Л., Малапака Р.Р., Сюй Х.Э., Тюрк Дж., Семенкович К.Ф. (август 2009 г.). «Идентификация физиологически значимого эндогенного лиганда PPARalpha в печени». Клетка. 138 (3): 476–488. Дои:10.1016 / j.cell.2009.05.036. ЧВК 2725194. PMID 19646743.
- ^ Wu M, Singh SB, Wang J, Chung CC, Salituro G, Karanam BV, Lee SH, Powles M, Ellsworth KP, Lassman ME, Miller C, Myers RW, Tota MR, Zhang BB, Li C (март 2011 г.). «Антидиабетические и антистеатотические эффекты селективного ингибитора синтазы жирных кислот (FAS) платенсимицина на мышиных моделях диабета». Труды Национальной академии наук Соединенных Штатов Америки. 108 (13): 5378–5383. Bibcode:2011PNAS..108.5378W. Дои:10.1073 / pnas.1002588108. ЧВК 3069196. PMID 21389266.
- ^ Флавин Р., Пелусо С., Нгуен П.Л., Лода М. (апрель 2010 г.). «Синтаза жирных кислот как потенциальная терапевтическая мишень при раке». Будущая онкология. 6 (4): 551–562. Дои:10.2217 / fon.10.11. ЧВК 3197858. PMID 20373869.
- ^ Ричардсон Р.Д., Ма Дж., Ойола Ю., Занканелла М., Ноулз Л. М., Циплак П., Ромо Д., Смит Дж. В. (сентябрь 2008 г.). «Синтез новых бета-лактонных ингибиторов синтазы жирных кислот». Журнал медицинской химии. 51 (17): 5285–5296. Дои:10.1021 / jm800321h. ЧВК 3172131. PMID 18710210.
- ^ Эггерт С.Л., Хайк К.Л., Сомасундарам П., Кавалла Р., Стюарт Э.А., Лу А.Т., Пейнтер Дж.Н., Монтгомери Г.В., Медланд С.Е., Найхолт Д.Р., Treloar SA, Зондерван К.Т., Хит А.С., Мэдден П.А., Роуз Л., Беринг Д.Э., Ридкер П.М. , Часман Д.И., Мартин Н.Г., Кантор Р.М., Мортон С.К. (2012). «Полногеномный анализ сцепления и ассоциации указывает на предрасположенность FASN к лейомиомам матки». Американский журнал генетики человека. 91 (4): 621–628. Дои:10.1016 / j.ajhg.2012.08.009. ЧВК 3484658. PMID 23040493.
дальнейшее чтение
- Вакил SJ (1989). «Синтаза жирных кислот, эффективный многофункциональный фермент». Биохимия. 28 (11): 4523–4530. Дои:10.1021 / bi00437a001. PMID 2669958.
- Барон А., Мигита Т., Тан Д., Лода М. (2004). «Синтаза жирных кислот: метаболический онкоген при раке простаты?». Журнал клеточной биохимии. 91 (1): 47–53. Дои:10.1002 / jcb.10708. PMID 14689581. S2CID 26175683.
- Леджин Д. (1978). «[Вискозиметрия в клинической практике]». Medicinski Pregled. 30 (9–10): 477–482. PMID 600212.
- Вронковский Z (1976). «[Диагностика рака дыхательной системы]». Пелонгнярка I Полозна (12): 7–8. PMID 1044453.
- Семенкович CF, Coleman T, Fiedorek FT (1995). «Человеческая мРНК синтазы жирных кислот: распределение в тканях, генетическое картирование и кинетика распада после депривации глюкозы». Журнал липидных исследований. 36 (7): 1507–1521. PMID 7595075.
- Кухайда Ф.П., Дженнер К., Вуд Ф.Д., Хеннигар Р.А., Джейкобс Л.Б., Дик Дж.Д., Пастернак Г.Р. (1994). «Синтез жирных кислот: потенциальная селективная мишень для противоопухолевой терапии». Труды Национальной академии наук Соединенных Штатов Америки. 91 (14): 6379–6383. Bibcode:1994PNAS ... 91.6379K. Дои:10.1073 / pnas.91.14.6379. ЧВК 44205. PMID 8022791.
- Сюй М.Х., Чирала С.С., Вакил С.Дж. (1996). «Ген синтазы жирных кислот человека. Доказательства наличия двух промоторов и их функционального взаимодействия». Журнал биологической химии. 271 (23): 13584–13592. Дои:10.1074 / jbc.271.23.13584. PMID 8662758.
- Пизер Е.С., Курман Р.Дж., Пастернак Г.Р., Кухайда Ф.П. (1997). «Экспрессия синтазы жирных кислот тесно связана с пролиферацией и децидуализацией стромы в циклическом эндометрии». Международный журнал гинекологической патологии. 16 (1): 45–51. Дои:10.1097/00004347-199701000-00008. PMID 8986532. S2CID 45195801.
- Джаякумар А., Чирала С.С., Вакил С.Дж. (1997). «Синтаза жирных кислот человека: сборка рекомбинантных половин белка субъединицы синтазы жирных кислот восстанавливает активность фермента». Труды Национальной академии наук Соединенных Штатов Америки. 94 (23): 12326–12330. Bibcode:1997PNAS ... 9412326J. Дои:10.1073 / пнас.94.23.12326. ЧВК 24928. PMID 9356448.
- Кусакабэ Т., Маэда М., Хоши Н., Сугино Т., Ватанабэ К., Фукуда Т., Судзуки Т. (2000). «Синтаза жирных кислот экспрессируется в основном в чувствительных к гормонам клетках взрослых или клетках с высоким метаболизмом липидов и в пролиферирующих клетках плода». Журнал гистохимии и цитохимии. 48 (5): 613–622. Дои:10.1177/002215540004800505. PMID 10769045.
- Йе Кью, Чанг Л.В., Ли С., Чжау Х.Э. (2000). «Идентификация нового слитого транскрипта FAS / ER-alpha, экспрессируемого в раковых клетках человека». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1493 (3): 373–377. Дои:10.1016 / s0167-4781 (00) 00202-5. PMID 11018265.
- Роша-Штайнер В., Беккер К., Мишо О., Шнайдер П., Бернс К., Чопп Дж. (2000). «FIST / HIPK3: Fas / FADD-взаимодействующая серин / треониновая киназа, которая индуцирует фосфорилирование FADD и ингибирует опосредованную fas активацию NH (2) -концевой киназы Jun». Журнал экспериментальной медицины. 192 (8): 1165–1174. Дои:10.1084 / jem.192.8.1165. ЧВК 2311455. PMID 11034606.
- Чирала С.С., Джаякумар А., Гу З.В., Вакил С.Дж. (2001). «Синтаза жирных кислот человека: роль междомена в образовании каталитически активного димера синтазы». Труды Национальной академии наук Соединенных Штатов Америки. 98 (6): 3104–3108. Bibcode:2001PNAS ... 98.3104C. Дои:10.1073 / pnas.051635998. ЧВК 30614. PMID 11248039.
- Бринк Дж., Людтке С.Дж., Янг С.Й., Гу З.В., Вакиль С.Дж., Чиу В. (2002). «Четвертичная структура синтазы жирных кислот человека с помощью электронной криомикроскопии». Труды Национальной академии наук Соединенных Штатов Америки. 99 (1): 138–143. Bibcode:2002ПНАС ... 99..138Б. Дои:10.1073 / pnas.012589499. ЧВК 117528. PMID 11756679.
- Джозеф С.Б., Лаффитт Б.А., Патель PH, Уотсон М.А., Мацукума К.Э., Вальчак Р., Коллинз Дж. Л., Осборн Т.Ф., Тонтоноз П. (2002). «Прямые и косвенные механизмы регуляции экспрессии гена синтазы жирных кислот X-рецепторами печени». Журнал биологической химии. 277 (13): 11019–11025. Дои:10.1074 / jbc.M111041200. PMID 11790787.
- Мин Д., Конг Й., Вакил С.Дж., Бринк Дж., Ма Дж. (2002). «Движение доменов в синтазе жирных кислот человека с помощью квантованной модели упругой деформации». Труды Национальной академии наук Соединенных Штатов Америки. 99 (12): 7895–7899. Bibcode:2002PNAS ... 99.7895M. Дои:10.1073 / pnas.112222299. ЧВК 122991. PMID 12060737.
- Филд FJ, Born E, Murthy S, Mathur SN (2003). «Полиненасыщенные жирные кислоты снижают экспрессию белка-1, связывающего регуляторный элемент стерола, в клетках CaCo-2: влияние на синтез жирных кислот и транспорт триацилглицерина». Биохимический журнал. 368 (Pt 3): 855–864. Дои:10.1042 / BJ20020731. ЧВК 1223029. PMID 12213084.
внешняя ссылка
- Жир + кислота + синтаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Синтез жирных кислот: Политехнический институт Ренсселера
- Синтаза жирных кислот: молекула месяца RCSB PDB
- Структуры синтазы жирных кислот, полученные с помощью трехмерной электронной микроскопии, из EM Data Bank (EMDB)
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для синтазы жирных кислот человека